基于细菌学研究改性生物炭对抗生素的降解机制
2021-04-30简宏先王翠苹
杨 芳,简宏先,高 越,王翠苹
基于细菌学研究改性生物炭对抗生素的降解机制
杨 芳,简宏先,高 越,王翠苹*
(南开大学环境科学与工程学院,环境污染过程及基准教育部重点实验室,天津市环境修复和控制实验室,天津 300071)
分别选取3个裂解温度下制备的改性生物炭——MBC350,MBC500和MBC700,2种抗生素——磺胺甲噁唑(SMX)和氯霉素(CAP),考察MBCs对SMX和CAP生物降解的影响及生物降解过程中和的细菌学特征.结果表明,在低浓度MBCs培养的细菌体系中,SMX和CAP的去除主要依靠细菌和的生物降解;而在高浓度MBCs培养的细菌体系中,SMX和CAP的去除主要依靠MBCs的吸附.其主要是由于随着MBCs浓度的增加,对SMX和CAP的吸附量提高,同时促进细菌的繁殖,导致溶液中较少的SMX和CAP被细菌生物降解.MBCs提高了细胞膜中饱和脂肪酸含量,抑制了中饱和脂肪酸的合成.特别是中脂肪酸C10:0和C15:1,cis-10消失;而中逆式脂肪酸C14:1,cis-9和C15:1,cis-10生成.此外,应用基因绝对定量技术发现MBCs显著提高了细菌的基因表达拷贝数,抑制了的基因表达拷贝数.但细菌和的基因表达拷贝数均随着MBCs浓度的增加而增加.因此,本研究表明低浓度MBCs有利于SMX和CAP的生物降解,而高浓度MBCs促进细菌的生长量,脂肪酸和基因表达拷贝数.
抗生素;改性生物炭;生物降解;细菌生长量;脂肪酸;基因表达拷贝数
磺胺甲恶唑(SMX)和氯霉素(CAP)是使用较广的广谱性抗菌药物,被广泛应用于畜牧业和水产养殖中,主要通过干扰和抑制细菌的生长与繁殖,来治疗或预防细菌感染性疾病[1].基于SMX和CAP具有复杂的结构和抗菌特性,其不能被生物有机体完全吸收,约有40%~90%以母体或代谢产物的形式随尿液或粪便排出体外[2],由于具有较强的亲水性,导致其最终进入地表和地下水环境中[3].SMX和CAP持续暴露将导环境微生物产生抗性(耐药性),这些耐药菌所携带的抗性基因可以在不同细菌之间传递,引发超级耐药致病菌的产生,危害人体健康[4-5],因此,去除水体中残留的SMX和CAP引起了广泛关注.
生物炭具有比表面积大、孔结构复杂及特殊的官能团等理化性质[6-8],因此,常被用于对污染物吸附和固定[9-10].同时,由于含有丰富的C、N、S、P和K等营养元素,可为微生物生长提供基质.因此,在生物炭作用下,能提高微生物对污染物的生物降解[11-13].此外,基于一些特殊环境污染物治理和机制的阐述需求,生物炭常被进行化学改性,一旦经过改性,其理化性质随之发生巨大的改变[8].然而目前针对改性生物炭对微生物降解的影响和机制未有详细报道.因此基于细菌学研究改性生物炭对抗生素的生物降解机制具有深远的环境意义.
本研究以酸改性水稻秸秆生物炭为材料,研究改性生物炭对微生物降解SMX和CAP的影响,进而从改性生物炭对微生物细菌学特征的影响,如生长量、脂肪酸组成和含量、细菌基因表达拷贝数的影响角度,解释改性生物炭对抗生素生物降解的影响和机制,为生物炭联合微生物技术提供理论研究参考,并为去除环境中抗生素的应用提供参考.
1 材料与方法
1.1 实验材料
SMX和CAP,纯度³98%,购买于Aladdin试剂平台.此外,2X ChamQ SYBR COLOR qPCR Master Mix(Q411-02/03)和PCR引物(PAGE纯化)分别购买于南京诺唯赞生物科技有限公司和生工生物工程(上海)股份有限公司;八连管和DL2000分别购买于爱思进生物炭科技(杭州)有限公司和上海捷瑞生物炭工程有限公司;EX Taq 酶,dNTP,10×EX Taq Buffer,和pMD18-T Vector购买于宝日医生物技术(北京)有限公司.FAST DNA spin kit for soil 试剂盒和感受态细胞(Top-10)分别购买于MP Biomedicals和天根生化科技(北京)有限公司.PCR产物纯化试剂和质粒提取试剂均由北京美吉桑格生物医药科技有限公司自制.
菌种:(; ATCC17588),(; ATCCBAA- 1097)均购于广东省微生物研究所菌种保藏中心,并与4℃冰箱保存备用.
蛋白胨牛肉膏营养液(NM):称取5.0g牛肉膏,10g蛋白胨,和5.0g的NaCl溶解于1.0L蒸馏水中,利用0.1mol/L的HCl和NaOH调节溶液pH值为7.0±0.1.使用0.22µm滤膜滤掉杂质后,在121℃(1.05MPa)高温高压下灭菌30min后,置于超净台备用.称取15g琼脂添加于上述的NM中制成固体蛋白胨牛肉膏培养基(NA)待用.
无机盐培养液(MM):称取1.5g的KH2PO4,1.0g的NaCl,5.0g的K2HPO4·3H2O,0.4g的MgSO4·7H2O,及1mL的痕量元素于1.0L蒸馏水中,并用0.1mol/L的HCl和NaOH调节溶液pH值为7.0±0.1,用0.22µm滤膜滤掉杂质后,在121℃(1.05MPa)高温高压下灭菌30min后,置于超净台备用.
痕量元素组成:准确称取0.2g ZnSO4·2H2O,2.0g NaHCO3,0.02g (NH4)6Mo7O2·4H2O,0.3g MnSO4·3H2O, 0.5g的FeSO4·5H2O和0.1g的CuSO4·12H2O,及0.5g的CoCl2·5H2O,0.05g CaCl2·2H2O,溶于1.0L蒸馏水待用.
生物炭(BCs)的制备:本研究中水稻秸秆取自中国山东日照的某农田,其主要制备步骤如下:首先将收集的水稻秸秆用蒸馏水清洗、晒干、粉碎过60目筛备用;称取适量的生物质于石英舟中,并将其放入管式炉(型号:SK-G08123K,天津中环电炉股份有限公司)中制备生物炭.设置管式炉温度条件:以5℃/min的升温速率从室温升至100℃,停留1h;再以10℃/min的升温速率分别升温至350℃或500℃或700℃,停留4h,使之完全裂解,最后让其自然降温至室温.生物质裂解过程中保持纯N2以1.5L/min速率通过管式炉以确保生物质在缺氧或厌氧条件下进行裂解.将制备的生物炭研磨过200目筛,并按照其裂解温度命名为:BC350,BC500和BC700,置于密封袋中于避光黑暗中储存待用.
改性生物炭(MBCs)的制备及表征:首先,称取50g上述制备好的生物炭(BC350~700)于400mL蒸馏水中,在180r/min,30℃条件下震荡3d去除生物炭中易于溶解的有机质.其次,移除样品中液体部分,将得到的生物炭用蒸馏水清洗3遍后,加入200mL 1mol/L的HCl和200mL 1mol/L的HF,在相同条件下震荡3d以去除生物炭中灰分和难溶解有机质,将样品中液体部分移除.用蒸馏水清洗至生物炭沉淀呈中性后,将其置于冷冻干燥机内干燥,并根据其裂解温度命名为:MBC350,MBC500和MBC700,装入密封塑料袋中于避光黑暗中储存待用.对制备好的MBCs进行元素分析(EA3000,意大利)和比表面积分析(BET)讨论酸处理对生物炭的理化性质的影响.
本实验中使用的色谱级有机溶剂:甲醇、乙腈、正己烷、乙酸乙酯、甲基叔丁基醚购买于天津康科德科技有限公司;另本实验所使用的耗材,如C18反相色谱柱(5µm,4.6×150mm)、40mL棕色玻璃瓶、Teflon瓶盖、2mL进样小瓶购买于上海安谱实验科技有限公司.
1.2 菌种活化和菌悬液配置
菌种活化:将购买的菌种干粉接种到含10mL的NA固体斜面培养基的试管中,并用灭菌橡胶塞封口,置于30℃的恒温培养箱中培养24h以充分活化菌株,标为一代菌株.从固体NA斜面培养基中取菌种和分别接种到固体NA平板上,并于相同条件下培养24h,计为二代菌株.从固体NA平板中取和接种到装有50mL的NM的三角瓶中,用灭菌的橡胶塞封闭瓶口后,于180r/min,30℃条件的震荡箱中培养24h,计为三代菌株(本实验中所用到的细菌均为第三代菌株).
菌悬液配置:取三代菌液40mL于无菌离心管中,在4000r/min,4℃下离心10min,弃掉上清液,用无菌生理盐水清洗3遍菌沉淀,最后将菌种悬浮于无菌生理盐水中.以无菌生理盐水为空白,采用紫外分光光度计(型号:TU-1810,北京普析通用仪器有限责任公司)测量菌悬液的OD660值,并用无菌生理盐水进行稀释,直至菌悬液的OD660为0.65(相当于细菌浓度为5.2×108CFU/mL).
1.3 MBCs对微生物生长量的实验
在MM培养液中添加不同浓度的MBC350~700,使MBCs浓度为:25,100,500,1000和2000mg/L.取40mL含有不同浓度MBCs的NM培养于无菌离心管中,添加菌悬液和(菌悬液添加量为2%:)后,于180r/min,30℃的震荡箱中培养5d,以不添加菌悬液的样品为空白,测其OD660值,并计算其细菌浓度(1.0OD600 = 8×108CFU/mL).
1.4 MBCs对细菌细胞膜脂肪酸的实验和分析方法
参考微生物鉴定(MIDI)和Law等[14]的方法,对MBC350~700在不同浓度条件下培养的和进行脂肪酸提取和分析,其具体步骤如下.
脂肪酸提取:取步骤1.3培养5d的样品10mL于15cm×100mm带有Teflon盖子的玻璃管中,在8000r/min,4℃下离心10min,弃掉上清液;然后向沉淀加入1mL的试剂1(45g的NaOH、150mL的甲醇和150mL的蒸馏水混合),置于100℃的水浴中30min后,用冰浴使样品快速冷却至室温.再向样品中加入2mL的试剂2(325mL 6mol/L的HCl、275mL甲醇和65mL蒸馏水混合),在80℃的水浴中保留10min后,用冰浴使样品快速冷却至室温;快速向样品中加入1.25mL的试剂3(200mL正己烷和200mL甲基叔丁基醚混合),在涡旋上轻摇10min后,静置分层,使用巴斯德吸管去除下层水相后,向有机相中加入3mL的试剂4(10.8g的NaOH溶解于900mL蒸馏水中),轻摇5min后,使用巴斯德吸管吸取上层有机相的2/3(约0.6mL)到GC-MS进样小瓶中待测.
脂肪酸分析:用GC-MS(安捷伦5977B MSD)对上述提取的细菌脂肪酸进行分析,其参数设置如下:采用EI源(70eV),选择Scan模式进行测试,其/(质荷比)范围为:50~450.设置检测器和注入口温度为250和280℃.温控程序为:柱温开始设置为80℃,保留5min;以3℃/min升温至250℃,保留5min.进样量1.0µL注入到DB-5MS(30m×0.25µm×0.25µm)毛细管柱中进行分离和检测脂肪酸.通过峰高和保留时间来计算每种脂肪酸的含量.所有数据均采用3个平行样的均值.
1.5 MBCs对细菌基因绝对定量的实验
取步骤1.3培养5d的样品5mL于无菌离心管中,按照快速提取试剂盒(FAST DNA spin kit for soil)的说明书,进行DNA的提取.使用Primer Express软件3.0 (Applied Biosystems,福斯特市,美国)设计和菌株的PCR引物和TaqMan探针,如表1所示,对2种菌株使用实时qPCRs,测量特异引物下的细菌基因表达拷贝数.
qPCR实验的反应条件:每个PCR包含10µL的ChamQ SYBR Color qPCR Master mix(2x),0.4µL的正向和反向引物(5µmol/L),8.2µL双蒸水(ddH2O),和1µL上述提取的DNA,反应最终体积为20µL,并且控制循环条件如表1所示.使用质粒提取试剂盒提取质粒,将克隆片段进行PCR和琼脂糖凝胶电泳验证.然后使用NanoDrop 5000分光光度计(北京百泰克生物科技有限公司)分析质粒拷贝数,再根据扩增子序列和质粒的摩尔质量计算基因拷贝数,用LineGene 9600Plus软件导出数据进一步统计分析.

表1 细菌绝对定量实验的特异引物和反应条件
1.6 MBCs对微生物降解抗生素的实验和分析方法
MBCs对微生物降解抗生素的实验:前期研究结果显示,2种菌对抗生素SMX和CAP的最佳降解条件均为:接菌量为2%(:)、降解时间为5d、溶液pH为7.0、抗生素浓度10mg/L.因此,本研究在此条件下探讨MBC350~700在不同浓度(25,100,500, 1000,2000mg/L)对和降解SMX和CAP的影响.本实验均在40mL带有螺旋盖子的棕色玻璃瓶中进行,且置于180r/min,30℃条件的震荡箱中进行5d的降解.取出样品,用细胞破碎机粉碎(型号:JY92-ⅡDN,宁波新芝科技有限公司),过0.22µm滤膜后,取1.5mL液体于进样小瓶中测定残留抗生素的浓度.取样品10mL于40mL灭菌棕色瓶中,使用总有机碳分析仪(Multi N/C 3100,德国)对样品进行总有机碳(TOC)测定,分析不同浓度MBC350~700释放的TOC变化.
抗生素的分析方法:本研究采用高效液相色谱(HPLC,安捷伦,1260)检测改性生物炭和微生物降解抗生素后的残留浓度.其具体参数设置如下:采用紫外检测器,波长设置为265nm(SMX),278nm(CAP).流动相为超纯水(含0.1%甲酸)和甲醇以70:30(:)的等分洗脱,其柱温为40℃,进样量为10µL,以1mL/ min的速率进入C18反相色谱柱.根据培养基中的抗生素的残留量,计算各处理组的去除率,计算公式为:去除率(%)=(初始浓度-残留浓度)/初始浓度´100.
2 结果与讨论
2.1 MBCs的理化性质
表2是水稻生物炭经酸改性后的理化性质测试结果,表明其在水中的pH值呈中性,即酸洗可去除生物炭中的碱性基团[15].随着裂解温度的升高,改性生物炭中C元素含量呈上升趋势,而H、N、O元素显著下降,表明高温裂解使得生物炭炭化彻底,显示出高度芳香结构,且经酸洗可有效减少含O基团的数量[16].此外,改性生物炭比表面积和总孔体积显著高于普通生物炭,且其在水溶液中释放的溶解性有机碳(TOC)低于检测线,表明酸改性可有效的去除生物炭中无机组分、溶解性有机质和灰分等,提高生物炭中C元素含量、比表面积和总孔体积等[16].
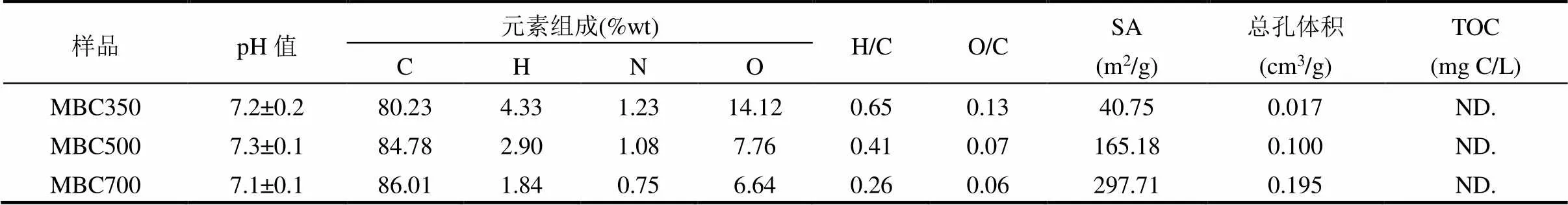
表2 改性生物炭的理化性质
注:ND.为未检验.SA为比表面积.
2.2 MBCs对抗生素生物降解的影响
不同浓度MBC350~700对SMX和CAP在MM营养液中的吸附量如图1所示.随着吸附剂MBCs浓度的增加,对SMX和CAP的吸附量呈线性增加,其相关系数2>0.8361.此外,发现不同温度MBCs对SMX和CAP的吸附量均为:MBC700>MBC500> MBC350.表明MBCs对SMX和CAP的吸附以物理吸附为主,主要通过表面吸附、孔隙吸附等作用[11].

图1 不同浓度改性生物炭对SMX(a)和CAP(b)的吸附量
细菌和在不同浓度的MBC350~700下对抗生素的去除率如图2所示.结果表明在浓度为25和100mg/L的MBCs培养的和对SMX和CAP的去除率比单一MBCs对其的吸附率显著提高;而在MBCs浓度为500,1000和2000mg/L培养微生物的条件下,对SMX和CAP去除率与MBCs单一作用下的吸附率差异不显著(>0.05).然而,随着MBCs浓度的增加,单一生物炭对SMX和CAP的吸附量和联合微生物培养对SMX和CAP的去除率成显著升高趋势.
此外,随着裂解温度的升高,单一MBCs对目标物的吸附率和联合培养微生物对污染物的去除率均呈显著增加,按照吸附率和去除率大小,表现出的顺序为:MBC700>MBC500>MBC350.表明此过程中微生物对污染物的去除率与MBCs对抗生素的吸附率有关.

图2 不同浓度的改性生物炭培养的细菌对SMX和CAP的去除率
不同字母代表数据在<0.05水平(LSD’s检验)上有显著性差异
为了清楚说明MBCs对细菌降解SMX和CAP的影响,对MBCs培养下的细菌对抗生素的去除率做扣除单一MBCs对抗生素的吸附率,其结果如图3所示.在MBCs的浓度为25和100mg/L下培养的细菌和对SMX和CAP的去除率提高了10%~45%.随着MBCs浓度的增加,和对SMX和CAP去除率的提高幅度显著减小.因为低浓度MBCs不仅为细菌生存繁殖提供场地[17],且通过物理吸附将溶液中溶解的抗生素吸附到其比表面和孔隙中,方便细菌利用[17],从而提高抗生素的去除率.随着MBCs浓度的增加,一方面提高了对抗生素的吸附量,导致能为细菌繁殖提供场地的比表面和孔隙减少;另一方面,由于生物炭吸附导致溶液中的抗生素含量下降和生物炭表面细菌的繁殖,由此造成溶液中游离的菌多而目标物少,且不利于细菌接触吸附态的SMX和CAP.因此,高浓度MBCs不利于提高微生物对抗生素的降解.

图3 不同浓度的改性生物炭培养的细菌对抗生素的去除率的提高量
不同字母代表数据在<0.05水平(LSD’s检验)上有显著性差异
2.3 MBCs对细菌生长量的影响
不同浓度的MBCs对细菌和生长量的影响如图4所示.结果表明随着MBCs的添加量的增加,细菌浓度呈线性增加(2>0.7745),表明MBCs特殊的理化性质、巨大的比表面积和孔结构可以为细菌和的生长提供场所[11],便于细菌进一步繁殖[11].尽管高浓度MBCs对细菌增加量要高于低浓度的,但同时也增加了MBCs对细菌的吸附,减少细菌与目标抗生素的接触机会,结果体现在低浓度的MBCs反而提高了微生物对SMX和CAP降解率.

图4 不同浓度的改性生物炭对细菌生长量的影响
2.4 MBCs对细菌细胞膜脂肪酸组成和含量的影响
脂肪酸是细菌细胞膜的重要组成成分,细胞膜通常通过改变脂肪酸的组成和含量来适应并生存于外界环境或污染物的不利影响[18].因此,本研究分析不同裂解温度制备的MBCs对细菌和脂肪酸组成和含量的影响(表3).结果表明在没有MBCs作用条件下,的正构直链脂肪酸分布在C10:0~C18:0,缺少C15:0正构脂肪酸;而的正构直链脂肪酸分布在C12:0~C18:0.在MBCs作用下,中脂肪酸C10:0和C15:1,cis-10消失,而在MBC500和MBC700作用下C15:0正构脂肪酸生成;而在MBC700作用下,逆式脂肪酸C14:1,cis-9和C15:1,cis-10生成.因此,不同裂解温度的MBCs对和脂肪的组成影响规律不一样.体现在对通过改变其细胞膜的正构脂肪酸组成[18-19],而通过生成逆式脂肪酸来适应MBCs刺激[18-20],从而提高MBCs联合微生物对SMX和CAP的去除.

表3 不同改性生物炭培养下细菌脂肪酸的组成成分
注:ND.,为未检出.
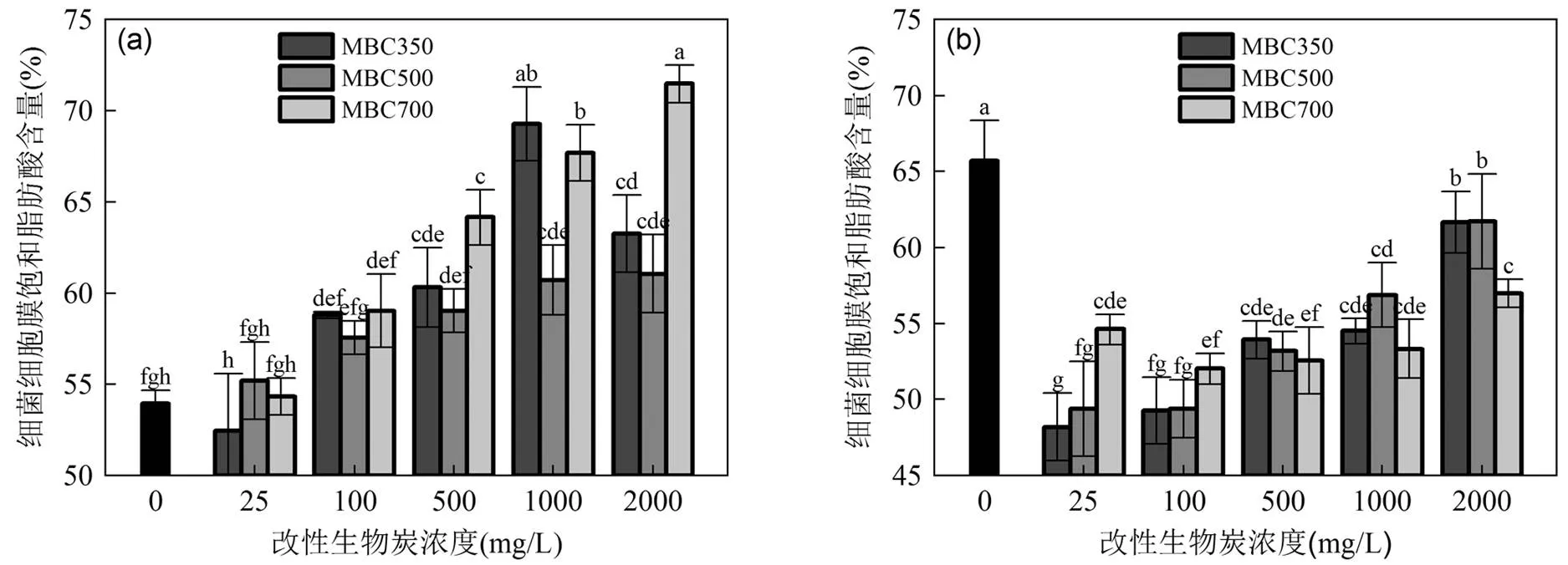
图5 不同浓度的改性生物炭对细菌饱和脂肪酸的影响
不同字母代表数据在<0.05水平(LSD’s检验)上有显著性差异
此外,对于革兰氏阴性菌,膜中饱和脂肪酸(SFA)与不饱和脂肪酸(UFA)的变化是许多微生物对污染物最常见的适应反应[21-23].因此,MBC350~700对细菌脂肪酸中SFA的影响如图5所示.在MBC350~700下培养的(图5a),其饱和脂肪酸显著提高,表明MBCs提高了细胞膜流动性[24-25].不同浓度的MBC350对细菌细胞膜SFA的影响做显著性分析(<0.05),当MBC350浓度为25mg/L时,细菌的SFA含量低于空白组;当MBC350浓度为1000mg/L时,细菌SFA达到最大.而对MBC500和MBC700培养的,其SFA含量随着MBCs浓度增加而增加,远高于空白组,均在浓度为2000mg/L,达到最大.而不同浓度MBC350~700对的SFA的影响特征(图5b)与对的影响不尽相同.结果显示相对空白组,MBCs显著降低了中SFA的含量,这是因为MBCs破坏细胞膜中脂质和蛋白质,从而导致SFA含量下降[26-27].此外,由图5b所示,随着MBCs浓度的增加,细胞膜中SFA含量显著增加,均在MBC350~700浓度为2000mg/L时,达到最大.因此,表明和在不同浓度的MBCs的刺激下,细胞膜中SFA的含量变化有着明显不同的规律[28],影响细菌细胞膜的流动性,从而造成MBCs联合这2种菌对SMX和CAP降解特征的不同.
2.5 MBCs对细菌基因表达拷贝数的影响
基因绝对定量被用来表达特殊环境对细菌的真实影响[29-30],图6揭示了不同温度MBCs在不同浓度下对细菌和基因表达拷贝数的影响.由图6a可知,相比空白组,MBC350~700培养的的基因表达拷贝数显著增加(<0.05),且随着MBCs浓度增加而增加,这和细菌生长量研究结果一致(图4).且发现在各相同浓度下,MBC500培养的的基因表达拷贝数最高.然而,相对空白组,在MBC350~700培养的细菌的基因表达拷贝数显著降低(图6b),其趋势与细菌饱和脂肪酸含量结果一致(图5b).因此,结果表明MBCs有利于细菌的基因表达,而抑制的基因表达量.
综上所述,MBCs对细菌降解抗生素的机制主要为:细菌在MBCs表面主要优先利用吸附到表面和空隙的抗生素作为营养物质进行繁殖,因此,低浓度MBCs作用下,繁殖的细菌能够提高对SMX和CAP的降解,而不影响细菌和目标物在MBCs吸附点位上的竞争;当MBCs浓度提高,抗生素吸附量、细菌的浓度、细菌细胞膜SFA、基因表达拷贝数均显著提高,此时,MBCs表面繁殖的细菌打破MBCs与溶液中抗生素的动态吸附[17],同时,溶液中抗生素减少,不利于抗生素的生物降解.
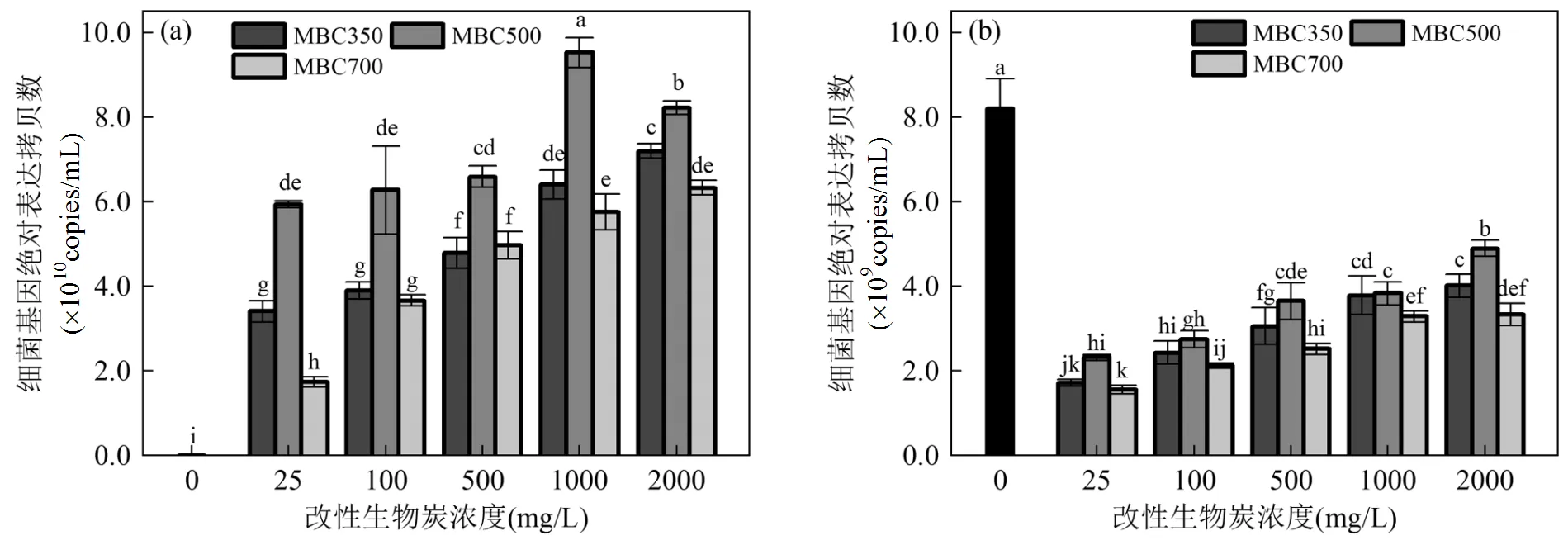
图6 不同浓度的改性生物炭对细菌基因表达量的影响
不同字母代表数据在<0.05水平(LSD’s检验)上有显著性差异
3 结论
3.1 低浓度MBC350~700培养的和对SMX和CAP的去除率显著高于单一MBCs对目标物的吸附率;而高浓度MBC350~700条件下,对SMX和CAP去除率与单一MBCs的吸附率差异不显著;且高浓度的MBCs单一或其与细菌联合对SMX和CAP去除率高于低浓度MBCs单一和联合作用.
3.2 低浓度MBC350~700联合细菌和对SMX和CAP的去除率相比单一MBCs的吸附量提高了10%~45%;高浓度MBCs联合培养细菌和对SMX和CAP的去除率与单一MBCs对SMX和CAP的吸附率呈不显著差异.
3.3 MBCs提高了细胞膜中饱和脂肪酸含量,而抑制了细菌的脂肪酸合成.特别是在MBCs作用下,细菌中脂肪酸C10:0和C15:1,cis-10消失;而在MBC700作用下,细菌的逆式脂肪酸C14:1,cis-9和C15:1, cis-10生成.
3.4 MBCs提高了细菌的基因表达拷贝数,而抑制了的基因表达拷贝数;但细菌和的基因表达拷贝数均随着MBCs浓度的增加而增加.
[1] Hirth N, Topp E, Dörfler U, et al. An effective bioremediation approach for enhanced microbial degradation of the veterinary antibiotic sulfamethazine in an agricultural soil [J]. Chemical and Biological Technologies in Agriculture, 2016,3(1):29-39.
[2] Kemper N. Veterinary antibiotics in the aquatic and terrestrial environment [J]. Ecological Indicators, 2008,8(1):1-13.
[3] Kivits T, Broers H P, Beeltje H, et al. Presence and fate of veterinary antibiotics in age-dated groundwater in areas with intensive livestock farming [J]. Environmental Pollution, 2018,241:988-998.
[4] Martínez J L. Antibiotics and antibiotic resistance genes in natural environments [J]. Science, 2008,321(5887):365-367.
[5] Wang H, Zhou H, Ma J, et al. Triplet photochemistry of dissolved black carbon and its effects on the photochemical formation of reactive oxygen species [J]. Environmental Science and Technology 2020, 54(8):4903-4911.
[6] Saffari N, Hajabbasi M A, Shirani H, et al. Biochar type and pyrolysis temperature effects on soil quality indicators and structural stability [J]. Journal of Environmental Management, 2020,261:110190-110202.
[7] Břendová K, Tlustoš P, Száková J, et al. Biochar properties from different materials of plant origin [J]. European Chemical Bulletin, 2012,1:535-539.
[8] Xu Y, Bai T, Yan Y, et al. Enhanced removal of hexavalent chromium by different acid-modified biochar derived from corn straw: behavior and mechanism [J]. Water Science and Technology, 2020,81(10): 2270-2280.
[9] Yao Y, Gao B, Chen H, et al. Adsorption of sulfamethoxazole on biochar and its impact on reclaimed water irrigation [J]. Journal of Hazardous Materials, 2012,209-210:408-413.
[10] Yang Z, Fang Z, Tsang P E, et al. In situ remediation and phytotoxicity assessment of lead-contaminated soil by biochar-supported nHAP [J]. Journal of Environmental Management, 2016,182:247-251.
[11] Zhao L, Xiao D, Liu Y, et al. Biochar as simultaneous shelter, adsorbent, pH buffer, and substrate of Pseudomonas citronellolis to promote biodegradation of high concentrations of phenol in wastewater [J]. Water Research, 2020,172:115494-115504.
[12] Bharti V, Vikrant K, Goswami M, et al. Biodegradation of methylene blue dye in a batch and continuous mode using biochar as packing media [J]. Environmental Research, 2019,171:356-364.
[13] Bao H, Wang J, Zhang H, et al. Effects of biochar and organic substrates on biodegradation of polycyclic aromatic hydrocarbons and microbial community structure in PAHs-contaminated soils [J]. Journal of Hazardous Materials, 2019,385:121595-121605.
[14] Law S Q K, Halim R, Scales P J, et al. Conversion and recovery of saponifiable lipids from microalgae using a nonpolar solvent via lipase-assisted extraction [J]. Bioresource Technology, 2018,260:338-347.
[15] Fidel R B, Laird D A, Thompson M L, et al. Characterization and quantification of biochar alkalinity [J]. Chemosphere, 2017,167:367-373.
[16] Yang F, Zhang Q, Jian H, et al. Effect of biochar-derived dissolved organic matter on adsorption of sulfamethoxazole and chloramphenicol [J]. Journal of Hazardous Materials, 2020,396:122598-122608.
[17] Lin C W, Tsai S L, Lai C Y, et al. Biodegradation kinetics and microbial dynamics of toluene removal in a two-stage cell-biochar- filled biotrickling filter [J]. Journal of Cleaner Production, 2019,238: 117940-117947.
[18] Weber F J, Bont J A M D. Adaptation mechanisms of microorganisms to the toxic effects of organic solvents on membranes [J]. Biochim Biophys Acta, 1996,1286(3):225-245.
[19] Fang J, Barcelona M J, Alvarez P J J. Phospholipid compositional changes of five pseudomonad archetypes grown with and without toluene [J]. Applied Microbiology and Biotechnology, 2000,54(3): 382-389.
[20] Heipieper H J, Diefenbach R, Keweloh H. Conversion of cis unsaturated fatty acids to trans, a possible mechanism for the protection of phenol-degrading Pseudomonas putida P8from substrate toxicity [J]. Applied and Environmental Microbiology, 1992,58(6): 1847-1852.
[21] Fang J, Barcelona M, Alvarez P. Phospholipid compositional changes of five Pseudomonad archetypes grown with and without toluene [J]. Applied Microbiology and Biotechnology, 2000,54(3):382-389.
[22] Chen P, Powell B A, Mortimer M, et al. Adaptive interactions between zinc oxide nanoparticles and chlorella sp [J]. Environmental Science and Technology, 2012,46(21):12178-12185.
[23] Zhu B, Xia X, Xia N, et al. Modification of fatty acids in membranes of bacteria: Implication for an adaptive mechanism to the toxicity of carbon nanotubes [J]. Environmental Science and Technology, 2014, 48(7):4086-95.
[24] Santhosh P B, Velikonja A, Perutkova A, et al. Influence of nanoparticle–membrane electrostatic interactions on membrane fluidity and bending elasticity [J]. Chemistry and Physics of Lipids, 2014,178:52-62.
[25] Min B, Kim K, Li V, et al. Changes in cell membrane fatty acid composition of streptococcus thermophilus in response to gradually increasing heat temperature [J]. Journal of Microbiology and Biotechnology, 2020,30(5):739-748.
[26] Fonseca F, Pénicaud C, Tymczyszyn E E, et al. Factors influencing the membrane fluidity and the impact on production of lactic acid bacteria starters [J]. Applied Microbiology and Biotechnology, 2019,103(17): 6867-6883.
[27] Mykytczuk N C S, Trevors J T, Twine S M, et al. Membrane fluidity and fatty acid comparisons in psychrotrophic and mesophilic strains of Acidithiobacillus ferrooxidans under cold growth temperatures [J]. Archives of Microbiology, 2010,192(12):1005-1018.
[28] Mortimer M, Kasemets K, Vodovnik M, et al. Exposure to CuO nanoparticles changes the fatty acid composition of protozoa tetrahymena thermophila [J]. Environmental Science and Technology, 2011,45(15):6617-6624.
[29] Zhang S Y, Zhao F J, Sun G X, et al. Diversity and abundance of arsenic biotransformation genes in paddy soils from southern China [J]. Environmental Science and Technology, 2015,49(7):4138-4146.
[30] Zhang S, Su J, Sun G, et al. Land scale biogeography of arsenic biotransformation genes in estuarine wetland [J]. Environmental Microbiology, 2017,19(6):2468-2482.
Effects and mechanisms of modified-biochar on biodegradation of antibiotics as revealed by bacteriological characteristics.
YANG Fang, JIAN Hong-xian, GAO Yue, WANG Cui-ping*
(Key Laboratory of Pollution Processes and Environmental Criteria, Ministry of Education, Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300071, China)., 2021,41(4):1723~1731
Three kinds of modified-biochar including MBC350, MBC500 and MBC700, and two types of antibiotics sulfamethoxazole (SMX) and chloramphenicol (CAP), were selected to investigate effects of different MBCs on biodegradation of SMX and CAP and the bacteriological characteristics ofand. The results showed that in the bacterial system cultured with low-concentration MBCs, the removal of SMX and CAP mainly depended on biodegradation byand. While in the bacterial system cultured with high-concentration MBCs, the removal of SMX and CAP was mainly by the adsorption onto MBCs. The adsorption capacities of SMX and CAP onto MBCs and the bacterial growth all increased as the concentrations of MBCs increased, leading to the decrease in the concentrations of antibiotics in the solution and the biodegradation efficiency. The content of fatty acids ofwas significantly improved, while the fatty acids synthesis ofwas inhabited in the presence of MBCs. In particular, the components C10:0, C15:1, cis-10 ofwere disappeared, and the components of trans-unsaturated fatty acids ofwere generated, such as C14:1, cis-9 and C15:1, cis-10. Additionally, by using absolute quantitative technique, the gene copies number ofwasclearly improved, while it was inhabited forin the presence of MBCs. But the gene copies numbers ofandwere increased with the increasing concentrations of MBCs. Therefore, this study showed that low-concentration MBCs were conducive to the biodegradation of SMX and CAP. While the bacteriological characteristics, such as bacterial growth, fatty acid and copy number of bacterial gene expression, were all promoted in the presence of high-concentration MBCs.
antibiotics;modified-biochar;biodegradation;bacterial growth;fatty acids;the copy number of gene
X52
A
1000-6923(2020)04-1723-09
杨 芳(1990-),女,陕西咸阳人,南开大学博士研究生,主要从事环境污染物控制与修复研究.发表论文3篇.
2020-09-05
国家自然科学基金资助项目(42077320);宁夏科技厅重点研发资助项目(2019BFG02020);高等学校学科创新引智计划111资助项目(T2017002)
* 责任作者, 教授, wangcp@nankai.edu.cn
