烟气中汞现场监测氧化吸收条件优化研究
2021-04-29马超
马 超
(江苏省徐州环境监测中心,江苏 徐州 210000)
前 言
高锰酸钾作为一种常见、高效的氧化剂已广泛应用于多个领域。2009年,由环保部颁布的《固定污染源废气汞的测定 冷原子吸收分光光度法(暂行)》(HJ543-2009)(以下简称“HJ543-2009”)将高锰酸钾溶液作为固定源废气中的汞的吸收剂,利用高锰酸钾的氧化性将废气中的单质汞(Hg0)氧化成可完全溶解的离子态汞(Hg2+)[1],通过汞相态的转化,以达到固定待测污染物的目的。因此,氧化吸收效率将在很大程度上决定分析结果的准确性,由于样品采集现场情况复杂多变,干扰因素庞杂,作业环境恶劣[2],本文通过分析几种环境因素对其氧化吸收效率的影响,旨在探究“HJ543-2009”的适用性,进一步优化汞监测方法,为现场监测的高效运行提供依据。
本实验高锰酸钾液初始浓度、初始pH值,反应温度,初始汞浓度进行逐一研究,说明各影响因素对高锰酸钾吸收效率的影响,说明其适用性。
1 材料及步骤
1.1 实验材料
高锰酸钾(KMnO4,AR)购于南京化学试剂厂,氢氧化钠(NaOH,AR),盐酸(HCl,AR)均购于天津市天河化学试剂厂;汞渗透管(苏州青安仪器有限公司,操作温度90℃,汞渗透量90ng/min);氮气(N2)(纯>99.9%,徐州宏源达气体供应站);冷原子吸收测汞仪(QM201H,苏州青安仪器有限公司)。
1.2 实验装置
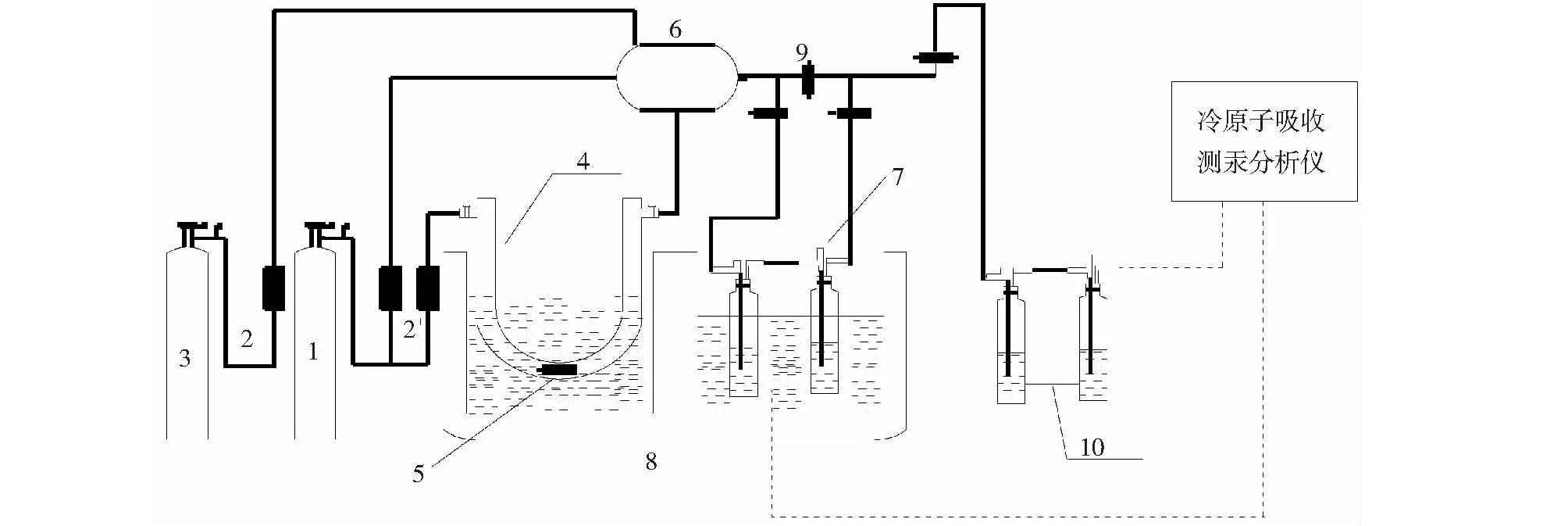
1.氮气(N2)载气;2.流量计;3.平衡气气体(氮气);4.U型玻璃管;5.汞渗透管;6.混气瓶;7.串联吸收管;8.恒温槽;9.三通阀;10.尾气吸收装置。图1 试验系统图Fig.1 Schematic diagram of experiment apparatus
1.3 实验装置及步骤
1.3.1 按《固定污染源废气汞的测定 冷原子吸收分光光度法(暂行)》(HJ543-2009)要求连接吸收管。设定汞渗透管、氧化吸收液水浴温度至待观察条件,气体总流量为0.3L/min,载气量和平衡气气量按比例混合均匀,同时检查管路的气密性。汞发生量与渗透管温度成正相关关系,比照关系详见表1。

表1 汞发生量与渗透管温度的关系Tab.1 The relationship between Mercury production and different reaction temperatures
1.3.2 按照Ontario-Hydro方法准备和配置尾气吸收和清洗试剂。
1.3.3 当水浴温度达到所需要的温度时,打开N2阀门,通入N2,赶走管路和反应器中的残存的少量汞蒸气及空气,稳定反应系统约1.5 h左右。过程中,隔一定时间补充恒温水浴的水,保证水深和U型汞渗透管加热面积不变。待气流等参数稳定后,根据实验要求配置氧化吸收液进行试验,pH值用10%(体积比)H2SO4和0.1mol/L的NaOH进行调节。
1.3.4 按《固定污染源废气汞的测定 冷原子吸收分光光度法(暂行)》(HJ543-2009)要求用冷原子分光光度法测定吸收液中的汞含量,重复采样。每个样品重复测试3次,结果取其平均值。
1.3.5 汞的脱除效率
Hg0经主反应器中氧化剂氧化生成水溶性较好的Hg2+,并溶解在氧化吸收液中,即视为脱除,汞的脱除效率(η)的计算方法:
η=(1—ρout/ρin)×100%
(1)
式中:η—Hg0的去除率,%;ρin—初始Hg0蒸气浓度,μg/m3;ρout—出口端Hg0蒸气浓度,μg/m3。
2 结果与讨论
2.1 高锰酸钾初始浓度对汞吸收效率的影响
配置模拟烟气Hg0浓度为50.92μg/m3(渗透管温度为55℃),“HJ543-2009”中7.1“样品的采集”中规定采样时间为5min~30min,而如图2,反应时间(t)为5min时,各浓度条件下的吸收效率均未超过5%,Hg0累计量不足,气液传质阻力明显,氧化吸收效果不佳,不宜作为样品采集的时间下限。随着反应时间的延长,Hg0的吸收效率也随之增加,10min~15min内基本达到氧化吸收平衡,KMnO4浓度(C(KMnO4))对平衡时间影响不明显,为保证氧化吸收效率,采样时间下限设置为10min~15min为宜。

pH=0,c(Hg0)=50.92μg/m3,反应温度(T)=60℃。图2 KMnO4浓度随反应时间变化的汞吸收效率Fig.2 Hg absorption efficiency of different concentration of KMnO4 changed with reaction time
C(KMnO4)<3.5mmol/L时,反应液浓度的增加对氧化吸收效率正向影响显著,而C(KMnO4)>5mmol/L,Hg0氧化吸收效率基本稳定在90%左右,氧化吸收液浓度的变化对其影响不大,“HJ543-2009”中氧化吸收液浓度为50mmol/L,出于经济性考虑,浓度可适当降低,根据实验结果,吸收液浓度为5mmol/L较为合适,考虑到监测现场的复杂性,可选取该浓度的2~3倍作为现场吸收液浓度。
2.2 高锰酸钾初始pH值对汞吸收效率的影响
通过稀H2SO4、稀NaOH调节C(KMnO4)=5mmol/L的溶液pH值,考察pH值与氧化吸收效率之间的关系,如图3。pH=0时,溶液处于强酸环境(pH=0),Hg0氧化吸收效率(η)为90.16%,随着溶液pH值的升高,η呈下降趋势,pH=10时,降至最低仅为66.70%。pH值继续升高,η又转而迅速增长,pH=14时,η增至89.66%,与强酸性体系相当(pH=0)。这与KMnO4的氧化性以及汞氧化的过程有关,不同pH值的体系环境中,KMnO4的氧化还原反应及标准电极电势如表2所示[3]。
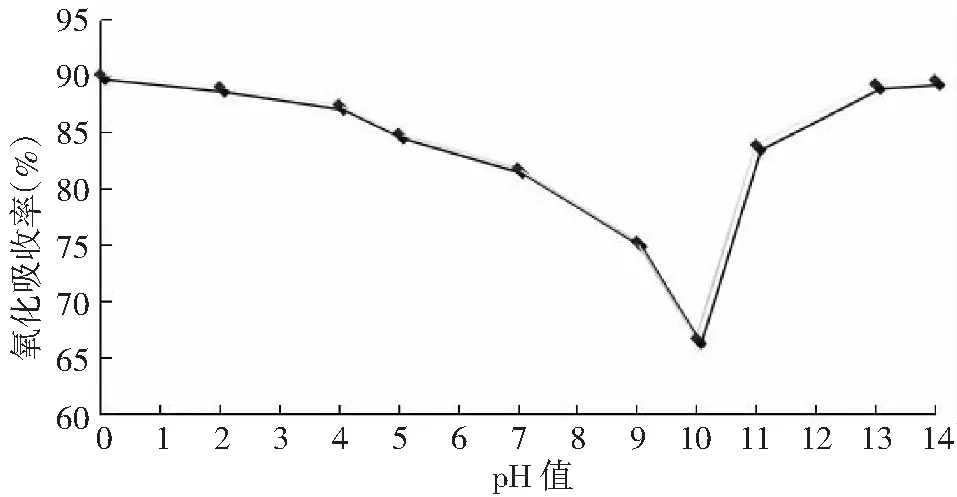
C(KMnO4)=5mmol/L,c(Hg0)=50.92μg/m3,T=60℃,t=15min图3 KMnO4初始pH值对汞吸收效率的影响Fig.3 Effect of the initial pH value of KMnO4on efficiency of Hg0 removal

表2 KMnO4半电池反应及标准电极电势与体系pH值的关系Tab.2 Relation of redox reactions and their standard potential of various couples of manganese ions with pH
在酸性(pH<7)的反应体系中,随着体系pH的降低,KMnO4的标准电极电势也随之增加,氧化性能增强。其可能发生的氧化还原反应如式(2)、式(3)所示:
在强酸性(pH<3.5)条件下,KMnO4与Hg0如反应:
(2)
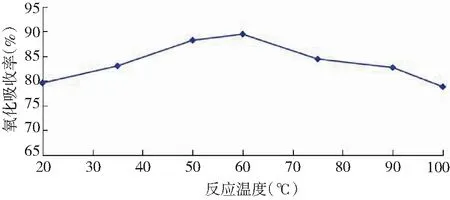
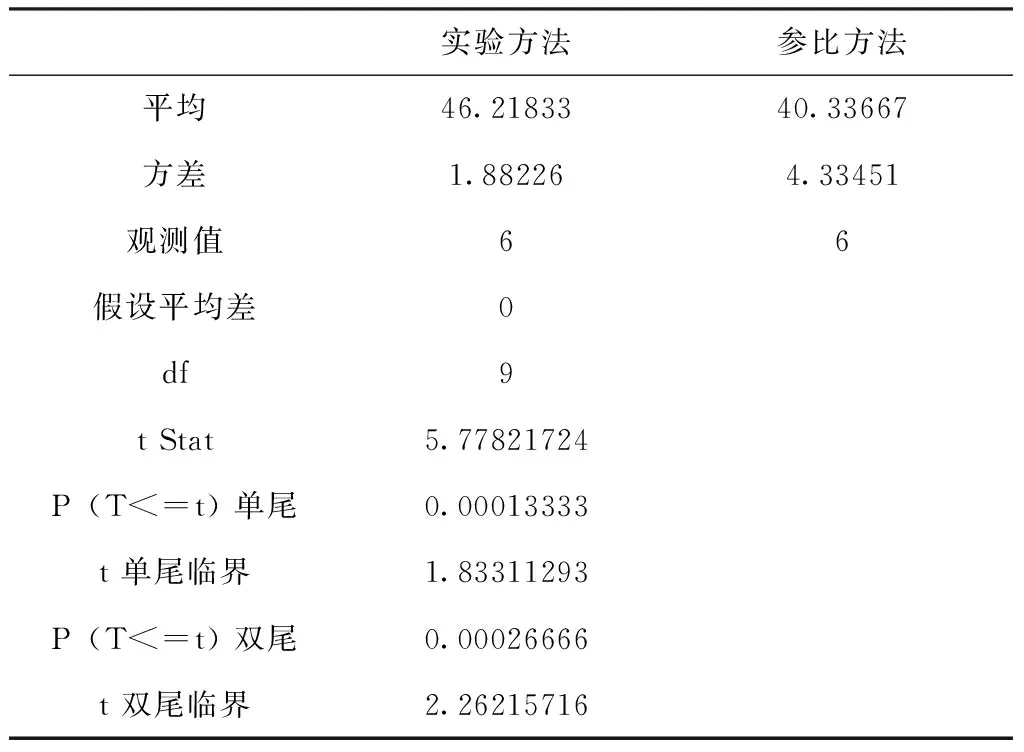
在弱酸性(3.5 (3) 在中强碱性(7 (4) (5) 在强碱性(pH>12)条件下: (6) Hg0与OH·反应,最终生成Hg(OH)2,反应如下: Hg+OH·→Hg(OH) (7) Hg(OH)+OH·→Hg(OH)2 (8) “HJ543-2009”中,氧化吸收液以体积比为10%的硫酸溶液等体积配置,pH值约为0.76,根据实验结果,该条件下KMnO4具有较高的反应活性,氧化吸收效率为90%左右。样品采集过程中要密切关注吸收液pH值的变化情况,建议在样品中加入酸碱指示剂,在不利条件下立刻停止采样或更换采样管,并一并送实验室分析。 2.3 初始汞浓度对高锰酸钾吸收效率的影响 燃煤烟气中汞含量受煤质、燃烧方式影响,平均含量在10~30 μg/m3之间,但有时可能更高。通过控制初始汞浓度,考察其在不同pH条件下氧化吸收效率,见图4。 由图4可以看出,在3种pH值环境中,初始汞浓度的变化(汞发生量与渗透管温度的关系详见表1)对高锰酸钾吸收效率没有明显的影响,汞浓度较高时,氧化吸收效率略有下降。pH=0,pH=7和pH=12条件下,氧化吸收效率极差分别为4.40%,2.94%,1.41%,均未超过5%,汞吸收效率基本保持稳定。 C(KMnO4)=5mmol/L,T=60℃,t=15min。图4 初始汞浓度对Hg0去除率的影响Fig.4 Effect of initial mercury concentration on removal efficiency of mercury 理论上,汞的气相分压随着初始汞蒸气浓度的增大而增大,提高了气相传质推动力,传质增强,反应速率增大。但试验结果并非如此,汞吸收效率并未与初始汞浓度呈现正相关关系。这可能是由于①KMnO4对Hg0的氧化吸收速率主要受液膜内的氧化还原反应控制,气液间传质的影响不大;②反应过程中,高锰酸钾相对过量,气相汞浓度的变化并不影响汞氧化反应的平衡的程度。但由于Hg0难溶于水,浓度较高时,部分Hg0未来及与KMnO4接触就散逸,导致氧化吸收效率略有下降[6],初始汞浓度处于24μg/m3~125μg/m3之间时,KMnO4适应性较好,抗冲击能力较强。 2.4 反应温度对高锰酸钾吸收效率的影响 反应温度对反应剂的稳定性、气液间传质及反应速率等因素均有影响,是影响液相氧化吸收性能的重要指标。 pH=0,c(Hg0)=50.92μg/m3,C(KMnO4)=5mmol/L,t=15min图5 汞氧化吸收效率随反应温度的变化Fig.5 Removal efficiency of mercury changed with reaction temperature 由图5可知,在20℃~100℃温度范围内,随着体系T的升高,汞吸收效率(η)呈现先增加后降低的变化趋势。20℃时,η为79.56%,随着温度的提高,η也随之增高,当T2=60℃时,η增长至最高的89.44%,但当温度继续升高时,η转而减小,反应温度升至100℃,η下降至78.79%。这可能与Hg0的物理性质以及汞的氧化反应有关:一方面,KMnO4氧化Hg0的反应为吸热反应,反应活化能为56kJ/mol[7],温度的升高有利于氧化还原反应的进行;但另一方面,气液传质阻力增加,限制了氧化反应的进行。温度与Hg0的饱和蒸汽压如表3所示。 表3 Hg0的饱和蒸汽压Tab.3 Saturation vapor pressure of mercury 当反应温度处于25℃~60℃时,温度的升高对化学反应促进作用较为突出,在此温度范围内,较高的温度有利于Hg0的液相氧化吸收;但当温度超过60℃,气液传质影响变得更显著,有限的溶解量限制氧化吸收反应的继续进行,吸收效率降低。60℃是高锰酸钾氧化吸收的最优反应温度。冬季现场样品采集时,应增设加热装置,保持反应液温度恒定。 2.5 方法对比 为验证实验择选出的最优条件与“HJ543-2009”方法相比较是否对汞的氧化吸收效率的提高具有统计学意义,设置初始汞浓度为50μg/m3,实验方法、参比方法分别进行六组实验,对两组实验数据进行统计学分析,得出结果。 实验方法:C(KMnO4)=5mmol/L,pH=0,T=60℃,t=15min 参比方法:按照“HJ543-2009”方法配置、链接氧化吸收液,T=2℃(室温),t=15min。 使用excel软件,将实验方法、参比方法所得6组数据进行F检验、双样本T检验假设分析,见表4、表5。根据统计学检验结果,与参比方法相比较,实验方法对于汞氧化吸收效率的提高显著,具有统计学意义(显著性水平选取0.05)。 表4 F检验结果表Tab.4 The result on F-test 表5 T检验结果表Tab.5 The result on T-test 3.1 KMnO4氧化Hg0的效果明显,15min达到氧化吸收平衡,KMnO4浓度对平衡时间无显著影响,为保证样品代表性,应调整样品采集时间下限。 3.2 强酸、强碱性条件下,高锰酸钾浓度为5mmol/L氧化吸收效率较高,初始汞浓度的变化对KMnO4的脱汞效率几乎没有影响,抗冲击能力较强。反应温度为60℃时效果最佳,温度过高、过低均不利,现场监测应加设恒温装置。 3.3 将实验确定的最优方法与参比方法进行对比分析,根据统计分析结果,实验方法能有效提高汞的氧化吸收效率。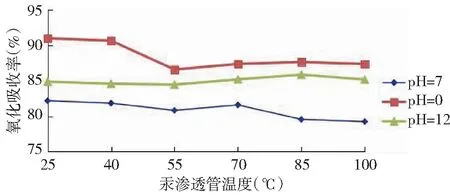


3 结 论
