石墨烯量子点荧光“开启”适配体传感器检测卡那霉素
2021-04-29张磊邓健康张富源
张磊,邓健康,张富源
(1.天津科技大学食品科学与工程学院食品营养与安全国家重点实验室,天津 300457;2.河南科技学院食品学院,河南 新乡 453003;3.衡水学院生命科学学院,河北 衡水 053000;4.河北农业大学食品科技学院,河北 保定 071001)
卡那霉素(kanamycin,KAN)作为一种氨基糖苷类抗生素被广泛用于人和牲畜,目的是治疗细菌感染、乳腺炎、羊痘以及肺炎等[1-2]。然而,随着KAN的长期过量使用,其危害逐渐显现,如哺乳期动物乳汁污染、动物组织积累和细菌耐药性等,进而对人体健康和环境安全造成威胁[3-4]。因此,非常需要开发一种简单、快速和灵敏度高的新方法,用于定量检测动物源性食品中痕量KAN残留。目前,常用的检测方法有高效液相色谱(high performance liquid chromatography,HPLC)[5]和液质联用(high performance liquid chromatography with mass spectrometry,LC-MS)[6],在定量和定性分析中具有明显的优势。但是,这些方法同时也存在耗时、样品预处理复杂、仪器精密以及专业技术要求高等不足[7]。为克服这些缺陷,研究者进行了大量尝试以开发用于KAN的快速且有效的检测方法,包括:比色法(colo-rimetric assay,CA)[8]、荧光传感器(fluoresence,FL)[2]和电化学生物传感器(electrochemistry,EC)[9]等。其中,荧光传感器由于具有制备简单、易定量、高灵敏度以及高通量生物分析潜力等优点,已被广泛用于化学和生物分析领域[10-11]。
近年来,氮掺杂石墨烯量子点(nitrogen-doped graphene quantum dots,N-GQDs)由于其量子产率更高和活性位点丰富而倍受关注。值得注意的是,N-GQDs通过控制其聚集/解离状态,可以切换体系荧光淬灭/恢复[12]。因此,通过引入能诱导N-GQDs聚集/解离的特异性识别探针,可以制备一种具有高选择性和优异灵敏度的新型荧光传感器。核酸适配体(aptamers,Apt)是一小段经体外筛选得到的寡核苷酸序列,它不仅能与其互补链(complementary strand,CS)结合形成DNA双螺旋结构,还能与其目标物进行更强的高亲和力特异性结合,因此可以胜任这一角色[13]。
本研究提出了一种新型荧光“开启”策略,用于高灵敏度检测动物源性食品中的卡那霉素(KAN)。其原理是基于不同状态的适配体结构转换(Apt-CS/Apttarget)诱导N-GQDs聚集状态发生改变(聚集/解聚),并最终引起体系荧光信号的淬灭/恢复,原理如图1所示。通过这一策略,可以进行KAN的检测,并能作为原型扩展到其它目标物的检测。

图1 构建适配体传感器原理图Fig.1 Schematic diagram of the designed aptasensor
1 材料与方法
1.1 试剂和仪器
KAN-Apt及其 3条互补链(CS):Genewiz(苏州)公司 [碱基序列如下:KAN-Apt:5′-TGGGGGTTGAGGCTAAGCCGA-(CH2)7-NH2-3′;互补链:包括 CS1(5′-NH2-(CH2)6-TCGGCTTAG-3′)、CS2(5′-NH2-(CH2)6-TCGGCTTAGCC-3′) 和 CS3 (5′-NH2-(CH2)6-TCGGCTTAGCCTC-3′)];1-(3-二甲氨基丙基)-3-乙基碳二亚胺[1-Ethyl-3-(3-(dimethylamino)propyl)carbodiimide,EDC]、N-羟基琥珀酰亚胺酯(N-hydroxysuccinimide ester,NHS):美国 Sigma-Aldrich 公司;柠檬酸(citric acid,CA):加拿大 BioBasic公司;三(羟甲基)氨基甲烷[Tris(hydroxymethyl)aminomethane,Tris-HMA]、卡那霉素(KAN):阿拉丁(上海)有限公司。以上试剂均为分析纯。
透射电子显微镜(2010 FEF):日本JEOL公司;UV-Vis紫外可见分光光度计(Cary 50-Bio):美国Varian公司;荧光分光光度仪(Thermo Lumina):美国Thermo公司;傅立叶变换红外光谱仪(Vector-22):德国Bruker公司。
1.2 N-GQDs、N-GQDs-Apt和 N-GQDs-CS 的制备
N-GQDs采用CA和Tris-HMA混合物一步热解法制成[14]。得到的N-GQDs溶液通过冷冻干燥24 h得到淡黄色粉末,棕色瓶中4℃保存。N-GQDs-Apt和N-GQDs-CS采用碳二亚胺化学缩合方法合成[12]。首先,取 10 mL N-GQDs悬浮液(0.4 mg/mL),加入 30 μL EDC(19 mg)和 NHS(22 mg)混合液,混合 30 min。然后,将混合液平均分成两份,每份分别与24 μL氨基修饰的 KAN-Apt或 CS 溶液(100 μmol/L)混合 2 h,通过缩合反应分别得到N-GQDs-Apt和N-GQDs-CS。接着超滤以除去过量的Apt/CS。最后,超滤过的复合物洗涤3次,分散于磷酸盐缓冲液(phosphate buffer saline,PBS),4℃保存。通过添加过量的KAN-Apt和CS,使N-GQDs完全反应,确保体系中N-GQDs之间最大程度聚集[12]。
1.3 构建检测体系
取500 μL N-GQDs-Apt,加入等体积N-GQDs-CS,20℃轻微搅拌10 min,通过简单混合,构建NGQDs-Apt/N-GQDs-CS适配体传感器。通过优化缓冲溶液pH值、N-GQDs浓度、CS序列长度、Apt与CS结合的孵育温度和时间、KAN与Apt特异性结合的反应温度和时间等参数进行优化,获得高灵敏度的荧光“开启”适配体传感器。
1.4 KAN测定
加入不同浓度的KAN,在330 nm激发波长下,记录测定检测体系(N-GQDs-Apt/N-GQDs-CS)的荧光光谱和荧光强度。具体而言,首先将50 μL不同浓度的KAN、150 μL N-GQDs-Apt/N-GQDs-CS 混合溶液和300 μL PBS溶液(pH 7.4)快速混合,20℃振荡孵育15 min。接着,用λex=330 nm测量检测体系荧光强度,并记录其荧光光谱。最后,基于以上结果创建标准曲线。此外,采用50 μL预处理样品或加标样品代替标准溶液进行分析,根据工作曲线计算实际样品中KAN浓度。
1.5 实际样品准备
所用动物源性食品样品均从当地超市购买。
荧光测定,对样品进行处理以去除蛋白质和脂肪。牛奶和蜂蜜样品采用三氯乙酸进行预处理[15]。除每次离心前需要冰水浴超声10 min外,鱼肉、鸡肉和鸡蛋的预处理方法与牛奶和蜂蜜样品处理方法基本相同。另外,在提取前,需要将它们分别捣碎、搅拌10 min得到均匀粉碎样品。在测量之前,将滤液避光4℃保存。
样品中加入 KAN 标准溶液(0.2、1.0、2.5 ng/mL),采用牛奶和蜂蜜处理方法对加标样品进行预处理并分析。
6个收集的实际样品中加入KAN标准溶液(0.2、1.0、2.5 ng/mL),采用牛奶和蜂蜜处理方法对加标样品进行预处理,得到加标样品的上清液。之后,根据本研究方法分析所得加标样品,根据各样品基质标准曲线计算各加标样品中KAN含量。
2 结果与分析
2.1 N-GQDs、N-GQDs-Apt和 N-GQDs-CS 的制备和表征
为验证N-GQDs-Apt、N-GQDs-CS的形态以及粒度分布,对它们进行透射电镜(transmission electron microscope,TEM)表征。结果如图2。

图2 所制备材料的TEM图和粒径分布Fig.2 TEM image and particle size statistics of the prepared materials
由图2a、图2b可知,所制备的N-GQDs-Apt/CS稳定且分散良好。由图2e、图2f可知,N-GQDs-Apt的直径主要在3.9 nm~5.4 nm之间,平均粒径为4.56 nm,NGQDs-CS在3.6 nm~5.1 nm之间,平均粒径为4.41 nm。比较发现,两者粒径有细微差别,前者的平均粒径比后者稍大。此外,还对添加KAN前后的检测体系进行了TEM表征。由图2c可知,N-GQDs-Apt/N-GQDs-CS混合物导致N-GQDs显著聚集,表明Apt和CS有效杂交;由图2d可知,将KAN添加到N-GQDs-Apt/NGQDs-CS混合体系后,发现大量N-GQDs显著分散,表明加入KAN后阻碍了Apt和CS的杂交。
为验证N-GQDs和N-GQDs-Apt/CS的成功合成,对3种材料进行紫外-可见吸收光谱检测,结果如图3所示。

图3 N-GQDs、N-GQDs-Apt、N-GQDs-CS 和混合体系紫外-可见吸收光谱Fig.3 UV-vis spectra of N-GQDs,N-GQDs-Apt/CS and the mixture system
结果显示,N-GQDs-Apt与N-GQDs-CS除了具有N-GQDs的特征峰[在235 nm处的肩峰(C=C键的ππ*跃迁)和335 nm处明显的紫外吸收峰(sp3团簇中均匀的分布有sp2团簇)[14]外,在260 nm处出现了一个新的ssDNA特征峰,这证明了N-GQDs与Apt/CS的成功偶合。另外,还对N-GQDs-Apt/N-GQDs-CS混合体系的紫外-可见吸收光谱进行了测定。结果发现,与单个组分相比,N-GQDs-Apt/N-GQDs-CS混合物的紫外-可见吸收光谱没有明显变化。
通过对N-GQDs和N-GQDs-Apt进行傅立叶变换红外光谱(fourier transform infrared spectrum,FTIR)表征,以获得其化学和结构信息,结果见图4。

图4 傅立叶红外光谱光谱图Fig.4 Fourier transform infrared spectroscopy
由图4a可知,在N-GQDs的FTIR光谱图中,明显存在-OH、-NH和-COO-的伸缩振动峰,以及C-O拉伸和C-H弯曲的振动峰[16-18]。C=O振动和C=C拉伸峰表明合成的N-GQDs含有能提高水溶性的羰基[18],C=C的伸缩振动峰表明其具有石墨烯六元环晶格结构[14]。这些特征峰证实了本研究中N-GQDs的成功合成。此外,C-NH-C和-NH的伸缩振动峰则表明合成的N-GQDs成功引入了氮掺杂[19]。另外,由图4b可知,当引入KAN-Apt时,出现了4个新的振动峰:1 064.7 cm-1和1 132.2 cm-1处的峰归因于2-脱氧核糖中C-O-C的不对称拉伸和对称磷酸盐(PO2-)的振动;983.6 cm-1和802.3 cm-1处的峰归因于Apt中P=O和P-O的伸缩振动。基于这些特征,表明N-GQDs与Apt实现了成功偶联[20-21]。
为探究N-GQDs、N-GQDs-Apt/CS以及添加KAN前后检测体系的光学特性,对它们的荧光光谱进行分析,如图5所示。

图5 荧光光谱分析Fig.5 Fluorescence spectral analysis
由图 5a可知,N-GQDs-Apt/CS 在 λex/λem=330 nm/445 nm处具有最强的荧光信号,而两者混合体系的发射光谱发生了明显的荧光淬灭,荧光强度大幅下降67.8%以上,并且,它还发生了8 nm的红移(λex/λem=330 nm/453 nm)。更有趣的是,随着体系中加入KAN(50 ng/mL),其发射光谱的红移又会随着荧光恢复而逐渐消失。
同时,将N-GQDs-Apt与N-GQDs混合作为对照组,以测量体系FL强度的变化。由图5b可知,对照组没有发生明显的荧光淬灭。此外,加入KAN后观察到对照组的FL强度几乎也没有变化。这充分表明荧光淬灭是由Apt和CS杂交进而引起N-GQDs聚集而导致的。
2.2 N-GQDs聚集引起体系荧光淬灭的原理
基于上述对 N-GQDs、N-GQDs-Apt、N-GQDs-CS和N-GQDs-Apt/N-GQDs-CS检测体系的表征,研究了该方法的机理。添加KAN前,Apt-CS杂交会诱导N-GQDs聚集(图2c),从而导致体系荧光明显淬灭。同时,体系荧光发射光谱发生红移,而吸光度没有变化。基于这些结果,证明发生了有效的激子能量转移[12]。相反,体系中添加KAN(50 ng/mL)后,它与N-GQDs-Apt之间的特异性识别和结合引起Apt的结构转换。这限制了Apt-CS的杂交,导致N-GQDs解聚(图2d),并削弱了N-GQDs之间的激子能量转移,最后体系FL强度得以显著恢复。
2.3 条件优化
据研究,KAN荧光测定受试验条件的影响非常明显。为获得灵敏度更高的荧光适配体传感器,本研究对包括缓冲溶液pH值、N-GQDs浓度、CS序列长度、Apt与CS结合的孵育温度和时间、目标物与Apt特异性识别的反应温度和时间等参数进行了优化。基于优化结果,最终选取最佳条件为:pH 7.4、CS2(11 bp)、CN-GQDs=0.4 mg/mL、20℃孵育10 min,加入KAN后,20℃反应15 min。最后,测定体系FL强度,根据标准曲线计算KAN含量。
2.4 KAN检测和绘制校准曲线
在最佳条件下,分析不同KAN浓度下构建的适配体传感器的荧光光谱,如图6所示。
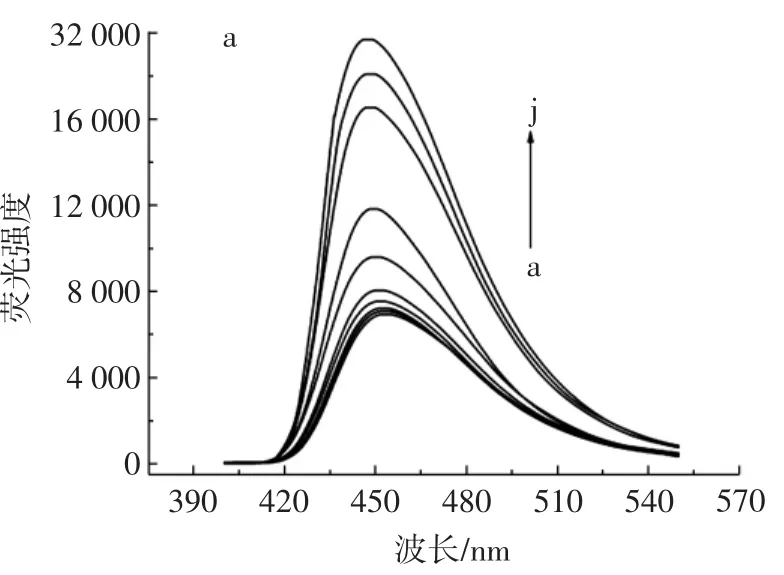

图6 不同KAN浓度下构建的适配体传感器的荧光光谱分析Fig.6 Fluorescence spectrum analysis of aptamer sensors constructed at different Kan concentrations
所制备的传感器的荧光强度变化和KAN浓度在0.1ng/mL~10.0ng/mL范围内保持线性关系。校准曲线可用公式(F-F0)/F0=0.1382C[KAN]+0.0015表示,相关系数为0.999 2。检测限(limit of detection,LOD)为0.036 ng/mL。
2.5 选择性
通常畜牧生产过程中会使用多种抗生素,所以会导致动物性产品中多种抗生素的残留[1]。因此,应研究常见抗生素共存下本方法的靶标特异性,以消除其它常见抗生素的潜在干扰。本试验研究了在氨基糖苷类抗生素和其它主要抗生素共存下体系的荧光特性,结果见图7。


图7 N-GQDs-Apt/N-GQDs-CS对KAN共存物的选择性Fig.7 Selectivity of N-GQDs-Apt/N-GQDs-CS for
由图7a可知,仅有KAN引起体系荧光强度的显著变化(36.5%)。其它常见的抗生素无明显作用(<5%)。结果表明,所开发的体系对KAN的选择性明显高于其它常见抗生素。
为进一步研究其它抗生素对体系的影响,将其中两种氨基糖苷类抗生素,庆大霉素(gentimicin,GEN)和硫酸链霉素(streptomycin sulphate,STR)以及常见的氨苄西林(ampicillin,AMP)进行竞争性试验。由图7b可知,在同时添加5倍浓度上述3种抗生素的情况下,与仅添加KAN的体系相比,未观察到体系荧光回收率有显著差异。可以看出,该结果主要归因于所构建的荧光适配体传感器中适配体与KAN的特异性结合,而与非特异性结合无关。因此,开发的传感器具有很高的选择性优势,为复杂基质样品中KAN的检测提供了一种新的有效方法。
2.6 方法精密度
本研究中,对 3个浓度(0.2、1.0、2.5 ng/mL)的KAN标准溶液分别在不同时间进行荧光检测,以评价本方法的稳定性。通过对同一样品进行日内和日间重复荧光检测,得到本方法的日内和日间精密度。结果表明,本方法的日内和日间相对标准偏差(relative standard deviation,RSD)(n=6) 较小,分别为 0.5%~2.3%和0.9%~4.0%。因此,该方法非常适于痕量KAN的检测,结果见表1。

表1 方法的日内和日间精密度(n=6)Table 1 The intra-and inter-day precisions of the assay(n=6)
2.7 实际样品分析
动物源性实际样品中含有一定浓度的氨基酸、糖类和金属离子等成分,它们可能会对KAN检测结果产生影响。本研究对上述各类共存物进行了干扰试验,以验证本研究方法对动物源性食品样品的适用性。主要包括两部分内容:第一,通过单独添加共存物或KAN,比较它们对体系荧光强度的影响;第二,通过同时添加目标物和上述各共存物,比较共存物对体系荧光恢复效率的影响。各共存物对体系荧光强度的影响见图8。

图8 干扰试验Fig.8 Interference experiment
由图8a可知,单独添加各共存物对体系荧光均无显著影响;由图8b可知,同时添加各共存物和KAN时,体系荧光的恢复程度也与单独添加KAN时相当(KAN、各种氨基酸和糖类浓度为2.5 ng/mL,金属离子浓度为KAN浓度的10倍)。结果表明,各氨基酸、糖类和金属离子等主要共存物对检测体系用于KAN检测并无显著干扰。
本研究还通过多个浓度加标样品检测,绘制了基质标准曲线,并计算了各样品的检出限。结果如图9。

图9 加标样品中荧光强度变化(F/F0-1)与KAN浓度的线性校准曲线Fig.9 The linear calibration of the fluorescence intensity variation(F/F0-1)versus KAN concentration in spiked samples
由图9可知,5种动物源性食品样品均表现出较低的检出限(0.044 ng/mL~0.074 ng/mL)。所以,上述干扰试验、基质标准曲线和样品检出限的结果很好地证明了本研究所构建体系对动物源性食品样品中KAN痕量检测的适用性。
此外,本研究还对6个未知实际样品[牛奶、鱼(2个)、鸡肉、鸡蛋、蜂蜜]进行加标回收试验,以此验证本方法的适用性和准确性。结果如表2所示。

表2 实际样品中KAN的检测(n=3,pH 8.0)Table 2 Analytical results for KAN detecting in actual samples(n=3,pH 8.0)
由表2可知,一个鱼肉样品(0.11 ng/mL)和另一蜂蜜样品(0.16ng/mL)中检测出痕量KAN残留物,但是它们都远低于允许的最大残留量(150ng/mL~200ng/mL)。其它样品的结果则均为阴性。结果显示,各不同浓度加标样品的测量值与KAN添加量保持一致,定量回收率在96.5%~106.9%之间,相对标准偏差(RSD)小于4.0%。鉴于以上结果,证明了该方法具有良好的准确性和可重复性,能用于动物源性食品中KAN检测。
另外,还对本方法与已发表的方法进行了比较,结果如表3所示。

表3 不同KAN测定方法的比较Table 3 Comparison of different methods for the determination of KAN
比较发现,本研究方法具有优于同类型荧光适配体方法的优势,而与其它方法相当。值得注意的是,基于其极为简单的反应过程,本研究方法(包含样品提取过程在内)的整个测试过程可在45 min内完成,因此更加方便有效。总之,这些结果表明,本研究中开发的基于N-GQDs-Apt结构转换诱导N-GQDs聚集/解聚的荧光“开启”适配体传感器具有在动物源性食品等复杂基质样品中高灵敏度快速检测KAN的潜在适用性。
3 结论
本研究开发了一种新型的基于Apt结构转换的荧光“开启”适配体传感器,该传感器能诱导N-GQDs的聚集/解离行为。它被证明适用于动物源性食品中卡那霉素(KAN)的高灵敏度和高效检测。与以前的方法相比,所提出的策略具有以下优点:首先,Apt的结构转换诱导N-GQDs的聚集/分解行为,使体系具有更高的灵敏度和出色的选择性;其次,构建的N-GQDs-Apt/N-GQDs-CS检测体系具有简单、快速的特点;最后,它成功用于检测复杂基质样品中的KAN。总之,本研究中构建的适配体传感器显示出许多突出的优点,包括易于制备、效率高、灵敏度高、特异性好和成本低等。这为分析复杂基质样品中的痕量目标物提供了一种新的有效策略。
