5种淡水鱼鱼糜凝胶基本特性研究
2021-04-29刘芳芳林婉玲韩迎雪李来好李春生杨贤庆周文果
刘芳芳 ,林婉玲 ,韩迎雪,李来好,李春生,杨贤庆,周文果
(1. 农业农村部冷冻调理水产品加工重点实验室,福建 厦门 361022; 2. 中国水产科学研究院南海水产研究所/国家水产品加工技术研发中心,广东 广州 510300; 3. 福建安井食品股份有限公司,福建 厦门 361022; 4. 韩山师范学院食品工程与生物科技学院,广东 潮州 521041)
鱼糜制品是近年来我国发展最为迅速的水产深加工产品之一,因其脂肪含量低、蛋白质含量高、营养结构合理等特点而深受消费者青睐。我国丰富的淡水鱼类资源为鱼糜产品的加工提供了良好的原料,但相比海水鱼,淡水鱼的凝胶性能较差[1]。鱼糜凝胶的形成实质上是肌原纤维蛋白在加热条件下的变性聚集[2],凝胶性能是决定鱼糜产品感官、质构以及风味的因素之一。目前,对鱼糜制品中蛋白质凝胶性能的研究主要集中于其形成机理和影响因素等。目前越来越多的研究发现,肉糜中脂质种类及含量对肉糜体系中蛋白凝胶的弹性模量、食品的流变特性及微观结构有一定影响,从而影响蛋白凝胶的质构特性[3-4]。
一定的脂肪含量为鱼糜制品提供了风味、多汁性、适宜的口感及嫩度,一般认为肌肉脂肪质量分数为3.5%~4.5% (鲜样) 时有良好的适口性,因此脂肪含量不宜过低[5-6]。Debusca等[7]研究表明,在鱼糜中添加油脂会使鱼糜凝胶的弹性模量、剪切力和硬度有所提高。Zhou等[8]研究发现,添加油茶籽油可有效改善鱼糜凝胶的强度、乳化稳定性和持水性 (Water holding capacity, WHC)。也有研究报道油滴大小对凝胶性能有影响,油滴较小时凝胶弹性更好[9]。关于脂质对鱼糜凝胶特性的影响研究主要集中在油脂添加量、种类及颗粒大小等,但有关鱼糜自身脂肪对凝胶特性的影响却鲜有报道。Eymard等[10]研究显示脂肪含量高的鱼转化为鱼糜时会发生脂质氧化,从而降低鱼糜品质;Park等[11]认为鱼糜添加磷脂会加速脂质氧化。本研究选取鱼肉原料蛋白质含量无明显差异、但脂质含量不同的5种淡水鱼类,采用两段加热制成鱼糜凝胶,研究了第一段和第二段加热鱼糜的凝胶特性和化学键变化,并测定了第二段加热稳定凝胶的脂质和磷脂含量,为定向提高淡水鱼鱼糜制品品质和风味、改善鱼糜凝胶特性提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
黄颡鱼 (Pelteobagrus fulvidraco)、草鱼 (Ctenopharyngodon idellus)、鳙 (Aristichthys nobilis)、鲮(Cirrhinus molitorella)、鲢 (Hypophthalmichthys molitrix) 均购自于广州市华润万家超市,为提高实验的可靠性,每种鱼选用质量相当的5条及以上。
乙二胺四乙酸 (EDTA)、8-苯胺-1-萘磺酸(ANS) 和其他常见试剂均为分析纯 (广州领驭生物科技有限公司);磷脂酰乙醇胺 (Phosphatidyl ethanolamine, PE)、溶血磷脂酰乙醇胺 (Lysopnosphatidylethanolamine, LPE)、磷脂酰肌醇 (Phosphatidylinositol, PI)、磷脂酰丝氨酸 (Phosphatidylserine,PS)、鞘磷脂 (Sphingomyelin, SM)、磷脂酰胆碱(Phosphatidyl cholines, PC)、溶血磷脂酰胆碱(Lysophosphatidylcholine, LPC, 美国 Sigma 公司)。
1.2 仪器与设备
IKA-T25组织匀浆机 (德国IKA公司);HH-4快速恒温数显水浴箱 (常州澳华仪器公司);Sunrise-basic吸光酶标仪 (德国TECAN公司);CT3质构仪 (美国Brookfield公司);3K30台式高速冷冻离心机 (德国Sigma公司);CR-410全自动色差仪(上日本柯尼卡美能达光学影像公司);高效液相色谱仪LC-20AD (日本岛津公司);蒸发光散射检测器ELSD−LT II (日本岛津公司);氮吹仪 (美国Organomation 公司)。
1.3 实验方法
1.3.1 鱼糜凝胶制备 将鲜活鱼在通氧条件下运往实验室,立即宰杀清洗制作鱼糜。鱼糜凝胶制作流程:原料处理→采肉→漂洗 [ 水洗1次、0.2%质量分数盐洗1次,每次4 min,肉液质量 (g) 体积 (mL) 比为1∶4,保证水温低于10 ℃,防止蛋白质变性 ] →脱水→擂溃 [ 空擂5 min后加入食盐(质量分数1%) 和白砂糖 (质量分数1%) 继续擂溃10 min,擂溃温度介于4~10 ℃,且在擂溃过程中加冰调节水分 (保证水分质量分数80%)]→灌肠→加热(40 ℃/30 min 为第一段加热;第一段加热的鱼糜凝胶样品在90 ℃加热30 min,即第二段加热,得到稳定鱼糜凝胶)。
1.3.2 凝胶强度测定 将待测样品切成3 cm高的圆柱体,且两端切面平整光滑。采用CT3型质构仪分析鱼糜凝胶的凝胶强度 (g·cm)。参数设定:选用5 mm球形探头;测前速度0.2 cm·s−1;触发点负载5 g;下压位移为1.5 cm;测试速度0.1 cm·s−1。每组样品平行10次,以减小最终误差。
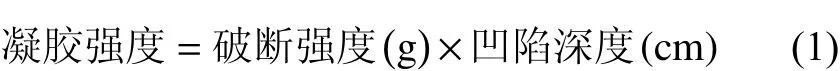
1.3.3 质构特性测定 将待测样品切成2 cm高且切面平整的圆柱体,采用CT3型质构仪分析鱼糜凝胶的质构特性。参数设定:探头型号TA44;测前速度0.2 cm·s−1;下压位移为0.5 cm;测试速度0.1 cm·s−1;测后速度 0.1 cm·s−1;触发力为 5 g。每组样品平行10次。
1.3.4 鱼糜凝胶WHC测定 参考文献[12]的方法,并略作修改。称取鱼肠样品中心部位约3 g样品,厚度约5 mm,将其质量记录为M1,3层滤纸包裹 (2层在下,1层在上) 放入50 mL离心管中,在4 ℃下10 000× g离心10 min,取出后用滤纸擦拭表面残余水分,精确称质量,记录为M2,每个样品测3次取平均值。
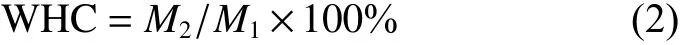
1.3.5 白度 (W) 测定 W的测定参考文献[13-14]等,在不同阶段切取鱼肠中心部位,最终将凝胶样品切成5 mm厚的薄片,然后用全自动色差仪测定W [L*为明度,黑暗色至明亮色 (0~100) ;a*为红度值 (红色到绿色 (60~ −60);b*为黄度值(黄色到蓝色 (60~ −60)],每个样品取5片,每片测3次,最终取15次测定数值计算平均值。
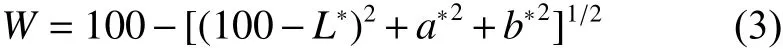
1.3.6 肌原纤维蛋白的提取 依据姚慧等[15]方法。称取样品5 g,加入4倍体积pH 7.2的10 mmol·L−1Tris-HCl缓冲液,高速均质 20 s,然后离心 10 min (4 500 r·min−1, 4 ℃);倒掉上清液取沉淀加入 4 倍体积 10 mmol·L−1Tris-HCl缓冲液[含 0.6 mol·L−1氯化钠 (NaCl),pH 7.2] 均质,在4 500 r·min−1条件下离心 20 min,上清液即肌原纤维蛋白提取液。
1.3.7 表面疏水性的测定 参考文献[16],以1-苯奈氨-8-磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 作为荧光探针,用上述肌原纤维蛋白提取液将蛋白浓度分别调节至0.125、0.25、0.5、0.75、1.00 mg·mL−1,然后加入 15 μL 8 mmol·L−1的 ANS溶液混匀,室温避光反应15 min,然后测其荧光强度。荧光光谱的条件设定:激发波长390 nm,发射波长468 nm,狭缝宽度5 nm。所得荧光强度对蛋白浓度的斜率即为表面疏水性。
1.3.8 二硫键的测定 参照文献[16],肌原纤维蛋白用相应缓冲液将质量浓度调至4 mg·mL−1后,取0.5 mL加入3.0 mL新配pH 9.5的NTSB检测液混匀,于室温 (25 ℃) 下避光反应25 min,于412 nm处测其吸光值。计算公式为:
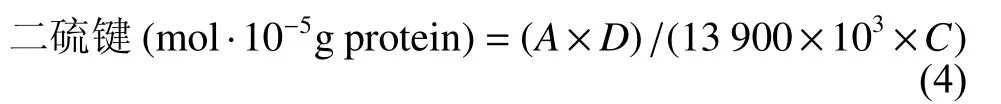
式中A为412 nm处的吸光值;D为稀释倍数,此处为7;C为肌原纤维蛋白溶解质量浓度,此处为 4 mg·mL−1。
新配NTSB检测溶液的制备方法。用新配制的溶液 [ 含2 mol·L−1异硫氰酸胍(CH5N3·HSCN),50 mmol·L−1Gly, 100 mmol·L−1亚硫酸钠 (Na2SO3),3 mmol·L−1EDTA, pH 9.5] 以 1∶100 稀释 NTSB 原液 (100 mg DTNB 溶于 10 mL、1 mol·L−1的Na2SO3溶液中,调pH为7.5,在38 ℃恒温条件下通O2反应,至溶液变为淡黄色终止反应)。
1.3.9 脂质的测定 鱼糜凝胶脂质测定参照文献[17]。准确称取一定质量的样品 (m, g) 于50 mL离心管中,加入15 mL含0.01% BHT的氯仿-甲醇(2∶1, V/V) 溶液,然后在 10 000 r·min−1条件下均质1 min (冰浴),再定容至30 mL,静置1 h后过滤,直接将滤液盛放到已知质量的离心管 (M0, g) 中,加入0.2倍体积的生理盐水,最后在3 000 r·min−1的条件下离心15 min,弃去上层水与甲醇等液体杂质,下层脂质溶液用氮气吹扫有机试剂,冷却至恒质量后称质量 (M, g),得到浓缩脂质。脂质质量分数 (Wl, g·kg−1) 计算公式为:
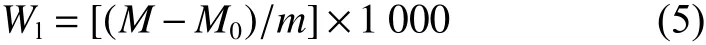
1.3.10 磷脂的测定 参考韩迎雪等[18]的方法,采用高效液相色谱仪测定磷脂含量及组成。HPLC条件:选用Chromolith®Performan-ce-Si型正相硅胶色谱柱 (100 mm×4.6 mm);柱温箱温度30 ℃;流动相为正己烷-异丙醇-乙酸溶液体系,流速为1.5 mL·min−1,进样量为 20 μL。ELSD 条件:选用氮气为雾化气,压强320 kPa,漂移管温度70 ℃。
1.3.11 数据处理 采用SPSS 22.0对多组数据进行分析,结果用“平均值±标准差( X ±SD)”表示,多组数据差异性分析采用单因素ANOVA检验的邓肯比较模型,P<0.05表示差异显著,所有图表均用Excel 2013软件绘制。
2 结果与分析
2.1 凝胶强度
凝胶强度是衡量鱼糜品质最基本的指标,影响着鱼糜凝胶的质构及持水性[19]。5种淡水鱼鱼糜第一和第二段加热的凝胶强度均差异显著 (P<0.05),且第一段加热的鱼糜凝胶在第二段加热后,其凝胶强度增加幅度差异显著 (表1)。第一段加热,鲮的凝胶强度最大,草鱼的最小;第二段加热后,鲢的凝胶强度最大 (351.18 g·cm),鲮的凝胶强度仅为232.26 g·cm。相比第一段加热,第二段加热后草鱼、鲮、鳙、黄颡鱼和鲢的凝胶强度分别增加了68.58%、33.63%、61.72%、34.06%和70.66%,其中鲮和黄颡鱼的增加幅度明显低于其他3种。蛋白质和脂肪是鱼糜凝胶体系中除水分以外含量最多的组分,蛋白质含量在很大程度上决定了凝胶的性质,本研究中5种淡水鱼原料粗蛋白含量无明显差异,因此导致凝胶强度差异显著的原因可能是不同种鱼在经过漂洗、斩拌等工序后,鱼糜本身所含的盐溶性蛋白、脂质等不同。

表1 5种淡水鱼第一段和第二段加热鱼糜凝胶的凝胶强度Table 1 Gel strength of first and second heated surimi gels of five kinds of freshwater fish
2.2 质构特性
5种淡水鱼第一段和第二段加热鱼糜凝胶的全质构分析 (Texture profile analysis, TPA) 数据见表2。对于硬度和咀嚼性,第一段加热鱼糜凝胶的咀嚼性差异较小,在1.20~2.02 mJ范围内鲮最大,鳙次之,且无明显差异,同时其硬度也无明显差异。草鱼的硬度和咀嚼性均最小,黄颡鱼、鲢的咀嚼性与草鱼差异不显著,但鲢的硬度却显著大于其他4种鱼 (153.4 g)。第一段加热的鱼糜凝胶在第二段加热后,5种淡水鱼鱼糜凝胶的硬度和咀嚼性显著增大 (P<0.05),表明高温加热更易形成咀嚼性较好的鱼糜凝胶。5种淡水鱼鱼糜凝胶硬度差异显著(P<0.05)。草鱼、鲮、鳙、黄颡鱼和鲢的硬度分别增加了69.13%、37.16%、62.55%、71.81%和7.5%,鲢的增加幅度明显小于其他4种;其中鳙和黄颡鱼的硬度较大,鲮的硬度最小。咀嚼性大小和硬度顺序一致,但增加程度有所差异。
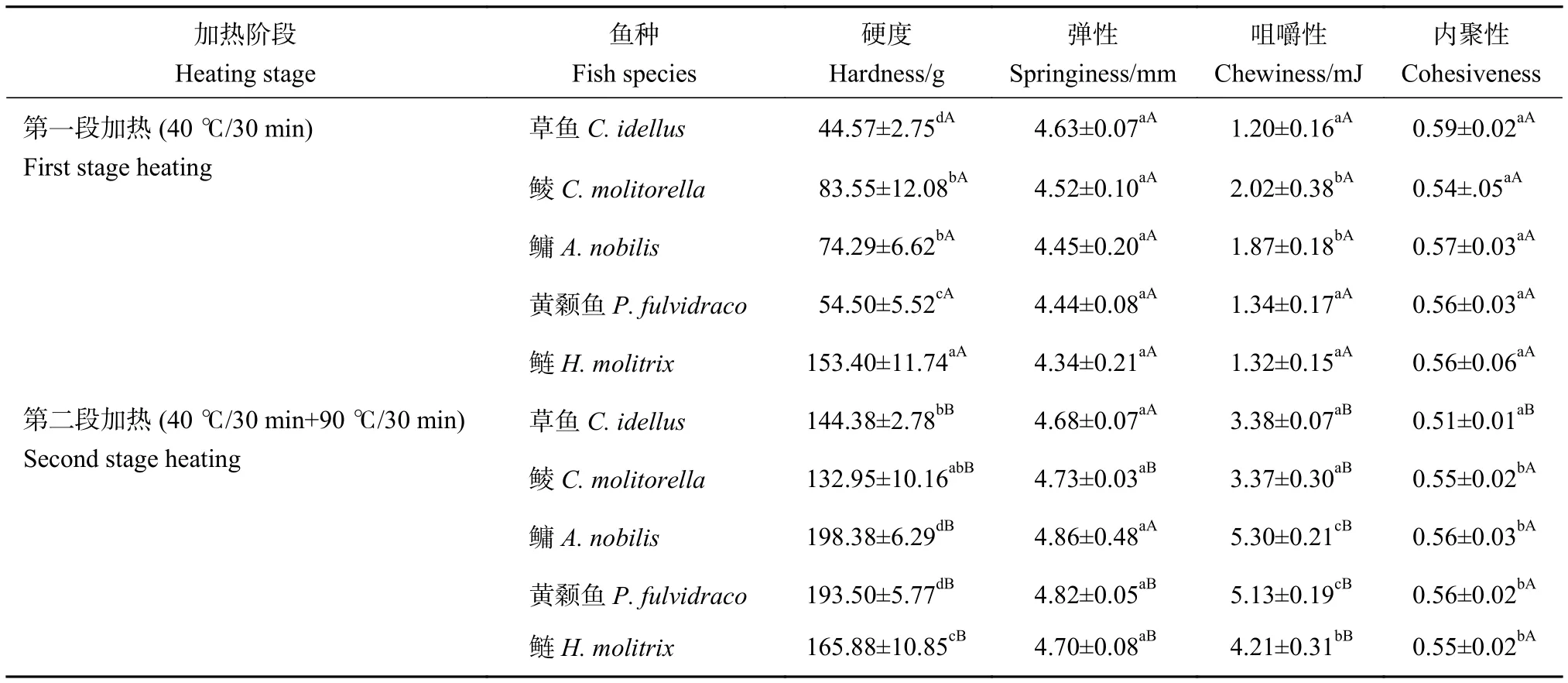
表2 5种淡水鱼第一段和第二段加热鱼糜凝胶的质构特性Table 2 Texture characteristics of first and second heated surimi gels of five freshwater fish
对于弹性和内聚性,5种淡水鱼第一段加热的鱼糜凝胶均无显著差异 (P>0.05),但经第二段加热后,变化较为复杂,草鱼鱼糜凝胶内聚性明显变小,而其他4种鱼无显著变化 (P>0.05)。草鱼和鳙的弹性无明显变化,而鲮、黄颡鱼和鲢则显著增大(P<0.05),且5种淡水鱼的弹性无明显差异。刘友明等[20]对不同凝胶化温度处理的草鱼和鲢的肌原纤维蛋白凝胶弹性进行比较发现,40 ℃加热的鱼糜凝胶弹性显著大于30 ℃加热和90 ℃直接加热形成的凝胶,而60 ℃加热的鱼糜凝胶弹性最小,因此可以推测在40~90 ℃之间某一温度达到最大值、随后通过劣化区时,蛋白质变性明显,造成弹性再次降低。根据内聚性的研究结果可知,一般在较低温度下形成的鱼糜凝胶的内聚性较好。
2.3 持水性
蛋白质在高温加热时结构展开,在氢键作用下结合大量游离的水分子,从而形成弹性凝胶体,增强对水分子的截留能力[21]。5种淡水鱼第一段加热凝胶样品的持水性介于57.55%~70.45% (表3),差异显著,其中鲢的最大,鲮的最小。经过第二段加热形成稳定凝胶后,鳙、鲮、鲢、黄颡鱼和草鱼的持水性分别增加了21.44%、32.86%、16.14%、26.56%和26.20%,持水性均较好 (86%以上),但持水性增加程度差异较大,尤其是鲢,其增加程度远小于其他4种鱼。有研究表明,低温鱼糜凝胶在进行第二段高温加热的情况下,凝胶网络结构会在这一阶段较短时间内迅速形成,持水性也会相应达到最大值,然后在一段时间内持续加热,持水性基本趋于平缓,变化相对较小[22]。本研究中不同种鱼在经过高温加热后持水性变化程度差异较大,可能与加热时间及不同种鱼肌原纤维蛋白形成凝胶的稳定性差异较大有关。

表3 5种淡水鱼第一段和第二段加热鱼糜凝胶的持水性Table 3 Water holding capacity of first and second heated surimi gels of five freshwater fish %
2.4 白度
白度也是评价鱼糜的标准之一,直接影响消费者对商品的可接受度。一般来说,白度越大,产品越受消费者喜爱。通常L*较大、b*较小,鱼糜制品的整体白度更大。5种淡水鱼第一段和第二段加热鱼糜凝胶的白度数据 (表4) 显示,第一段加热鱼糜凝胶白度由大到小依次为鲢、鲮、黄颡鱼、鳙、草鱼。a*均为负值,5种鱼差异显著;b*介于8.93~15.59,即凝胶颜色偏向黄色,5种鱼差异显著,其中鲮最小,鳙最大。经第二段加热后,5种淡水鱼的L*和白度显著增加,草鱼、鲮、鳙、黄颡鱼和鲢的白度分别增大15.50%、4.79%、6.99%、11.23%和0.43%,总体而言,5种淡水鱼在形成稳定凝胶时的白度较好,鳙最小 (79.36),草鱼最大(84.82),鲮、黄颡鱼和鲢的白度值均大于80。
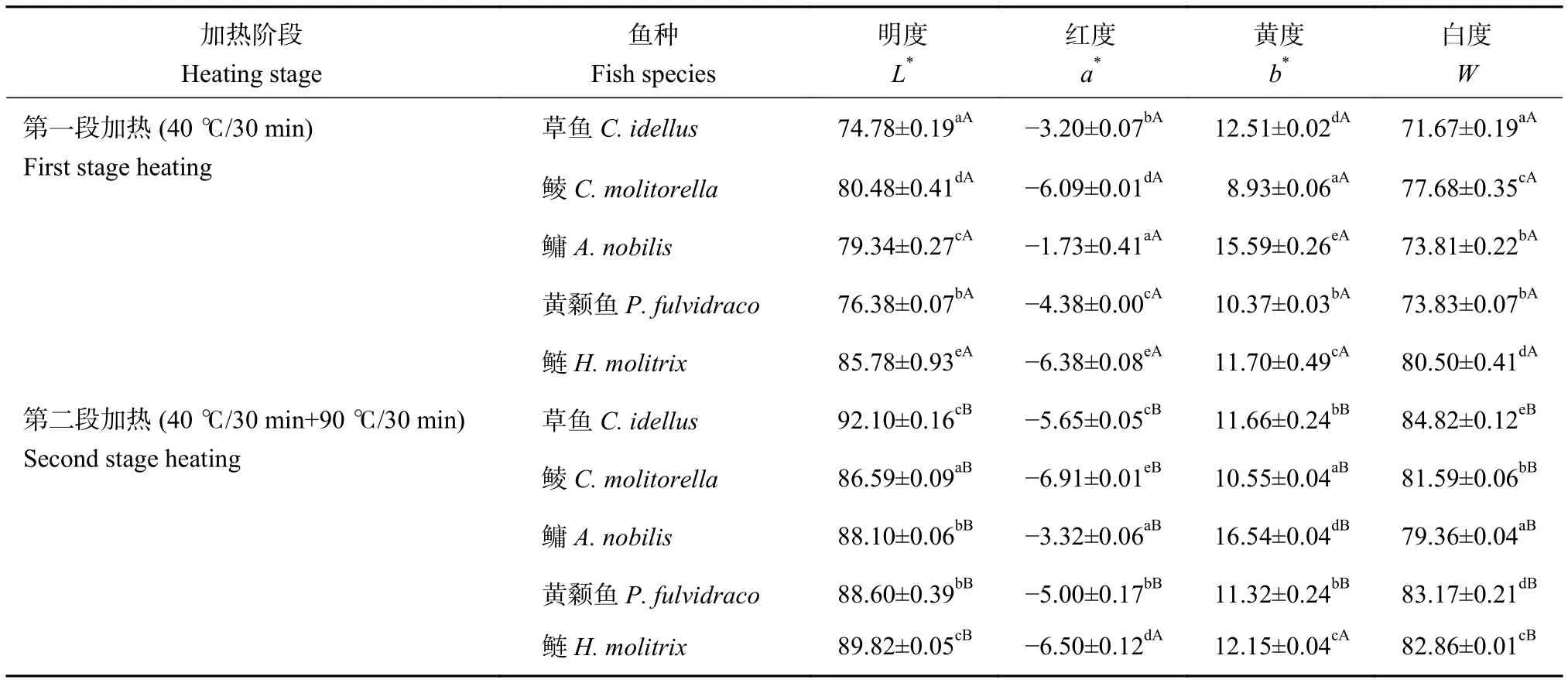
表4 5种淡水鱼第一段和第二段加热鱼糜凝胶的白度Table 4 Whiteness of first and second heated surimi gels of five freshwater fish
通常凝胶结构越致密,白度越大。白度主要取决于水分和蛋白质,尤其是肌球蛋白和血红蛋白的含量、蛋白质变性程度、聚合程度以及物体表面的光学特性[23]。本研究发现,经过第二段加热后,除鲢的a*无明显变化,其他4种鱼a*的绝对值均增加,表明绿度增大。除鲢外,其他4种鱼的b*均显著减小 (P<0.05),黄度下降,结合白度增加程度,表明高温加热对鲢鱼色差值影响较小。不同淡水鱼蛋白质对相同加热温度的敏感性也有差异,因此白度增加程度也有差异。
2.5 肌原纤维蛋白的主要化学键
肌原纤维蛋白是含量最高且热诱导凝胶形成的关键蛋白质,二硫键是热诱导蛋白质形成凝胶的主要化学键,起稳定蛋白质空间结构的重要作用。廖慧琦等[24]发现鱼糜凝胶的硬度、胶黏性与肌原纤维蛋白凝胶的硬度、胶黏性具有很强的相关性。本研究中5种淡水鱼第一段加热形成的鱼糜凝胶的二硫键含量差异显著,鳙最大,黄颡鱼最小;经第二段加热后,鲮、鲢和草鱼的二硫键分别增加6.85%、7.45%和8.82%,而鳙和黄颡鱼无明显变化 (表5),表明不同种鱼二硫键形成的最适温度有一定差异,鳙和黄颡鱼的二硫键形成最适温度约为40 ℃,而其他3种鱼则高于40 ℃。Ko等[25]研究罗非鱼肌球蛋白时发现,其二硫键形成的最适温度高于75 ℃,贾丹等[26]发现鲢肌球蛋白疏水键和表面疏水性在约60 ℃达到最大。总体而言,在经过第二段加热形成稳定凝胶后,二硫键含量介于3.01~3.78 mol·10−5g,鲢和鳙较高,黄颡鱼则明显小于其他4种鱼。于传龙等[27]通过对混合鱼糜凝胶强度和二硫键含量进行相关性分析发现,二硫键含量和凝胶强度呈极显著相关性 (R=0.710),本研究发现凝胶强度较大的鳙和鲢的二硫键含量也明显大于其他3种鱼;而凝胶强度最小的黄颡鱼,其二硫键含量明显小于其他4种鱼,即凝胶强度较高的鱼的二硫键含量大于凝胶强度较小的鱼。
表面疏水性的变化与蛋白质结构有一定关联性,而加热会使埋藏在蛋白质内部的疏水基团暴露,疏水性区域的暴露是蛋白质聚集的前提[28]。经过第二段加热后,5种淡水鱼肌原纤维蛋白的表面疏水性均显著增大 (表5,P<0.05),且不同种鱼差异显著。第一段加热的鱼糜凝胶中,鳙的肌原纤维蛋白表面疏水性明显大于其他4种鱼,经高温加热后增加了21.88%,仍最大,但增加程度比鲮、鲢、草鱼和黄颡鱼 (分别为36.03%、39.37%、42.61%和65.07%) 明显要小。黄颡鱼第一段加热鱼糜凝胶的表面疏水性最小 (210.34),而第二段加热其表面疏水性仅次于鳙 (602.22)。草鱼、鲢和鲮鱼糜凝胶两段加热的表面疏水性差异均较小。
表5 5种淡水鱼第一段和第二段加热鱼糜凝胶的化学键Table 5 Chemical bonds of first and second heated surimi gels of five freshwater fish
2.6 第二段加热鱼糜凝胶的脂质含量
脂肪是肉制品中的一种典型的填充凝胶,尤其在西式乳化灌肠制品中,脂肪含量会明显影响肉糜和鱼糜制品的结构和持水力。贾丽娜[29]研究发现,当脂肪添加量低于1%或脂肪添加量为2%~3%时,随着脂肪含量增加,猪油显著提高了罗非鱼肌原纤维蛋白的凝胶强度。5种淡水鱼第二段加热鱼糜凝胶的脂质质量分数差异显著 (表6,P<0.05)。鱼肉原料在经过漂洗后,能够除去脂肪以及腥臭物质,一般低脂鱼中少量脂肪对凝胶特性影响较小,但对含脂量较高的鱼类,在加工过程中,脂肪的氧化会造成鱼糜品质的下降。本研究中黄颡鱼鱼糜凝胶的脂质质量分数达76.45 g·kg−1,明显大于其他4种,因含水量相同,故黄颡鱼鱼糜凝胶的蛋白质含量显著低于其他鱼种。

表6 5种淡水鱼第二段加热鱼糜凝胶脂质含量Table 6 Lipid content of second heated surimi gels of five freshwater fish g·kg−1
2.7 第二段加热鱼糜凝胶的磷脂组成及含量
磷脂是构成生物膜的重要物质,也是生命的基础物质之一,是一种结合脂质,因此不会被漂洗掉,是鱼糜加工过程中一直存在的物质。Konno等[30]发现磷脂酰胆碱含量增加可明显减少阿拉斯加鳕鱼糜凝胶的形变量,从而影响凝胶强度的大小。本研究测定了5种淡水鱼鱼糜凝胶自身的磷脂质量分数 (表 7),磷脂总量介于 1.929~3.452 mg·g−1,差异显著 (P<0.05),磷脂总量的顺序为草鱼>鲮>鳙>黄颡鱼>鲢。在5种淡水鱼糜凝胶中均检测到了磷脂酰乙醇胺 (PE)、磷脂酰肌醇 (PI)、磷脂酰丝氨酸 (PS)、磷脂酰胆碱 (PC)、鞘磷脂 (SM),含量较高的为PE、PI和PC,PS和SM含量较低。草鱼鱼糜凝胶的PE、PI、PS和PC质量分数均显著高于其他4种,分别为1.824、0.579、0.137和0.835 mg·g−1。鲢 PE 质量分数最小 (1.095 mg·g−1),鳙的PI、PS和SM均为5种淡水鱼鱼糜凝胶中含量最低。参考王霞[31]对海水鱼鱼糜凝胶本身含有磷脂的研究,得出磷脂与鱼糜品质指标有一定相关性,PI与凝胶强度的相关系数为负值 (−0.516)。本研究中PI含量较高的黄颡鱼和草鱼的凝胶强度明显小于鲢和鳙,因此推测PI含量过高可能对凝胶强度有一定的不利影响。
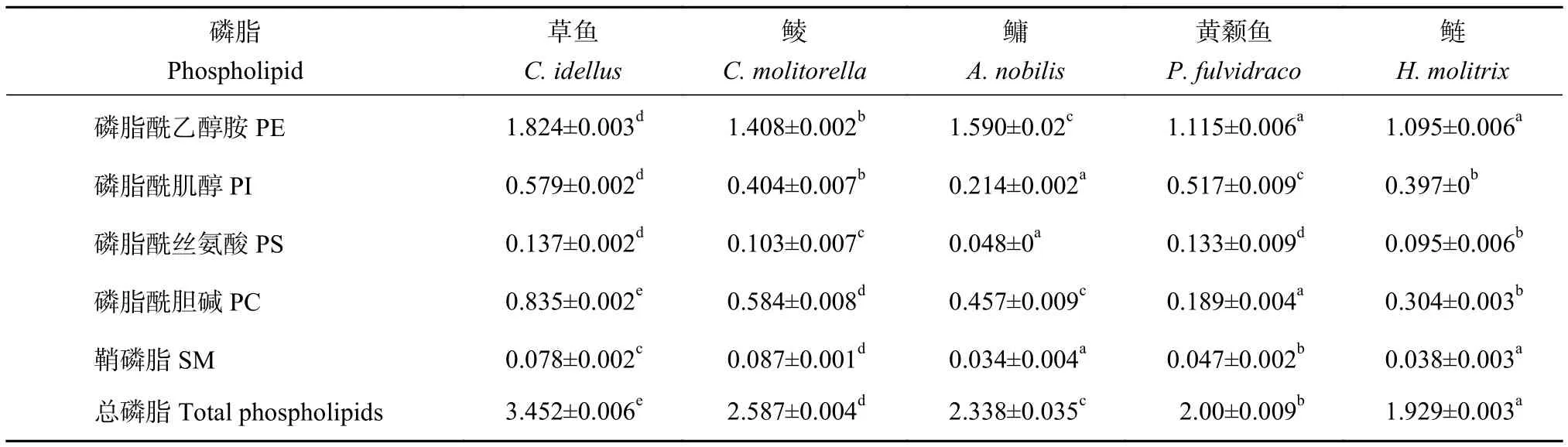
表7 5种淡水鱼第二段加热鱼糜凝胶的磷脂组成及含量Table 7 Phospholipid composition and content of second heated surimi gels of five freshwater fish mg·g−1
3 结论
通过分析5种淡水鱼鱼糜凝胶特性,发现鱼糜的凝胶强度、硬度、咀嚼性、持水性和白度等基本性能在第二段加热时达到最大值,而弹性和内聚性两段加热的差异较小。肌原纤维蛋白化学键的研究结果表明,不同鱼种的化学键含量差异显著,凝胶强度较大的鱼的二硫键含量较高。另外,对脂质、磷脂分析显示鱼糜自身脂质含量过高可能不利于凝胶结构的形成,磷脂中的PI对凝胶强度有一定的不利影响。综上,原料蛋白质含量无明显差异的鱼种,其凝胶强度却差异较大,一般二硫键含量较多、PI含量较少的鱼糜凝胶强度较大。
