不同消毒剂对凡纳滨对虾育苗水质和菌群结构的影响
2021-04-29张文伟段亚飞林黑着江世贵黄建华
张文伟,黄 忠 ,段亚飞,林黑着 ,江世贵,黄建华
(1. 广州大学生命科学学院,广东 广州 510006; 2. 中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室,广东 广州 510300; 3. 中国水产科学研究院南海水产研究所深圳试验基地,广东 深圳 518121)
自2000年以来,随着凡纳滨对虾 (Litopenaeus vannamei) 的引入、推广和普及,中国对虾养殖业迅猛发展,已成为水产养殖的重要支柱产业。近年来,近海水域环境生态失衡、富营养化、赤潮频发、病害滋生给水产养殖带来巨大损失。环境微生物和养殖生物之间的相互作用受到越来越多的关注[1-2]。在水产养殖中,微生物菌群在水环境物质转化以及养殖动物健康、营养吸收、病原防御过程中发挥着重要作用[3-4]。关于养殖对虾肠道微生物和养殖环境的关系已有较多的研究报道,如发病对虾和健康对虾肠道微生物与养殖环境微生物之间的关系[5-9]。而有关对虾早期发育阶段的幼体微生物和育苗水环境微生物之间的互作关系,以及对幼苗期与养成期对虾体内微生物的相关性研究相对较少。
对虾幼体发育对水环境质量要求非常高。近海水环境的富营养化、有害细菌及其耐药性的加重,使对虾育苗病害增多,苗种生产难度增大。海水净化处理已成为对虾育苗生产的重要环节,直接影响育苗生产的成败[10]。传统水处理方法主要采用物理过滤和化学消毒以降低或消除水环境中的有毒有害物质。邢诒炫等[10]报道砂滤对海水中细菌的去除率为80%~90%,多级砂滤与一级砂滤对细菌的去除率并无显著差异。因此,绝大多数育苗场会再使用含氯或其他化学消毒剂对对虾育苗用水进行消毒杀菌处理。水产消毒剂主要有醛类 [ 甲醛 (HCHO)、戊二醛 (C5H8O2)]、季铵盐类和卤素类 (含氯、溴、碘)。研究表明,0.5 mg·L−1有效氯可杀死总菌量的96.1%,1 mg·L−1有效氯可杀死99.1%的细菌[11]。19 mg·L−1甲醛在短时间内对细菌有一定的杀灭、抑制作用,但并不能长效控制育苗水体细菌总数[10]。二氧化氯 (ClO2)和碘制剂对细菌及芽孢、病毒、真菌等微生物有强大的杀灭作用,且不产生抗药性,是一种低毒、广谱杀菌消毒药物,在水产养殖和育苗中广泛应用[12]。
近年来,育苗用水的处理工艺越来越复杂化,往往采用物理 (沉淀、过滤) -化学 (消毒) -物理 (紫外杀菌) 等多个复杂处理工艺来提升育苗水质,而这些处理对育苗水环境微生物菌群的影响,以及后续对幼体发育及其体内菌群的影响尚不清楚;此外,幼体不同发育阶段对营养需求和摄食习性的不同,也可能影响幼体及其水环境菌群结构。因此,本研究采用传统实验方法和细菌16S rDNA高通量测序技术,研究了碘 (I2)、二氧化氯、甲醛溶液和漂白粉 [Ca(ClO)2] 4种常用消毒剂对对虾育苗水质、水环境和对虾幼体肠道微生物菌群的影响及育苗效果,以期为凡纳滨对虾育苗水体消毒处理及其菌群调控提供科学依据。
1 材料与方法
1.1 对虾育苗实验和样品采集
本实验在中国水产科学研究院南海水产研究所深圳试验基地进行。实验海水先经砂滤和沉淀,再通过300目以上的棉布滤袋过滤后进入500 L的玻璃钢实验桶,实际育苗水体为400 L。实验共分为5组,即对照组、碘组、二氧化氯组、甲醛组和漂白粉组,每组3个平行,使用剂量参照育苗生产推荐浓度和参考文献[10–12]。对照组水体不用消毒剂处理;碘组水体使用1 mg·L−1碘消毒;二氧化氯组水体使用3 mg·L−1二氧化氯消毒;甲醛组水体使用25 mL·m−3甲醛溶液消毒;漂白粉组水体使用30 mg·L−1漂白粉消毒。各组水体经消毒和曝气处理48 h后,投入凡纳滨对虾无节幼体 (购自深圳环球生物科技有限公司),幼体初始密度为200尾·L−1。实验期间,无节幼体 (N6)或溞状幼体(Z1)期幼体开始喂食螺旋藻粉和虾片,并逐步增加虾元、BP、黑粒等富含蛋白质、脂肪、维生素和矿物质的人工配合饲料。各桶育苗水体连续曝气,无水交换,不使用抗生素和其他化学药物。海水盐度 30,pH 8.0~8.2,温度 (30±0.5) ℃,溶解氧质量浓度6.0 mg·L−1以上,均能满足对虾幼体发育需求。
每天取少量幼体用显微镜观察确认发育情况,并计数,计算每个发育期的成活率。在不同消毒剂处理0、48、96 h后,每组取1 L 水体,用0.22 μm滤膜过滤,收集滤膜于无菌冻存管中; 在N6、Z1、糠虾幼体 (M1) 和仔虾 (P1) 等关键发育时期,从每个实验桶随机采集1 L育苗水体,用0.22 μm滤膜过滤,收集滤膜于无菌冻存管中;此外,使用40目筛绢捞网从每个实验桶中取幼体1 g,先用干净过滤海水冲洗,再用75%乙醇对幼体进行体表消毒,最后用无菌海水冲洗3次置于无菌冻存管中。所得滤膜和幼体均于−80 °C保存,用于微生物菌群分析。
1.2 细菌测定方法
在不同消毒剂处理后24和72 h,各实验组采集10 mL海水,在N6—P1和P5幼体不同发育时期,从每个实验桶随机采集10 mL育苗水体,取0.5 mL,用无菌海水按10、100、1 000倍数进行稀释,然后取0.1 mL稀释水样滴入到已经制备好的2216E和TCBS (Thiosulfate citrate bilesaccharose)培养基上,用灭菌玻璃棒将水样涂抹均匀至完全被培养基吸收,28 ℃恒温培养,于72 h 后采用平板计数法计算弧菌和异养菌数量。计数时选取菌落数30~300之前的平板,每个稀释度取3个平行样结果的平均值。
1.3 细菌总DNA提取及群落结构分析
使用DNA提取试剂盒 (Mo Bio Laboratories,Inc., Carlsbad, CA) 抽提水体滤膜和幼体微生物菌群DNA,并用1.0%琼脂糖凝胶电泳分析DNA质量。采用正向引物 (CCTACGGRRBGCASCAGKVRVGAAT) 和反向引物 (GGACTACNVGGGTWTCTAATCC) 对细菌16S rDNA基因的V3—V4区进行PCR扩增。PCR反应体系共20 μL,包含模板 DNA 20 ng、5×FastPfu buffer 4 μL、2.5 mmol·L−1dNTPs 2 μL、5 μmol·L−1正反向引物各0.8 μL、FastPfu 聚合酶 0.4 μL,补充 ddH2O 至总体积20 μL。使用MetaVx™文库构建试剂盒构建测序文库,Agilent 2100生物分析仪检测文库质量,并且通过Qubit 2.0 Fluorometer检测文库浓度。DNA文库混合后,在Illumina MiSeq平台进行PE300双端测序。所得序列经过质控、组装后,使用16S rRNA参考数据库Silva 123进行比对;然后使用QIIME软件 (1.9.1) 基于RDP classifier (Ribosomal Database Program) 贝叶斯算法对OTU的代表性序列进行物种分类学注释,并在属分类水平上分析各组菌群的组成差异。菌群高通量测序分析委托广州吉瑞基因有限公司完成。
1.4 氨氮与亚硝酸氮质量浓度的测定
每个平行组每天取300 mL育苗水体,经0.45 μm滤膜抽滤后,用于氨氮与亚硝酸氮质量浓度测定,分别采用《海洋调查规范》 (GB/T 12763.4—2007) 中的溴酸钠氧化法和重氮-偶氮光度法测定。
1.5 数据分析
所得数据采用SPSS 17.0软件进行统计学分析,P<0.05表示差异显著。
2 结果
2.1 水体氨氮和亚硝酸盐质量浓度变化
使用消毒剂前测定二级过滤海水中的氨氮质量浓度为0.005 mg·L−1,使用不同消毒剂消毒24 h后测定为 0.003~0.006 mg·L−1,不同实验组间没有显著差异 (P>0.05)。溞状幼体 (Z1—Z3) 发育阶段,各组水体氨氮质量浓度迅速上升,其中对照组显著高于各消毒处理组 (P<0.05)。糠虾幼体 (M1—M3) 以后,除漂白粉组的氨氮质量浓度有所下降外,对照组和其他消毒剂处理组氨氮质量浓度均在0.10 mg·L−1水平波动,最高组的氨氮质量浓度为0.115 mg·L−1(图 1-a)。
使用消毒剂前测定过滤海水中的亚硝酸盐质量浓度为0.005 mg·L−1,使用不同消毒剂消毒24 h后测定为 0.003~0.006 mg·L−1,不同实验组间无显著差异 (P>0.05)。Z2期之前,各组水体亚硝酸盐质量浓度迅速上升,之后呈缓慢上升趋势。M3期之前,对照组、碘组和二氧化氯组的亚硝酸盐质量浓度显著高于甲醛组和漂白粉组。整个育苗期间,漂白粉组的亚硝酸盐质量浓度均为最低,而对照组亚硝酸盐质量浓度最高,P5期升到最高值0.065 mg·L−1(图 1-b)。

图1 不同实验组中水体氨氮和亚硝酸氮质量浓度变化Figure 1 Change in mass concentrations of ammonia nitrogen and nitrite nitrogen in water in different groups
2.2 水体总菌和弧菌数量变化
使用消毒剂前测定二级过滤海水中的总异养细菌数量为2.88×105CFU·mL−1,使用不同消毒剂消毒24和72 h [ 无节幼体 (N) 期]后,测定各组水体中总异养细菌数量和灭菌效率见表1。甲醛对海水中细菌杀灭最为有效,第24和第72小时灭菌效率分别为94.62%和84.46%;二氧化氯次之,分别为89.24%和68.66%;碘和漂白粉在第24小时灭菌效率分别为74.65%和48.96%,但第72小时两组细菌总数与对照组接近。One-way ANOVA分析结果表明,甲醛组和二氧化氯组第24与第72小时细菌总数显著低于碘组、漂白粉组和对照组。

表1 不同消毒剂组育苗海水处理24与72 h (无节幼体期) 水体中总异养细菌数量及灭菌效率Table 1 Number of heterotrophic bacteria and sterilization efficiency in seawater treated with different disinfectant groups for 24 h and 72 h (N stage)
随着幼体生长发育,各组水体总菌数量均不断升高 (图2-a)。其中,幼体在Z2期之前,甲醛组和二氧化氯组的总菌数量显著低于碘组、漂白粉组和对照组 (P<0.05),随后甲醛组和二氧化氯组总菌数量明显升高;P5幼体期,漂白粉组和甲醛组的总菌数显著高于其他3组 (P<0.05)。
幼体在Z2期之前,甲醛组和二氧化氯组的弧菌数量显著低于碘组、漂白粉组和对照组 (P<0.05);幼体在M2期之前,弧菌数量一直维持较低水平,之后随着其发育生长,各组弧菌数量急剧上升。P5幼体期,碘组和二氧化氯组弧菌数量显著高于漂白粉组、对照组和甲醛组 (P<0.05,图2-b)。

图2 不同实验组中水体总菌和弧菌数量变化Figure 2 Changes of total aquatic bacteria and Vibrio in different groups
2.3 水体和幼体菌群结构分析
使用不同消毒剂0、48、96 h后各组水体属水平菌群组成相对丰度见图3。使用不同消毒剂0 h后,对照组初始水体主要优势菌属为东吉科拉属(Donghicola) 和红杆菌属 (Rhodobacteraceae),分别占43.2%和25.5%;二氧化氯组为红杆菌属和Nautella,分别占38.4%和9.3%;碘组为红杆菌属、东吉科拉属和Nautella,分别占27.4%、7.4%和5.8%;甲醛组为假交替单胞菌属 (Pseudoalteromonas)、交替单胞菌属 (Alteromonas) 和嗜甲基菌属 (Methylophaga),分别占43.6%、34.3%和5.0%;漂白粉组为嗜甲基菌属和假交替单胞菌属,分别占83.4%和4.0%。使用消毒剂48 h后,对照组初始水体主要优势菌属为东吉科拉属和红杆菌属,分别占23.3%和20.9%;二氧化氯组为红杆菌属、黄杆菌科未能培养属和东吉科拉属,分别占比18.0%、8.4%和8.4%;碘组为红杆菌属、Thalassococcus、海命菌属 (Marivita) 和东吉科拉属,分别占比41.8%、10.7%、7.4%和7.3%;甲醛组为嗜甲基菌属、Mesoflavibacter、假交替单胞菌属和东吉科拉属,分别占比84.0%、3.7%、2.7%和2.0%;漂白粉组为交替单胞菌属、Leisingera、Nautella和盐单胞菌属 (Halomonas),分别占比44.0%、20.9%、12.9%和12.2%。使用消毒剂96 h后,对照组初始水体主要优势菌属为东吉科拉属、红杆菌属和Gammaproteobacteria incertae sedis_unclassified,分别占27.1%、15.5%和5.5%;二氧化氯组为红杆菌属、Gammaproteobacteria incertae sedis_unclassified和东吉科拉属,分别占比30.2%、10.9%和8.7%;碘组为红杆菌属、军团菌属 (Legionella)、东吉科拉属、嗜甲基菌属、Thalassococcus和海命菌属,分别占比38.2%、13.5%、6.2%、5.4%、3.2%和3.1%;甲醛组为Leisingera、Tropicibacter、嗜甲基菌属、Mesoflavibacter和东吉科拉属,分别占比29.6%、23.3%、8.0%、5.9%和4.0%;漂白粉组为Leisingera、Thalassococcus、Nautella、嗜甲基菌属、红杆菌属、黄杆菌属 (Tenacibaculum)、交替单胞菌属和盐单胞菌属,分别占比24.9%、17.1%、10.2%、9.6%、6.9%、6.2%、5.5%和3.0%。

图3 不同消毒剂0、48和96 h后各组水体属水平菌群组成相对丰度Figure 3 Relative abundance of microbial community of hatchery water after 0 h, 48 h and 96 h of different disinfectants groups at genus level
在幼体各发育阶段,从育苗水体和对虾幼体中共鉴定出237个菌属,其中水体优势菌属有50种,而幼体优势菌属有33种。不同处理组不同发育期育苗水体的主要优势菌属差异很大,尤其是N6期和Z1期细菌属种类多,差异大 (图4)。N6期育苗水体中主要优势菌属为OM43_clade、食烷菌属(Alcanivorax)、AEGEAN-169_marine_group、岸生菌属 (Litoricola)、Porticoccus、赤杆菌属 (Erythrobacter)、交替赤杆菌属 (Altererythrobacter)、Lutimaribacter、黄杆菌属、Coxiella、水栖菌属 (Enhydrobacter)、Muricauda、Phaeodactylibacter、NS3a_marine_group、Salinihabitans、嗜甲基菌属和泥滩微菌属 (Gilvibacter)。与N6期比Z1期育苗水体中增加了东吉科拉属、红菌属 (Rhodobium)、嗜冷杆菌属 (Psychrobacter)、动性杆菌属 (Planomicrobium)、念株菌属 (Candidatus-Aquiluna) 和埃希氏杆菌属 (Escherichia-Shigella) 几种优势菌属。随着幼体发育,M1和P1期不同处理组优势菌属种类基本一致,但不同菌的丰度存在差异。M1期育苗水体中主要优势菌属为东吉科拉属、黏着杆菌属(Cohaesibacter)、Phaeodactylibacter、海命菌属、Maritalea、鲁杰氏菌属 (Ruegeria)、Winogradskyella和念株菌属,而P1期育苗水体中主要优势菌属为弧菌属 (Vibrio)、念株菌属、NS3a_marine_group、海命菌属、食烷菌属、假交替单胞菌属、OM43_clade、Marinomonas、Aureimarina、嗜冷杆菌属、黏着杆菌属和Phaeodactylibacter。

图4 不同实验组育苗水体属水平菌群组成相对丰度Figure 4 Relative abundance of microbial community of hatchery water in different groups at genus level
随着幼体生长发育,不同时期的优势菌属变化较大,主要为弧菌属、不动杆菌属 (Acinetobacter) 、动性杆菌属、微杆菌属 (Exiguobacterium) 、嗜冷杆菌属、嗜甲基菌属和鲁杰氏菌属 (图5)。其中,N6期幼体不同组间优势菌属差异较大,埃希氏杆菌属和盐单胞菌属是二氧化氯组主要优势菌属,Blastomonas、Gemmatirosa和埃希氏杆菌属是漂白粉组主要优势菌属,嗜甲基菌属、埃希氏杆菌属、嗜冷杆菌属和鲁杰氏菌属是甲醛组主要优势菌属。Z1期幼体主要优势菌属为动性杆菌属、微杆菌属、嗜冷杆菌属;M1期各组幼体最占优势属是弧菌属、不动杆菌属、微杆菌属;P1期幼体内较为优势属为鲁杰氏菌属、埃希氏杆菌属、黏着杆菌属和弧菌属。
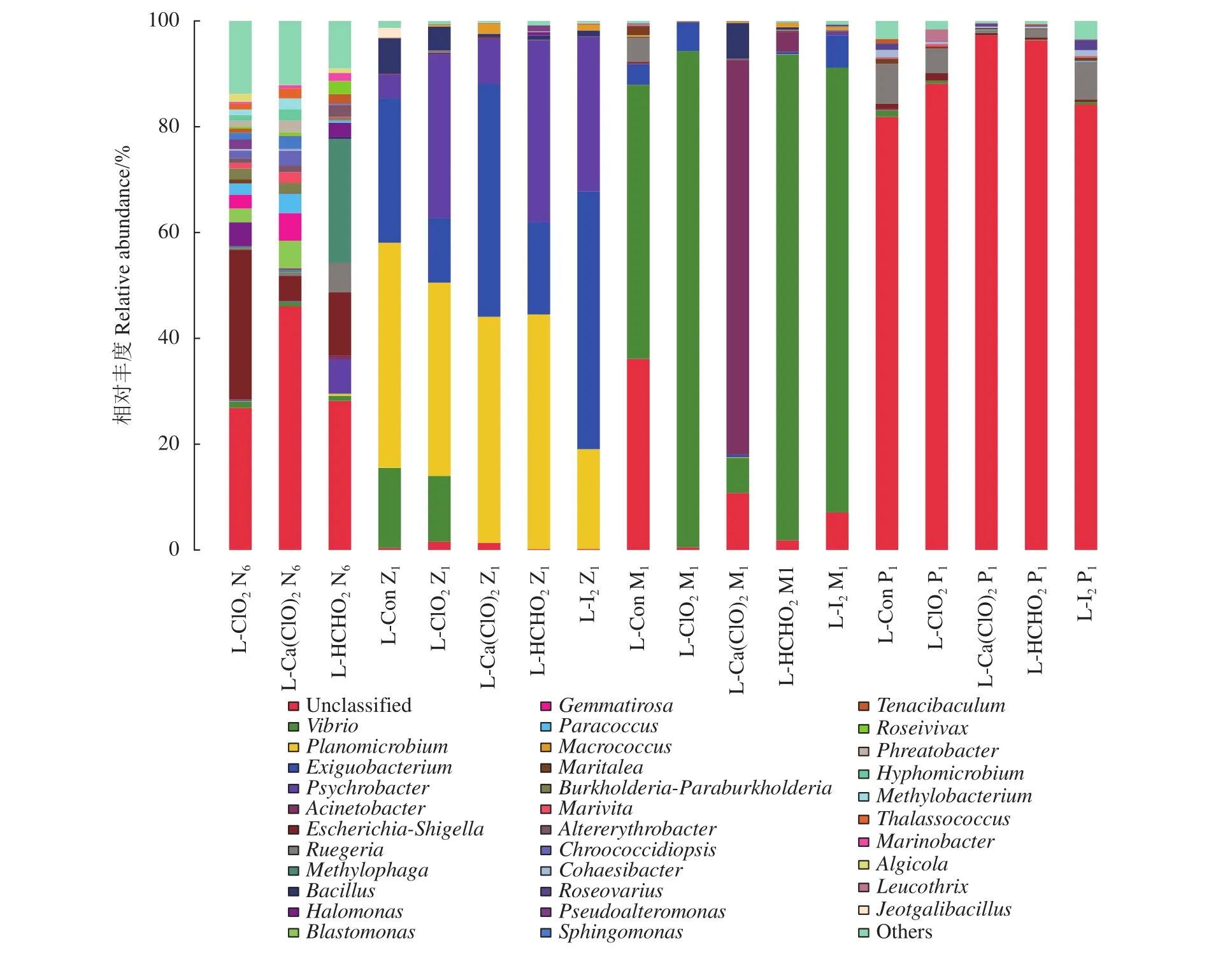
图5 不同实验组幼体属水平菌群组成相对丰度Figure 5 Relative abundance of microbial community of larvae in different groups at genus level
2.4 幼体成活率
在幼体各发育阶段,甲醛组均有较高的成活率,其中Z1—Z3期成活率接近90%,P5期最终成活率为44.44%,显著高于其他组 (P<0.05);其次是漂白粉组,成活率高于对照、碘和二氧化氯组,但无显著差异 (P>0.05,图6)。

图6 不同实验组幼体不同时期的成活率Figure 6 Survival rates of L. vannamei larvae at different developmental stages
3 讨论
3.1 消毒剂对育苗水体细菌、水质及幼体成活率的影响
消毒剂在水产养殖中发挥着重要作用,能净化和稳定水质,维护水产养殖动物良好的生长环境,杀灭或消除环境病原微生物,防止疾病的发生[12]。本研究中,不同消毒剂杀菌效果不同,对育苗早期水体的总菌和弧菌数量影响较大。24和72 h灭菌效率由高到低分别为甲醛、二氧化氯、碘、漂白粉,其中甲醛和二氧化氯灭菌具有长效性和稳定性,而碘和漂白粉72 h总菌数量与对照组相近。二氧化氯有效氯含量是氯的2.63 倍,杀灭异养菌所需的浓度仅为液氯的一半[13]。溞状幼体阶段,甲醛和二氧化氯组水体的总菌和弧菌数量低于对照组、漂白粉和碘组,表明甲醛和二氧化氯杀菌效果较好。随着幼体发育,育苗水体总菌和弧菌数量上升,各组中碘组的总菌数最低而弧菌数量最高,甲醛组的弧菌数最低。
消毒剂除了杀菌和控制有害藻类作用外,还能增氧并分解水体中的有害物质,降低亚硝酸盐等有害物浓度,有效改善水质[12-13]。本研究中,使用不同消毒剂前后氨氮和亚硝酸盐质量浓度无显著差异;除仔虾阶段碘和二氧化氯组水体氨氮浓度高于对照组外,其余2种消毒剂组育苗水体氨氮和亚硝酸浓度均低于对照组,漂白粉组最低,本实验也证实使用4种消毒剂可改善育苗水体水质。
幼体不同发育阶段,甲醛组幼体成活率最高,其次是漂白粉组。这与甲醛组水体弧菌数量少及较低的亚硝酸盐浓度有关,且与漂白粉组水体氨氮和亚硝酸浓度低相关。崔子予等[14]认为保持凡纳滨对虾育苗水体的弧菌数量稳定,对增加水体稳定性,提高对虾育苗成活率具有意义。
3.2 消毒剂对育苗水体和幼体微生物菌落结构的影响
本研究中,在育苗水体和幼体中鉴定出微生物属种237种,不同处理组的主要优势菌属与杨硕[15]报道凡纳滨对虾肠道中的优势菌属结果相似。4种消毒剂对早期 (N6—Z1) 阶段育苗水体中的优势菌属种类和丰度影响均较大,使用不同消毒剂0、48、96 h后各组优势细菌属种类和优势度 (百分比)不同。0和48 h后,对照组、碘和二氧化氯组优势菌为东吉科拉属和红杆菌属,而甲醛和漂白粉组优势菌为假交替单胞菌属、交替单胞菌属和嗜甲基菌属。随着消毒时间延长,96 h后不同实验组水体优势细菌属种类趋近,优势种类的数量增加但丰度降低。M1和P1期各组水体的优势菌属种类相似,以东吉科拉属、OM43_clade、弧菌属、黏着杆菌属、Phaeodactylibacter、念珠菌属 (Candidatus-Cquiluna) 和埃希氏杆菌属等为主,只是各组不同菌属的丰度存在差异。
OM43_clade属β-变形菌纲嗜甲基菌科,在全球海洋环境和其他水生环境中C1化合物的代谢中发挥着重要作用[16]。赤杆菌属属α-变形菌纲、赤杆菌科,在土壤、热泉、海水中广泛分布,部分菌株具有细菌叶绿素a,营好氧异养生长兼具光合作用功能,在全球海洋碳循环和能量代谢过程中起重要作用[17]。交替赤杆菌属 (Altererythrobacter) 主要来源于海洋环境,具有生物降解、产类胡萝卜素、产细胞毒素和产酶等功能[17]。泥滩微菌属属于拟杆菌门黄杆菌纲,具有硝酸盐还原功能。Phaeodactylibacter、芽孢杆菌属 (Bacillus) 和盐单胞菌属是三疣梭子蟹 (Portunus trituberculatus) 养殖水体优势属,在有机质降解和氮磷循环方面发挥着重要作用[18]。东吉科拉属和Roseibacterium通常在水生环境中占主导地位,并促进氮化合物的降解[19-20]。黄杆菌属是一种黏附能力较强的细菌,可能影响幼体的活力和蜕皮而导致其成活率下降,其丰度受水体中有机物含量影响。研究发现,对虾育苗成活率低的育苗池水体的优势菌为假单胞菌和弧菌[21]。本研究中对照组和二氧化氯组水体中的黄杆菌属、弧菌属和假交替单胞菌属为主要优势菌属,丰度高于其他组,这可能与其幼体较低的成活率有关。
凡纳滨对虾幼体中的优势菌属以盐单胞菌属、弧菌属、不动杆菌属、动性杆菌属、芽孢杆菌属、微杆菌属、嗜冷杆菌属、嗜甲基菌属和鲁杰氏菌属为主,本研究结果表明育苗水体和幼体微生物群落存在显著差异。弧菌是Z1期对照组和二氧化氯组的第三优势菌,除漂白粉组外,弧菌属是M1期各组幼体内最占优势的菌属。虾的肠道和周围环境的弧菌、假单胞菌和黄杆菌等可能是降低幼体成活率的细菌性病原体。既往研究报道,弧菌过量可改变虾类健康状况,引起疾病[22]。研究表明,导致凡纳滨对虾“早期死亡综合征”(Early mortality syndrome, EMS) 的病原可能是携带有毒性质粒的副溶血弧菌 (V. parahaemolyticus) 的特异变种[23-24]。弧菌是海洋环境和对虾肠道的优势菌群,除部分种类为致病菌外,另一些种类则具有硝酸盐异化作用,对水体中有机物的降解具有重要意义[25]。不动杆菌属和嗜冷杆菌属均属变形菌门γ-变形菌纲,主要分布于水体和环境中,前者也分布于人的皮肤、咽部、胃、肠道,是人类条件致病菌,而后者具有强耐酸性,主要分布于动物和人类胃肠道内,可引起肠道炎症。已有研究证实变形菌属是虾类肠道菌群的主导[26-27]。郁维娜等[28]研究发现养殖凡纳滨对虾患病虾肠道中的γ-变形菌纲的相对丰度显著高于健康虾肠道样品,而α-变形菌纲的相对丰度显著低于健康虾肠道样品。杨坤杰等[29]发现在健康幼虾肠道中α-变形菌纲丰度较高,而在患病幼虾中γ-变形菌纲和拟杆菌门丰度较高。微杆菌属属于厚壁菌门芽孢杆菌纲,分布广泛,生存环境多样,具有分解复杂有机物、转化重金属、促生长等极具实用价值的功能[30]。芽孢杆菌属具有强抑制有害菌能力,并能产生拮抗物质如抗生素和细菌素,抑制致病菌的生长;同时产生多种消化酶帮助宿主消化吸收营养物质,从而起到防治疾病的效果,已经成为改善凡纳滨对虾健康状况的益生菌[31]。而Z1期甲醛组幼体的动性杆菌属和芽孢杆菌属丰度高于其他4组,这可能与甲醛组幼体有较高的成活率有关。
