CCRL2、miR-211-5p在食管鳞癌组织中表达及临床意义
2021-04-28尚庆毅梁伟连云港市赣榆区人民医院检验科江苏连云港00连云港市第二人民医院医学检验科江苏连云港03
尚庆毅,梁伟(.连云港市赣榆区人民医院检验科,江苏连云港 00;. 连云港市第二人民医院医学检验科,江苏连云港 03)
趋化因子诱饵受体2[Chemokine (C-C motif) receptor-like 2,CCRL2]是一种跨膜G蛋白偶联受体,广泛分布于人体组织和器官中,在肿瘤的相关炎症浸润与免疫应答中发挥了重要作用[1]。微小RNA(microRNA,miRNA)与肿瘤发生发展、耐药性和预后有关,在肿瘤细胞的增殖、侵袭及转移等过程中发挥重要的调控作用[2-3]。微小RNA-211-5p(miR-211-5p)在膀胱癌、三阴乳腺癌等多种肿瘤组织中表达下调,发挥类似抑癌基因的作用[4-5]。然而,目前国内尚未见CCRL2、miR-211-5p在食管鳞癌中的研究报道。本研究通过检测CCRL2与miR-211-5p在食管鳞癌组织中的表达情况,探讨CCRL2和miR-211-5p在食管鳞癌中的表达水平及临床意义,报道如下。
1 材料和方法
1.1研究对象 选择2015年6月至2017年10月在连云港市赣榆区人民医院行手术治疗的83例食管鳞癌患者作为研究对象。男55例,女28例,年龄(59.7±12.5)岁。纳入标准:(1)患者经术后病理组织学检查确诊为食管鳞癌;(2)具备完整的病历资料;(3)术前均未行放、化疗等抗肿瘤治疗。排除标准:(1)合并其他系统的恶性肿瘤者;(2)合并严重心、肝、肺、肾功能不全;(3)临床资料不全者。TNM分期:Ⅰ~Ⅱ期40例,Ⅲ~Ⅳ期43例;浸润程度:黏膜下层/黏膜层者28例,肌层者32例,浆膜层者23例;肿瘤直径<5 cm者39例,≥5 cm者44例;分化程度:低分化35例,中、高分化48例;有淋巴结转移者36例,无淋巴结转移者47例。以患者术后出院为起点,对所有患者进行电话或门诊随访,随访日期截至2020年10月,所有患者均完成随访。本研究经过连云港市赣榆区人民医院医学伦理学委员会批准(批准文号:No.2015051),患者或其监护人均知情同意。
1.2主要试剂与仪器 TRIzol试剂购自美国Invitrogen公司,逆转录试剂盒和qPCR试剂盒购自美国Thermo Fisher公司,免疫组化试剂盒、DAB显示试剂购自北京中杉金桥生物技术公司,兔抗人CCRL2多克隆抗体、辣根过氧化物酶标记的羊抗兔IgG二抗购自美国Abcam公司。CCRL2、miR-211-5p及内参基因β-actin、U6引物由广州锐博生物技术公司设计与合成。Evolution 200分光光度计(美国Thermofisher Scientific公司)。
1.3方法
1.3.1标本采集与保存 收集83例患者手术过程中的食管鳞癌组织及癌旁组织(距离癌组织>5 cm,且经病理组织学证实无食管鳞癌细胞)标本,部分样本石蜡包埋,另一部分标本经生理盐水冲洗后,立即置于-80 ℃保存。
1.3.2RNA提取及逆转录反应 取上述组织标本50 mg,经研磨后使用TRIzol试剂提取总RNA,采用分光光度计检测RNA的浓度和纯度,取吸光度(A260/280 nm)为1.8~2.0的样本,按照逆转录试剂盒说明书逆转录为cDNA,样本置于-20 ℃保存。
1.3.3实时荧光定量PCR(quantitative real-time PCR,qRT-PCR) 采用qRT-PCR检测食管鳞癌组织中CCRL2、miR-211-5p的表达。根据NCBI参考序列CCRL2、miR-211-5p的序列号(NM_001130910、NC_000015.10),由广州锐博生物技术公司使用Primer Premier 5.0软件设计与合成。CCRL2上游引物序列:5′-AGGATCCCCACCATGGTCTACACCCGTTTCTTAAAAGG-3′,下游引物序列:5′-AGGATCCCCACCATGGCCAATTACACGCTG-3′,产物片段大小156 bp,退火温度 61 ℃;miR-211-5p上游引物序列:5′-GCGCTTGTCATCCTTCGCCT-3′,下游引物序列:5′-TGGTGTCGTGGAGTCG-3′,产物片段大小232 bp,退火温度63 ℃;β-actin上游引物序列:5′-CATGTACGTTGCTATCCAGGC-3′,下游引物序列:5′-CTCCTTAATGTCACGCACGAT-3′,产物片段大小60 bp,退火温度60 ℃;U6上游引物序列:5′-CTCGCTTCGGCAGCACA-3′,下游引物序列:5′-AACGCTTCACGAATTTGCGT-3′,产物片段大小255 bp,退火温度61 ℃。PCR反应体系为15 μL,包括:primeSTAY 2 μL,2.5×dNTP Mix 5 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O25 μL,cDNA样本1 μL。循环参数:95 ℃预变性60 s;95 ℃ 30 s,60 ℃ 75 s,72 ℃ 15 s,38个循环。使用StepOneTM软件于62 ℃时采集荧光信号并进行熔解曲线分析。CCRL2以β-actin为内参照,miR-211-5p以U6为内参照,采用2-△△Ct法进行计算相对表达量,ΔΔCt=(实验组Ct目的基因-实验组Ct内参基因)-(对照组Ct目的基因-对照组Ct内参基因)。每个样品设置3个复孔,取平均值。
1.3.4免疫组织化学染色 将石蜡标本切成4 μm切片后,经过脱蜡、抗原修复和去除内源性过氧化物酶活性后,用10%山羊血清封闭,加入CCRL2兔抗人多克隆抗体(工作浓度1∶200稀释)4 ℃过夜,PBS洗涤后,加入辣根过氧化物酶标记的羊抗兔IgG二抗(工作浓度1∶500稀释),室温温育1 h,PBS洗涤,DAB染色,蒸馏水漂洗,苏木精复染细胞核,梯度乙醇浸泡5 min,二甲苯透明化后封片,显微镜观察。染色结果判断:根据阳性细胞数:0%~5%,记为0分;6%~25%,记为1分;26%~50%记为2分;51%~75%,记为3分;>75%,记为4分;根据细胞染色强度评分:无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将两项积分的乘积作为评判标准:得分0~1分为阴性(-),2分以上为阳性,2~4分记为+,4~6分记为++,6分以上记为+++。
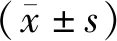
2 结果
2.1组织中CCRL2mRNA及miR-211-5p表达水平的比较 与癌旁组织相比,食管鳞癌组织中CCRL2mRNA(1.05±0.21 vs 2.68±0.52)的表达水平显著升高(t=26.480,P<0.001),而miR-211-5p(1.01±0.18 vs 0.61±0.15)的表达水平显著降低(t=15.553,P<0.001)。
2.2组织中CCRL2蛋白表达水平的比较 免疫组织化学染色结果显示,CCRL2蛋白主要定位于细胞质和细胞膜。与癌旁组织CCRL2蛋白阳性表达率(24.10%)比较,食管鳞癌组织中CCRL2蛋白阳性表达率(62.65%)显著升高,差异有统计学意义(χ2=25.116,P<0.05)。见图1。

注;A,CCRL2在癌旁组织中阴性表达;B,CCRL2在癌组织中阳性表达。
2.3食管鳞癌组织中CCRL2mRNA和miR-211-5p的相关性 Pearson相关分析结果表明,食管鳞癌组织中CCRL2和miR-211-5p呈负相关(r=-0.713,P<0.01)。
2.4CCRL2和miR-211-5p的表达与食管鳞癌患者临床病理参数的关系 根据食管鳞癌组织中CCRL2蛋白免疫组织化学染色结果,将食管鳞癌患者分为CCRL2阳性表达组(染色结果为+、++和+++)和CCRL2阴性表达组(染色结果为-)。以食管鳞癌组织中miR-211-5p表达水平的均值(0.61)为界,将食管鳞癌患者分为miR-211-5p高表达组(≥0.61,n=41)和miR-211-5p低表达组(<0.61,n=42),结果表明,CCRL2、miR-211-5p的表达水平与患者性别、年龄、肿瘤直径、浸润程度无关(P>0.05),而与肿瘤分化程度、TNM分期和淋巴转移有关(P<0.05)。见表1。

表1 CCRL2和miR-211-5p表达水平与食管鳞癌患者临床病理参数的关系[n(%)]
2.5CCRL2、miR-211-5p表达与食管鳞癌患者生存率的关系 通过Kaplan-Meier生存分析可知,CCRL2阳性表达组食管鳞癌患者3年累积生存率显著低于CCRL2阴性表达组患者(30.84% vs 54.98%,χ2=6.407,P=0.011)。miR-211-5p高表达组食管鳞癌患者3年累积生存率显著高于miR-211-5p低表达组患者(58.72% vs 24.31%,χ2=10.99,P<0.001)。见图2。

注:A,CCRL2表达与食管鳞癌患者生存率的关系;B,miR-211-5p表达与食管鳞癌患者生存率的关系。
3 讨论
CCRL2作为一种趋化因子受体,在单核细胞、中性粒细胞、巨噬细胞、T细胞内均有表达,通过调控机体稳态平衡、血管生成、免疫监视及炎症反应等在肿瘤发生、发展、转移的不同阶段发挥重要作用[6]。本研究结果显示,在食管鳞癌组织中CCRL2的表达水平显著高于癌旁组织,且CCRL2表达与食管鳞癌分化程度、TNM分期和淋巴转移有关,提示CCRL2高表达与食管鳞癌的发生有关。研究表明,CCRL2在多种肿瘤组织或细胞中异常表达,如在前列腺癌细胞中表达水平升高,可影响肿瘤细胞增殖、侵袭和迁移[7]。另有研究结果表明,CCRL2在肝癌、乳腺癌、神经胶质瘤等肿瘤的恶性进展过程中发挥作用,如参与调节细胞生长、迁移,血管发生和调节免疫反应等[8]。提示CCRL2在食管鳞癌组织中的表达水平升高,可能在食管鳞癌进展过程中调控肿瘤细胞增殖、侵袭,促进肿瘤的发展与淋巴转移,但其在食管鳞癌中作用还需要进一步的实验支持。
miR-211-5p在肿瘤细胞增殖、分化、迁移及肿瘤耐药等过程中发挥重要作用,其表达异常与多种肿瘤的发生、发展有关,且主要发挥抑癌作用[3,9]。本研究检测了miR-211-5p在食管鳞癌组织中表达水平,结果发现与癌旁组织比较,食管鳞癌组织中miR-211-5p表达水平显著降低,提示miR-211-5p与食管鳞癌的发生、发展有关。Qin等[10]研究表明,与正常组织相比,在肝细胞癌(HCC)组织和细胞系中miR-211-5p相对表达量显著下调;进一步行Kaplan-Meier分析表明,miR-211-5p低表达HCC患者的总生存期较差,而体外上调miR-211-5p的表达,可抑制细胞增殖、迁移与侵袭。另有研究证实[11],miR-211-5p在肾细胞癌(RCC)组织与细胞中表达下调,miR-211-5p的表达下调促进了RCC细胞的增殖、迁移和侵袭。Wang等[12]研究证实,miR-211-5p在甲状腺癌中表达下调,过表达miR-211-5p可通过调控性别决定区Y框蛋白11的表达水平,影响甲状腺癌细胞的增殖与侵袭。进一步分析结果显示,miR-211-5p表达与患者性别、年龄、肿瘤直径、浸润程度无关,而与肿瘤分化程度、TNM分期和淋巴转移有关,提示miR-211-5p与食管鳞癌的发展相关。故而笔者推测,miR-211-5p可能通过某种机制调控食管鳞癌细胞增殖、迁移与侵袭。但其具体作用机制仍需进行实验验证。
本研究进一步行Pearson相关性分析,结果显示,在食管鳞癌组织中,CCRL2低表达、miR-211-5p高表达,且二者呈负相关,表明二者可能存在负向调控关系。提示CCRL2可能通过靶向miR-211-5p调控食管鳞癌的发生、发展。Kaplan-Meier生存分析显示,CCRL2阳性表达组食管鳞癌患者的3年累积生存率显著低于CCRL2阴性表达组患者,miR-211-5p高表达组食管鳞癌患者的3年累积生存率显著高于miR-211-5p低表达组患者,提示CCRL2、miR-211-5p可能通过调控肿瘤发展影响患者预后情况。
综上所述,CCRL2在食管鳞癌组织中高表达,而miR-211-5p低表达,且二者与食管鳞癌分化程度、淋巴转移及生存情况有关,可能作为食管鳞癌患者预后评估的分子标志物。然而二者具体作用机制尚不完全清楚,仍需进行进一步研究。
