产后子宫腺肌瘤变性坏死继发脓毒血症介入治疗1例报道及文献复习
2021-04-27徐娇王晓银桑琰庄琳徐洲陈瑾李钱容
徐娇,王晓银,桑琰,庄琳,徐洲,陈瑾,李钱容
1 病例资料
患者陈某某,28岁,藏族,因“停经37+1周,阴道流液1+h”于2019年08月03日就诊于成都中医药大学附属医院产科。患者平素月经规律,5/28 d,停经45 d因“先兆流产”于我院妇科住院保胎治疗。停经12+4周行颈项透明层(nuchal translucency,NT)检查:NT 0.12 cm,子宫左后壁肌壁间查见(8.7×5.1×7.5)cm3不均质回声,宫颈管长约3.6 cm(见图1)。因患者既往两次于停经15+周发生不明原因流产,故要求行宫颈环扎术,住院期间予预防感染、纠正贫血及中药口服等中西医结合治疗,阴道出血7 d后停止,好转出院。门诊定期随访。停经16+周行唐氏筛查未见明显异常。孕5+月感胎动,孕期行甲功、心电图、心脏超声、肝胆胰脾双肾输尿管膀胱超声、胎儿系统超声未见明显异常。停经28周行超声检查提示胎膜下积血消失。停经36+6周拆除宫颈环扎线,停经37+1周,孕妇无明显诱因出现阴道流液1+h,急诊以“胎膜早破”收入我科。
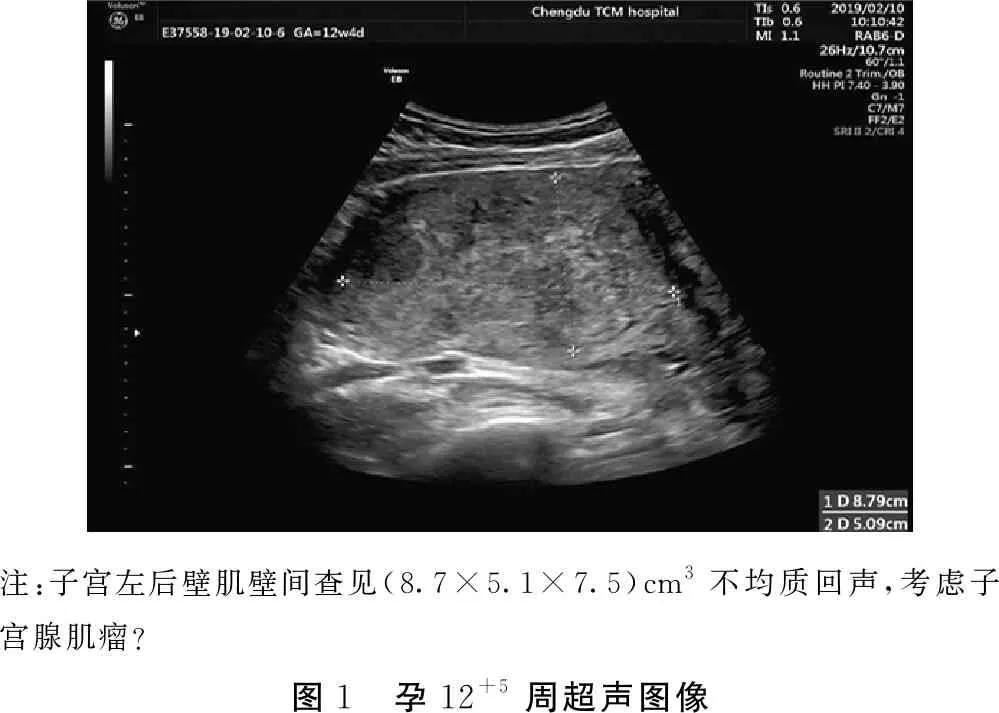
注:子宫左后壁肌壁间查见(8.7×5.1×7.5)cm3不均质回声,考虑子宫腺肌瘤?图1 孕12+5周超声图像
既往史:患者3+年前外院体检发现“乙肝小三阳”,孕期查乙肝DNA定量<103IU/mL。既往2次自然流产,两次妊娠均于停经15+周无明显诱因出现腹痛后难免流产,两次流产后均出现反复不明原因高热,体温最高达39℃,辗转于多地多家医院诊治,均无明显疗效,发热10+d后体温自行下降恢复正常。2年前彩超检查发现子宫腺肌瘤大小约4+cm;1+年前在四川大学华西第二医院行超声提示:子宫左后壁壁间查见大小(4.0×4.3×4.7)cm3的稍强回声,边界欠清,周边探及血流信号,诊断为“子宫腺肌瘤”,未予治疗。否认过敏史及家族遗传病史。
查体:身高168 cm,体重56 kg,体质量指数(body mass index,BMI)19.84 kg/m2。内科查体无特殊。产科检查:骨盆测量径线未见明显异常,阴道后穹窿可见羊水池,羊水清亮,未扪及明显宫缩,胎儿估计2 800 g,余无特殊。
实验室及其他辅助检查:产科B超:双顶径8.7 cm,头围30.9 cm,腹围30.3 cm,股骨长6.8 cm,羊水最大深度6.1 cm,羊水指数12 cm,脐动脉S/D 2.85,胎心率145次/min,胎盘着床于子宫前壁,厚度4.1 cm,成熟度I级。患者子宫左侧壁上份肌壁间突向浆膜下查见(10.7×6.4)cm2不均质回声,部分似有边界,周边及其内探及星点状血流信号。血常规:白细胞(white blood cell,WBC)13.33×109/L,血红蛋白(hemoglobin,HGB)112 g/L,血小板(platelet,PLT)284×109/L,小便常规及凝血功能、肝肾功电解质均未见异常。
入院诊断:1.胎膜早破;2.G3P0A237+1周宫内孕头位单活胎待产;3.子宫腺肌瘤合并妊娠;4.宫颈环扎缝线拆除术后;5.乙肝病毒携带者。
诊疗经过:入院后完善相关辅助检查,因无临产征兆,予缩宫素点滴引产4+h,宫口开大3 cm,因“胎儿窘迫?”行剖宫产术。顺利分娩一活男婴。术中未见明显腹水,胎盘、胎膜剥离完整,胎膜腐朽,宫腔及胎盘可闻及异味,子宫下段两侧有滤泡样增生,宫底左后壁可见一约(12×10)cm2大小包块,质中,暗红色,边界清,术后胎盘及胎膜组织送病检。
剖宫产术后立即予哌拉西林钠他唑巴坦钠+甲硝唑抗炎治疗。术后19+h患者开始发热,最高38.3℃,继续原治疗,暂停母乳喂养。第2 d患者体温最高39℃,无咳嗽咳痰、咽痛尿频尿急等不适。查体:心肺未查及异常,双乳软,腹部切口无渗血及渗液等不适,左侧腹部可明显扪及一大小约10 cm包块,压痛明显,阴道未见明显恶露排出。血常规提示:WBC 24.77×109/L,中性粒细胞百分比(neutrophilic granulocyte percentage,NEUT%):93%,红细胞(red blood cells,RBC):3.05×1012/L,HGB 95 g/L,PLT 250×109/L,C反应蛋白(C-reactive protein,CRP):180.9 mg/L,降钙素原(procalcitonin,PCT):4.23 ng/mL,行血培养。术后3~5 d患者体温持续上升,最高达42℃,患者出现寒战,轻微头痛,无咽痛,无咳嗽咳痰尿频尿急尿痛等不适,阴道可见少许淡红色分泌物,无异味。查体:双侧扁桃体正常,咽部无充血,双肺(-),乳房(-),腹部切口(-),子宫左上方压痛明显。剖宫产术后3 d超声检查:子宫前后径10.1 cm,子宫腔受推挤,显示不清,后壁肌壁间查见(11.6×9.9×11)cm3不均质稍强回声,内见不规则片状暗区,团块内探及血流信号, 盆腔及下腹腔查见液性暗区,最深约2.2 cm(见图2)。术后3 d胎盘病检回报:提示急性绒毛膜羊膜炎。血培养回示:查见革兰氏阴性杆菌,感染科会诊后予以美罗培南抗感染治疗。术后4 d复查血常规:WBC:21.62×109/L,NEUT%:96%,RBC:2.74×1012/L,HGB:96 g/L,PLT:149×109/L,CRP:205.3 mg/L,PCT:26.5 ng/mL。感染科再次会诊后考虑脓毒血症,继续予以美罗培南抗感染,对症退热治疗。考虑患者反复高热可能因子宫腺肌瘤变性坏死所致,建议行子宫切除术,但患者及家属有再生育要求,强烈要求保留子宫,充分与患者及家属沟通后继续予以抗感染治疗,术后6~11 d患者体温波动于36.1℃~39.2℃,术后11 d复查彩超:子宫前后径10.4 cm,宫腔受推挤,显示不清,后壁肌壁间查见(11.7×8.3×9.6)cm3的不均质回声,内见不规则液性暗区及较多短线状强回声,团块内探及血流信号,盆腔查见液性暗区,最深约2.6 cm(见图3)。术后12 d行腹部CT:子宫腔受推挤,显示不清,后壁肌壁间见较多液性密度影及多发散在斑点状(见下页图4)。术后12 d普外科及介入科会诊后行超声+数字减影血管造影(digital subtraction angiography,DSA)引导下行经腹部子宫腺肌瘤腔穿刺引流术,腹部留置引流管2根,分别植入腺肌瘤中部及瘤底部(见下页图5)。将引流出组织液送病理活检后,经引流管注入双氧水、甲硝唑氯化钠注射液后可见清亮液体自宫颈口流出,未见脓性分泌物及出血。引流后第2 d,引流袋中开始见少许淡黄色液体及坏死组织(见下页图6),阴道亦可见淡黄色及坏死组织物流出,无阴道流血及恶露流出。引流组织液病检结果回示:查见大量浆液、中性白细胞、脓细胞。引流术后每日予以左氧氟沙星注射液经引流管冲洗瘤腔治疗。
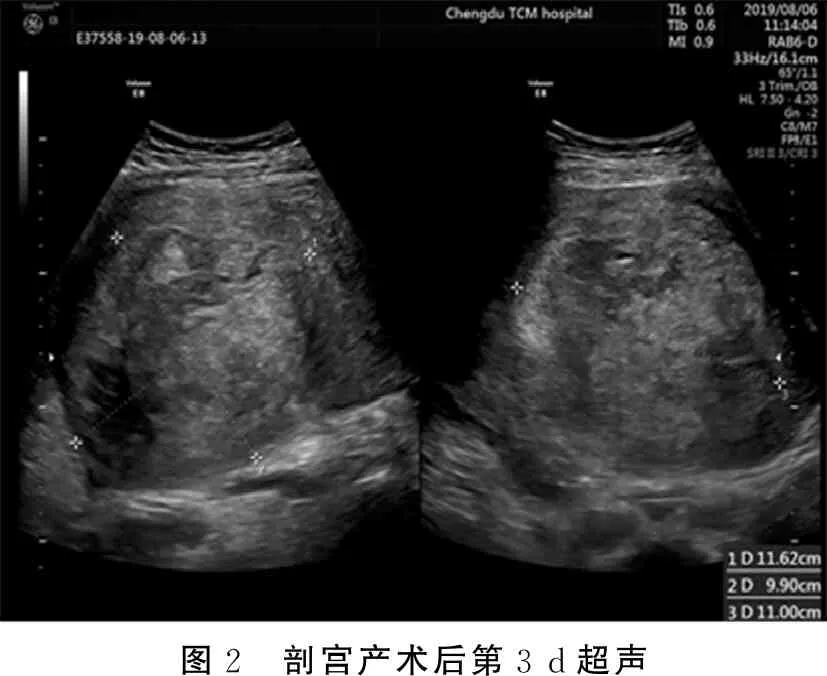
图2 剖宫产术后第3 d超声

图3 剖宫产术后第11 d超声
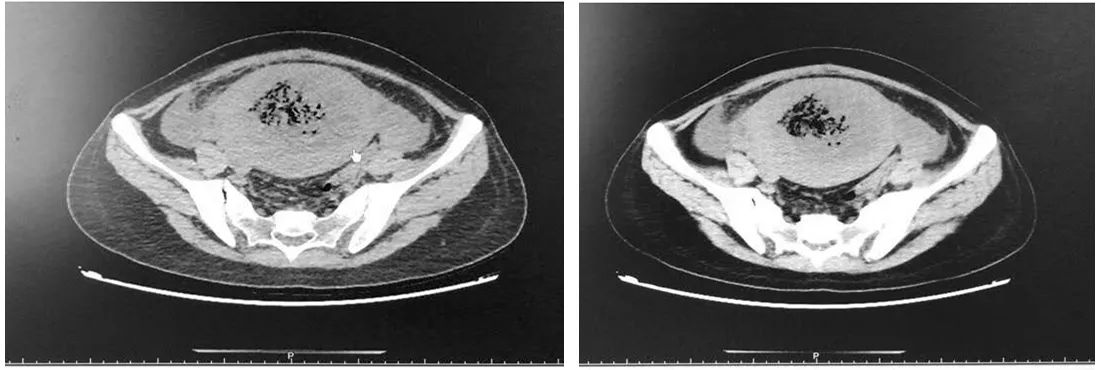
图4 剖宫产术后第12 d腹部CT

图5 剖宫产术后第12 d超声+DSA引导下行经腹部子宫腺肌瘤腔穿刺引流

图6 超声+DSA引导下行经腹部子宫腺肌瘤腔穿刺引流液
经腹腔局部穿刺引流术后第2 d(剖宫产术后14 d),患者体温迅速恢复正常,波动于36.5℃~37.1℃,腹部无压痛,阴道可见坏死组织流出,无异味。引流管中每日引流出灰白色液体约10 mL。腹腔引流8 d后(剖宫产术后20 d)病情好转,患者体温恢复正常6 d,每日引流袋中可见约5~10 mL灰白色液体,患者无腹痛,腹部无压痛,带腹腔穿刺引流管出院,定期返院予以左氧氟沙星冲洗瘤腔。出院后7 d即腹腔引流术后16 d(剖宫产术后28 d),返院进行瘤腔冲洗,冲洗后患者便意明显,排便后突发全腹部绞痛,查体:全腹呈板状,压痛反跳痛。考虑由于腹压增加,瘤腔液性内容物流入腹腔而导致腹膜刺激征,再次收入院。入院后予以抗感染等对症支持处理。腹腔引流23 d(剖宫产术后35 d),患者无腹痛等不适,腹部压痛症状消失,瘤体部引流管中无引流液,停用抗生素治疗并拔出瘤体部引流管。瘤底部引流管内每日可见白色引流物约10 mL,色较前清亮。宫底位于脐耻之间。局部穿刺引流23 d(剖宫产术后35 d)复查血常规:WBC:5.31×109/L,NEUT%:57.2%,HGB:103 g/L,CRP 1.6 mg/L,彩超提示:子宫后壁肌壁间查见(3.7×3.6×1.7)cm3不均质回声,内见少许不规则液性暗区,团块内探及少许点状血流信号。腹腔引流术后28 d(剖宫产术后40 d),患者无腹痛,发热等不适,瘤底部引流管无引流液,阴道可见白色恶露流出,无异味,予以拔出瘤底部引流管。剖宫产术后43 d复查彩超:子宫前位,前后径5.4 cm,内膜前移,厚约0.4 cm(双层),后壁肌壁间查见(3.1×2.7×3.3)cm3不均质稍强回声,子宫直肠陷凹未见明显无回声区(见下页图7)。剖宫产术后3个月于当地医院复查彩超:子宫前后径约4.4 cm,宫腔未见明显异常,婴儿出生后3月,一般情况可,生长发育正常。
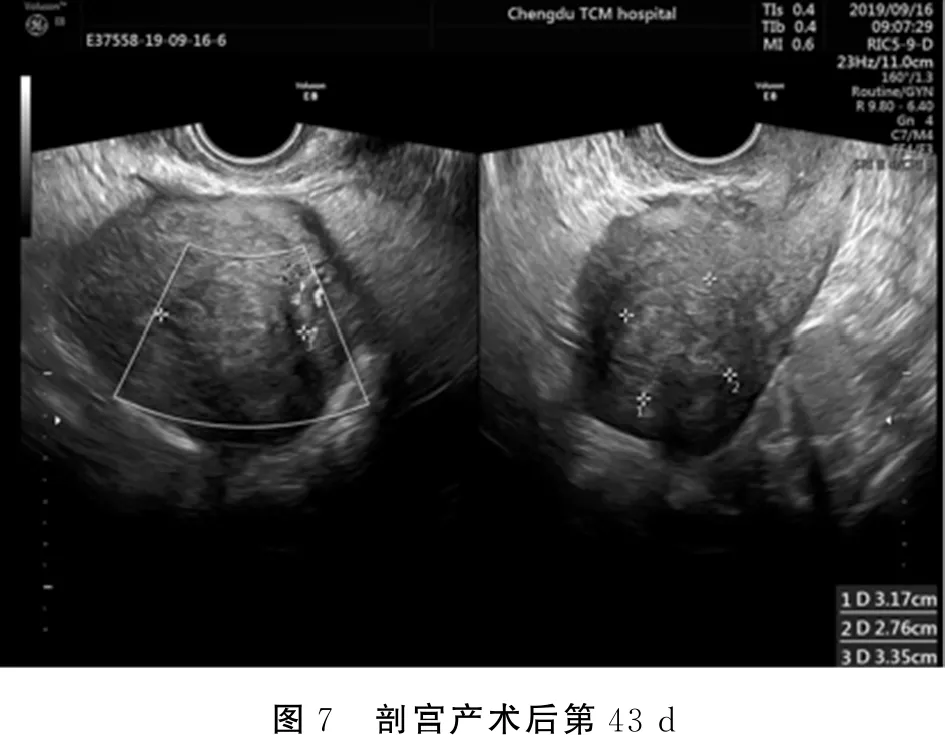
图7 剖宫产术后第43 d
2 讨论
子宫腺肌病是指子宫内膜腺体及间质侵入子宫肌层生长而产生的病变,同时伴随周围肌层细胞的代偿性肥大和增生。人群中子宫腺肌病发病率尚不明确,通过子宫切除后病理统计子宫腺肌病的发病率达20%~30%[1]。它与盆腔子宫内膜异位症有关,发病年龄常为30~40岁。痛经、月经大量出血和不孕是子宫腺肌病的主要表现,子宫腺肌病的病理特点及妊娠期的生理变化增加不良妊娠结局的发生率。在妊娠的病例中,与自然流产、早产、胎膜早破、胎儿生长受限(fetal growth restriction,FGR)、产后出血、前置胎盘、早产及围产期不良结局等风险增加有关[2-3]。磁共振成像和经阴道超声都被认为是有效的诊断工具[3-5]。临床上研究子宫腺肌瘤合并妊娠的资料较少见。因此,子宫腺肌瘤合并妊娠对医生来说是个挑战,需要临床医生为患者提供特定的临床建议和治疗方案。
2.1 子宫腺肌瘤变性坏死的原因分析
① 妊娠期子宫腺肌瘤体内雌激素受体在妊娠期受到抑制,产后雌激素水平骤然降低可诱发子宫腺肌瘤变性坏死[6]。② 产褥期患者血液处于高凝状态,导致子宫腺肌瘤组织供养血管内静脉血栓形成,使腺肌瘤血供减少及中断,发生变性坏死[7]。③ 细菌经子宫切口处侵入子宫肌层诱发腺肌瘤感染[7]。④ 子宫腺肌瘤压迫周围肠管,影响血供,使肠壁通透性增加,形成肠道菌群透壁性感染等因素导致子宫腺肌瘤变性坏死[8]。⑤ 分娩后子宫复旧使子宫迅速恢复到孕前的大小,在这个重塑过程中,纤维瘤组织很容易受到缺血的影响,继而发生变性坏死[9-10]。Chen C等[11]对110名育龄妇女生殖道内的微生物群系统研究,通过16S rRNA基因扩增子测序和培养发现子宫腺肌病患者(子宫内膜异常肌层内的组织)显示出耗尽或富集在整个生殖道的许多细菌中,其中与贫血相关的细菌重叠。本文中产妇分娩后生殖道微生物群发生变化,从而导致子宫腺肌瘤感染,发生变性坏死。结合该患者既往两次流产后均不明原因出现高热,在以上原因都存在的前提下,我们推测该患者既往流产后发生肌瘤变性坏死、感染,抗感染治疗将感染病灶局限于瘤腔,定植于腺肌瘤内;此次妊娠终止后机体免疫力低下使细菌激活,反复高热,最终发展成脓毒血症。
2.2 发生脓毒血症原因分析
全球范围大约11% 的孕产妇死亡是由感染引起,而脓毒血症是感染导致孕产妇死亡的必经过程,位列孕产妇死亡病因的前5位。在我国,入住ICU的产科患者占12.6%,其中5.3%为脓毒血症[12]。妊娠本身即可成为脓毒血症的危险因素,可分为产前、产时和产后3类。① 产前因素:包括初产、非白人种族、低收入、很少或根本没有产前保健,营养不良(包括肥胖)、贫血、糖尿病、慢性高血压和产后1 h内应用抗生素[13]。② 产时因素:包括产程活跃期延长、胎膜破裂时间过长、宫口开全时阴道检查次数过多(>5次)、使用产钳或负压吸引,在分娩期间发生脓毒血症最重要的危险因素是紧急剖宫产。③ 产后因素:包括胎盘残留和与乳腺炎有关的并发症[12]。本文中的患者在孕期行宫颈环扎术、孕晚期发生胎膜早破后予以缩宫素引产,阴道试产中阴道检查,后行紧急剖宫产术,这些均是发生脓毒血症的高危因素。剖宫产术中发现胎膜腐朽,宫腔可闻及异味,宫腔环境差,不排除宫体本身感染可能。产后机体免疫力低下,雌激素水平骤然下降、子宫腺肌瘤变性坏死综合各种因素导致患者全身感染,反复高热,继发脓毒血症。孕产妇发生脓毒血症的最常见致病菌为大肠埃希菌及A、B组链球菌,且存在多种微生物和感染的情况[12]。本例患者血培养结果回示大肠埃希菌感染,也印证了此观点。
2.3 临床表现及诊断
孕产妇脓毒血症的临床特征与非孕妇相似,包括体温高于38℃或低于36℃、心率高于110次/min、呼吸>24次/min、WBC计数异常低或高以及凝血异常,应进一步评估其他情况,如与病情不相称的腹痛、呕吐、腹泻和胎心率异常,特别是心动过速[14]。本例患者在剖宫产术中发现胎膜腐朽,宫腔可闻及异味,子宫左后侧巨大腺肌瘤。术后即予以哌拉西林他唑巴坦+甲硝唑抗感染治疗,但患者术后19+h即开始发热、腹痛,可能因为病变退行性变或进展为坏死导致的前列腺素释放有关[15]。患者腹部CT、MRI及超声均提示:子宫腺肌瘤变性坏死可能,诱发患者出现发热、一般情况差、贫血、低蛋白血症等临床表现,并且发生脓毒血症[16]。体征表现为:子宫有压痛、腺肌瘤处压痛、反跳痛。结合辅助检查:WBC、NEUT%、CRP、PCT等感染指标均明显升高;腺肌瘤内可出现积液或积脓。临床上结合患者的症状、体征、感染指标、B超和CT检查,可尽早作出子宫腺肌瘤变性坏死的诊断,及时进行治疗。胎盘病理检查可明确有无宫内感染,在防治产褥感染中具有重要的临床价值[17]。本例患者胎盘病检回报证实了感染诊断。该患者剖宫产术后无恶露排出,可能由于巨大腺肌瘤压迫宫腔,直到穿刺引流后,瘤体体积逐渐缩小,对宫腔压迫作用逐渐消除后才开始排出恶露。
2.4 治疗
对怀疑脓毒血症的孕产妇尽早给予经验性广谱抗生素,最好在1 h内应用,一旦有了培养结果,抗生素的覆盖范围应缩小,并且对病原体有针对性[12]。引起脓毒血症的微生物,据报道主要有溶血性链球菌、A、B族链球菌、大肠杆菌、肺炎克雷伯菌、金黄色葡萄球菌、肺炎链球菌、MRSA、芽孢杆菌、摩根菌等[18-19]。B族溶血性链球菌、大肠杆菌是绒毛膜炎最常见的需氧菌,大肠杆菌是埃希氏菌属的代表菌。根据药敏结果应用抗生素。本例患者血培养中找到大肠埃希氏菌,药物敏感试验提示对美罗培南敏感,使用美罗培南抗感染治疗10 d,患者感染控制欠佳,考虑当炎症不能控制,出现子宫内膜、肌层感染坏死时,引起腺肌瘤感染坏死,可能发生感染扩散、子宫穿孔、急性腹膜炎、全身炎性反应综合征及脓毒血症,危及患者生命。建议子宫次全切除术或子宫全切除术以祛除原发灶控制感染[20]。但该患者及家属有强烈保留生育功能愿望,充分交代病情及相关风险后,患者及家属仍坚持保留子宫。在完善术前准备,普外科及介入科会诊后行超声+DSA引导下行经腹部子宫腺肌瘤腔穿刺引流术,穿刺术中经引流管注入双氧水、甲硝唑氯化钠注射液后可见清亮液体自宫颈口流出,考虑穿刺导致瘤底破裂,使坏死组织经阴道及腹部引流管充分引流,术后继续予以抗感染治疗,予以腺肌瘤腔冲洗,患者体温逐渐下降至正常,在定期腹腔引流管冲洗过程中患者突然出现急性腹膜炎,考虑在冲洗过程中腺肌瘤腔内压力增加,导致瘤腔破裂,使局限于腺肌瘤中的坏死组织流入腹腔从而诱发腹膜炎,在有效抗炎治疗及充分引流下患者腹膜炎得以控制,最后治愈成功使患者子宫得以保留。
2.5 经验教训总结
① 早期识别高危因素,早期抗感染治疗,对于患有子宫腺肌瘤的妇女是否应在妊娠前或剖宫产术中进行手术治疗。② 动态监测感染指标和影像学检查的变化。③ 当确诊子宫腺肌瘤坏死,在抗炎治疗后一旦瘤腔坏死病灶形成是否可以尽早介入治疗使坏死病灶充分引流。④ 药物治疗无效后尽早手术祛除病灶,减少母儿并发症的发生。⑤ 多学科合作在产科临床应用中值得推广。对于子宫腺肌瘤或子宫肌瘤妊娠妇女,尤其是瘤体较大者,在妊娠期间腹痛除了红色变性等,还应该考虑可能存在瘤腔潜伏存在的条件致病菌引发的急性感染。
对于子宫腺肌瘤患者,无论是在妊娠期还是产褥期,患者出现急腹症、发热等表现时,应警惕腺肌瘤变性坏死可能。当患者有生育要求时,有效的抗炎+局部介入穿刺引流不失为一个有效的治疗措施。虽然子宫腺肌瘤合并妊娠的孕产妇数量多,但是子宫腺肌瘤合并妊娠的文献、指南报道并不多,而发生子宫腺肌瘤变性坏死后继发脓毒血症的病例更是罕见,我们应重视这类患者。子宫腺肌瘤患者不仅在妊娠期,产后也应该高度重视,加强对子宫腺肌瘤变性坏死、感染甚至破裂的认识及治疗,为患者提供更及时、更有效的个体化治疗。临床医生需要不断总结经验及教训,为患者提供最佳的治疗方案。
