不同浓度褪黑素对体外培养猪腔前卵泡生长发育的影响
2021-04-27毛梦菌吴佳俊
毛梦菌,吴佳俊,高 倩
(衢州市衢江区畜牧兽医站,浙江 衢州 324022)
哺乳动物卵巢中含有大量的腔前卵泡,但是在发育到有腔卵泡前大约有99.9%的卵泡都走向闭锁、退化,这无疑是动物繁殖领域内巨大的浪费。卵母细胞是体外受精、胚胎移植、动物克隆和转基因等胚胎生物技术研究和开发不可或缺的材料,然而卵母细胞来源十分匮乏成为其发展的一个制约性因素,无疑腔前卵泡的体外培养技术为其提供了一个有效途径。褪黑素(MT)在生殖调控中具有重要作用,在人排卵前卵泡液中发现了高水平的褪黑素,提示褪黑素有可能直接参与卵泡的生殖调控。
1 材料与方法
1.1试验材料 猪卵巢从北京市郊区屠宰场采集,经灭菌生理盐水洗涤后,在装有37℃添有双抗的灭菌生理盐水的保温瓶中2 h内运回实验室。
1.2主要化学试剂 DMEM/F12粉末(GIBICO),FBS(Sigma),抗坏血酸(Ascorbic acid,Sigma),ITS(Gibico),青霉素钠(Penicillin G,Sigma),链霉素(Streptomycin sulfate,Sigma),促卵泡激素(FSH,Sigma)。
1.3主要仪器、耗材 恒温CO2培养箱(Thermo),超净工作台(SW-CJ-IF),体视显微镜(Olympus),倒置显微镜(Olympus IX-50),96孔培养板(Corning Incorporated,3599),PCR仪,离心机以及万级净化实验室。
1.4试剂配制方法 DMEM/F12培养液的配制见表1。
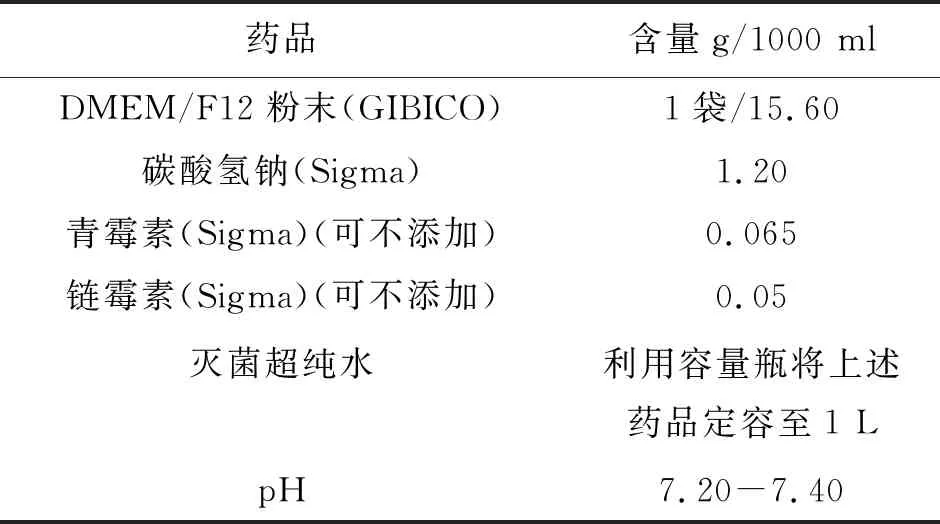
表1 DMEM/F12的成分及配制方法
将上述成分分别加入500 mL灭菌Milli-Q超纯水中,充分溶解后,调节pH为7.2-7.4,定容至1000 mL。溶液配制好后,用0.22 μm滤膜过滤灭菌,并用250 mL高压灭菌玻璃瓶分装,4℃保存。
双抗(Penicillin Streptomycin)100×储备液:青霉素10,000 U/mL、链霉素10,000 μg/mL,分装于无菌EP管中,200 μL/管,-20 ℃冻存。
ITS(胰岛素转铁蛋白硒酸)100×储备液:各个成分浓度(g/L):胰岛素1.00,转铁蛋白0.55,亚硒酸钠0.00067,氨基乙醇0.20;原装10 mL/瓶,分装于无菌EP管中,200 μL/管,4 ℃避光保存。
FSH储备液:取1 mg FSH溶解于10 mL超纯水中,配成0.1 mg/mL母液,用0.22 μm微孔滤膜滤菌后分装到0.5 mL离心管中,-20 ℃保存。
MT储备液:在分析天平上准确称量0.2339 g MT粉末,溶解于1 mL的DMSO中,得到0.1 M的母液。分装到0.5 mL离心管中,-20 ℃避光保存。
1.5腔前卵泡的分离和选择
1.5.1腔前卵泡的分离液和收集液 腔前卵泡的分离液和收集液为添加1% FBS的DMEM/F12基础培养液,并在37℃、5% CO2培养箱中平衡4 h。
1.5.2腔前卵泡的分离 挑选表面无黄体且无大卵泡的中等大小的猪卵巢,用含双抗的37 ℃的生理盐水冲洗干净,并放置于37 ℃的卵泡分离液中。用灭菌的刀片将卵巢皮质切削成薄片(0.5 mm),用卵泡分离液清洗干净后用无菌镊子夹持放置于一次性塑料培养皿中的卵泡分离液中,用装有针头的1 mL注射器在体视镜下分离卵泡。
1.5.3腔前卵泡的选择和藻酸盐胶球三维包裹处理 分离的卵泡收集于卵泡收集液中,用收集液洗涤后,挑选直径在200-400 μm的健康卵泡(卵泡卵母细胞和颗粒细胞完全被基底膜、膜细胞和基质组织包围),进行藻酸盐的三维包裹处理后进行培养(图1A)。
1.6腔前卵泡的培养 基础培养液为DMEM/F12,添加7.5% FBS、10 mU FSH、1%ITS、100 μg/mL L-AA以及不同浓度的MT,培养液用前在二氧化碳培养箱中至少平衡4 h。培养条件为37.5 ℃、5% CO2。采用96孔培养板,每孔100 μL培养液。将挑选好的腔前卵泡随机分组到不同的试验组中,每孔一个卵泡,培养4 d,每48 h半量换液一次。
1.7各项指标判断标准
1.7.1卵泡直径测量 测量培养前卵泡直径(第0 d),以后每隔一天测量一次直径(即第2 d、第4 d),由于分离的腔前卵泡的形态并非总是呈标准的圆形,所以以基底膜外缘为准,选择测量最长距离(长径)和与之相垂直的最短距离(短径),取平均值。
1.7.2卵泡细胞凋亡检测 将培养第4 d的卵泡取出,在于37 ℃恒温箱中平衡4 h的PBS液中清洗2次,在另外一份PBS液中于体视镜下用1 mL注射器针头对卵泡进行破坏,将卵泡破碎物收集在1 mL离心管中,在4 ℃恒温离心机中1 500 r/min转动2 min。用Trizol裂解后提取总RNA后对与细胞凋亡相关的Bcl-2、Bax和Bim等三个基因进行反转录,得到的cDNA进行半定量PCR。PCR体系为:1 μL cDNA、0.5 μL上下游引物、10.5 μL ddH2O、12.5 μL 2×PCR Master mix。PCR程序为:94 ℃ 5 min,94 ℃ 15 s,58 ℃ 20 s,72 ℃ 20 s,72 ℃ 10 min,共进行30次循环。PCR结束后,进行琼脂糖凝胶电泳,并在紫外灯下进行观察,比较各组的细胞凋亡情况。
1.8试验分组及测定指标
1.8.1生长发育测定 比较在体外培养的猪腔前卵泡在不同浓度褪黑素(0、10-11M、10-9M、10-7M)的培养液中,对于卵泡生长发育情况的影响。
1.8.2基因表达测定 比较在体外培养的猪腔前卵泡在不同浓度褪黑素(0、10-11M、10-9M、10-7M)的培养液中,于培养的第4 d取样,提取总RNA后进行RT-PCR,通过比较与细胞凋亡有关的基因(Bcl-2、Bax和Bim)的表达情况,以及不同浓度下褪黑素对细胞凋亡情况的影响。
1.9统计分析 试验所得数据使用SPSS 18.0进行统计学分析。以P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1MT对体外培养猪腔前卵泡生长的影响 由表1可见,在开始对猪腔前卵泡进行培养前各处理组间差异不显著(P>0.05);在培养4 d的过程中,卵泡持续增长,卵泡的直径随培养时间的增加而逐渐增大。在培养的第2 d、第4 d的卵泡的平均直径各组间差异也不显著(P>0.05),说明各组间的处理对卵泡的体外生长直径的增长影响不大。

图1 不同阶段猪腔前卵泡

表1 MT对猪腔前卵泡体外生长发育的影响
3.2MT对体外培养猪腔前卵泡细胞凋亡的影响 Bcl-2被认为是细胞凋亡蛋白家族中最重要的调控蛋白,和Bax、Bad、Bak等共同组成了Bcl-2蛋白家族。Bax能允许一些离子和小分子如细胞色素C等穿过线粒体膜,进入细胞质,从而引起细胞凋亡,而Bcl-2的作用正好相反,它能封闭Bax形成孔道的活性,使一些小分子不能自由通透,从而保护细胞凋亡。因此可以用Bcl-2/Bax值来比较细胞凋亡情况。从图1可见添加褪黑素组Bcl-2/Bax值都变大,表明MT的添加具有明显的抗凋亡作用,其中10-9M的效果最好。Bim是Bcl-2家族中BH3-only亚家族的成员,是一种重要的凋亡调节蛋白,一定的凋亡刺激能通过各种信号途径激活Bim分子,活化的Bim分子通过与Bcl-2/Bax的相互作用激活Bax,引起线粒体途径的细胞凋亡。由图1可知,在添加MT的处理组中Bim的表达量都有所下降,其中10-9M的表达量下降最多,同样说明了添加MT可以有效的降低卵泡细胞的凋亡水平,并且添加10-9M的浓度更为合适。
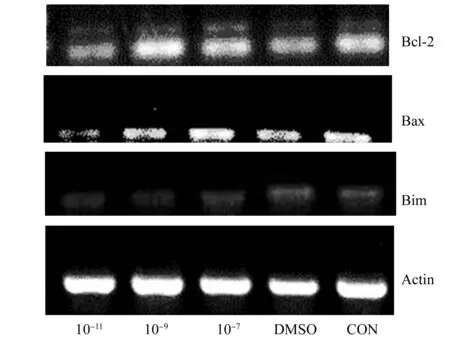
图2 凋亡相关基因RT-PCR实验结果
3 讨论
3.1MT对腔前卵泡体外生长的影响 腔前卵泡的生长包括两方面的内容,一是卵母细胞的体积的增大,二是卵母细胞周围颗粒细胞的迅速增殖和分化。腔前卵泡的生长发育受体内多种生长因子和激素的调控。研究表明,在人的排卵前卵泡液中褪黑素浓度水平是血清中的3倍[1]。在卵巢中还存在着褪黑素合成的前体物质以及其合成过程中的两种关键酶NAT和HIOMT,这说明卵巢可能会合成褪黑素释放到卵泡液中。褪黑素可以在卵泡发育的不同阶段影响性腺激素的生成,Adriaens等研究表明鼠的腔前卵泡在含褪黑素(100 μm)培养液中培养12 d后增加了雄激素和孕激素的生成量[2]。同样的,在猪有腔卵泡的培养中MT(100 ng/mL)可以刺激孕激素和雄激素的产生,但雌激素的水平不变[3]。在猪卵母细胞体外成熟体系中添加10 ng/mL MT可以明显降低ROS的含量,促进卵母细胞的核成熟和胞质成熟。MT对卵泡生长和发育的调控可能是通过影响膜细胞的类固醇激素的生成和作为体内的ROS清除剂起作用的。
本实验的结果表明,培养前的卵泡直径各组间差异不显著(P>0.05),培养的第2 d、第4 d,卵泡的平均直径各组间差异也不显著(P>0.05),说明各处理组对卵泡体外培养直径增长的影响差异不大。一方面可以说明褪黑素在卵泡生长发育中的作用可能不是通过促进卵母细胞和颗粒细胞的增殖分化而表现的,它与性腺激素的形成相关。另一方面可以说明在体外培养条件下褪黑素浓度为10-11M、10-9M、10-7M时对腔前卵泡的直径增长影响不大,有可能是位于卵泡发育的早期,卵泡对MT的敏感性反应比较滞后导致的,其在体外促细胞生长方面作用还有待进一步研究。
3.2MT对体外培养腔前卵泡细胞凋亡的影响 在卵泡的发育过程中,卵母细胞和周围的颗粒细胞相互影响,共同生长。颗粒细胞的增殖、分化,卵母细胞的细胞核、细胞质的成熟都对卵泡的发育有着重要作用。卵泡内细胞的大量凋亡将会影响卵泡的正常发育过程。
细胞凋亡受到机体严密的调控,Bcl-2基因家族是最重要的细胞凋亡调控基因,其同源蛋白可分为:凋亡抑制蛋白包括Bcl-2、Bcl-XL等和凋亡诱导蛋白包括Bax、Bcl-XS等。Bcl-2可以阻止线粒体细胞色素C的释放而发挥抗凋亡作用,而Bax的作用恰好相反,其可以诱导细胞的凋亡。Bim是Bcl-2家族中仅含有一个BH3结构域的蛋白,具有助凋亡活性。
在细胞凋亡中通常与机体周围环境中的活性氧有关,褪黑素是一种极强的抗氧化剂,但是对于不同的细胞,褪黑素具有不同的功效,在肿瘤细胞、癌症细胞等中MT会促进其凋亡;在神经细胞中的凋亡则会被其抑制。研究表明,MT可以使人B淋巴母细胞瘤细胞RAMOS-1线粒体膜去极化胞内钙浓度升高而导致凋亡[4];MT可以促进成神经细胞瘤细胞向神经细胞分化[5]。
由图1 可知,10-11、10-9、10-7M浓度的褪黑素均能在一定程度上降低细胞的凋亡水平,其中10-9M浓度的MT抑制细胞凋亡水平的程度最大,效果最明显。
4 结论
在本实验研究浓度范围内,褪黑素对于体外培养猪腔前卵泡的生长没有显著影响。在体外培养体系中添加褪黑素具有抑制卵泡细胞凋亡的作用,其中10-9M浓度的MT抗凋亡效果最明显。
