高产那西肽活跃链霉菌的高通量选育
2021-04-27张小朋陈贵才严发杰郭李坤曾伟主周景文
张小朋,陈贵才,严发杰,郭李坤,曾伟主,周景文*
1(甘肃汇能生物工程有限公司,甘肃 武威,733000) 2(浙江汇能生物股份有限公司,浙江 海宁,314422) 3(生物工程学院 工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
那西肽(nosiheptide)又称诺西肽,是一类含有多个噻唑环的硫多肽类抗生素,对革兰氏阳性菌具有良好的抑制作用[1-2],具有不易被分解、用量低、抑菌范围广和不易残留等特性,被广泛应用于饲料行业中。在动物细胞体内,那西肽能够持续地对肠道中的菌群生态进行微调控,且具有促进动物生长的作用,被认为是一种非常好的新型非吸收动物添加剂[3-4]。目前,那西肽主要以发酵法进行生产,其生产菌株主要为活跃链霉菌(Streptomyesactuosus)、抗生素链霉菌(Streptomyesantibiotics)和青灰色链霉菌(Streptomyesglaucogriseus),以活跃链霉菌的生产效果最佳[5-6]。
那西肽是一种次级代谢产物,具有复杂的合成途径。已有研究针对其合成机制和作用功能进行解析,另外,通过代谢工程等策略提高了那西肽效价[7-9]。目前工业上提高那西肽效价的方法主要为诱变育种和发酵过程优化[10-12]。常用的诱变育种方法包括物理诱变和化学诱变等方法。刑新会等[13]开发了一种常压室温等离子体诱变育种技术(atmospheric and room temperature plasma,ARTP),该方法具有操作简单、成本低、突变效率高等优势,已广泛应用于细菌、放线菌、微藻、真菌、酵母等微生物。ARTP技术在阿维菌素、盐霉素和头孢菌素等抗生素高产菌株的筛选中取得了较好的效果[14-16]。然而,在筛选过程中大多数采用基于随机筛选或抗性平板的筛选方法,存在工作量大、周期长、效率低及成本高等缺点[17-18]。近年来,具有自动化、规模化和微型化的优势的高通量筛选方法(high-throughput screening,HTS)的兴起,为那西肽等次级代谢产物高产菌株的高效筛选提供了平台[19-20]。
依据那西肽的分子结构特性,其与FeCl3发生络合反应生成的配合物,在520 nm可见光下能被快速检测,基于此建立了一种高通量筛选方法。本研究利用ARTP诱变育种方法处理那西肽工业生产用菌株活跃链霉菌11-27,结合建立的高通量筛选方法筛选高产那西肽突变菌株,并考察其遗传稳定性和在50 m3工业发酵罐中的生产性能。
1 材料与方法
1.1 材料
1.1.1 菌株
活跃链霉菌Streptomycesactuosus11-27为甘肃汇能生物工程有限公司工业化生产那西肽用菌株。
1.1.2 主要试剂和仪器
玉米淀粉、α-淀粉酶、黄豆饼粉、玉米浆、蛋白胨、豆油等,甘肃汇能生物工程有限公司;其他化学试剂,国药集团化学试剂有限公司。
ARTP诱变育种仪,无锡思清源生物科技有限公司;FE20K pH计,瑞士Mettler-Toledo公司;FREEDOM EVO移液工作站,瑞士Tecan公司;QPix 420智能挑菌仪,美国Molecular公司;Cytation3酶标仪,美国BioTek公司;Allegra X-15R离心机,美国Bekman公司;Eppendorf 5424高速离心机,美国Eppendorf公司;高效液相色谱仪,Shimadzu Corporation公司;50 m3发酵罐,浙江科美制药机械有限公司。
1.1.3 培养基
固体培养基(g/L):可溶性淀粉20,蛋白胨5,KNO31.0,KH2PO40.5,MgSO4·7H2O 0.5,NaCl 0.5,CaCO35,琼脂20;pH 7.0~7.2,121 ℃灭菌20 min。
种子培养基(g/L):玉米淀粉20,黄豆饼粉10,玉米浆20,(NH4)2SO42,CaCO35;pH 6.6~6.8,121 ℃灭菌20 min。
筛选培养基(g/L):玉米淀粉80,α-淀粉酶0.1,黄豆饼粉30,硫酸铵2,NaCl 2;KH2PO40.5,豆油5,CaCO35,121 ℃灭菌20 min。
1.2 方法
1.2.1 菌悬液制备
用无菌生理盐水从新鲜成熟的活跃链霉菌茄子瓶斜面上洗下一定量孢子,加入玻璃珠,振荡30 min后经脱脂棉、漏斗进行过滤,梯度稀释,将孢子悬液浓度调整至106~107个/mL,取1 mL孢子悬液于1.5 mL EP管中备用。
1.2.2 ARTP诱变
采用ARTP技术对出发菌株11-27进行诱变处理。取10 μL制备好的孢子悬液均匀涂布于无菌载片表面。然后将载片置于ARTP诱变育种系统的载台上,在入射功率为100 W、氦气流量为10 SLM条件下,分别照射0、20、40、60、80、100、120、140和160 s。样品处理完毕后,用镊子将载片转移至装有1 mL无菌生理盐水的EP管中振荡重悬1 min,将附着在载片上的孢子充分洗脱形成孢子悬液。
1.2.3 致死率测定
将ARTP不同照射时间处理后的单孢子悬液进行梯度稀释,取10-4、10-5梯度的0.2 mL孢子悬液涂布在固体分离平板培养基上(每个梯度进行3组重复),于温度为28 ℃、湿度50%~60%的恒温培养箱内培养3 d,分别统计长出的菌落个数,按照公式(1)计算致死率:
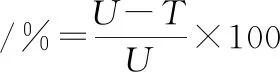
(1)
式中:U,对照组长出的平均菌落数;T,用ARTP技术处理后长出平均菌落数。
1.2.4 高通量筛选
应用QPix 420智能挑菌仪将成熟后的单菌落挑选于含有800 μL液体培养基的96深孔板中,在30 ℃、220 r/min条件下培养28 h,以10%的接种量转接于含有1 mL液体筛选培养基的48深孔板中,在30 ℃、220 r/min条件下培养4 d后,加入1 mL无水乙醇37 ℃保温30 min,4 000 r/min离心15 min,取一定体积上清液,加入等体积无水乙醇,摇匀,取120 μL上述含有那西肽的样品液于96浅孔板中,再加入80 μL 10 mmol/L的FeCl3溶液,静置10 min后,用酶标仪检测520 nm处的吸光值,吸光值越高表明那西肽含量越高,挑取高于对照5%以上的优势菌株复筛。
将孔板初筛选取的优势菌株接种试管斜面,于28 ℃,湿度50%~60%培养7 d,成熟后转接至摇瓶种子液中,28 ℃、220 r/min条件下培养28 h,10%接种量接入摇瓶发酵液中,于28 ℃、220 r/min条件下培养6 d,检测效价,挑取高于对照10%以上的优势菌株。
将摇瓶复筛选取的优势菌株进行传代培养,并进行遗传稳定性检测,将确定了遗传稳定性的高产菌株砂土保藏。
1.2.5 高通量检测
高通量检测那西肽含量是通过全自动移液工作站将发酵液转移至96孔浅孔板中,加入FeCl3溶液,用酶标仪检测OD520处吸光值,吸光值越高表明那西肽含量越高。
1.2.6 液相检测条件
采用高效液相色谱法检测发酵液中那西肽的含量。色谱柱:Diamonsil C18(150 mm×4.6 mm,5 μm);检测器:示差检测器;流动相:V(乙腈)∶V[水(0.025%磷酸)]=50∶50;流速:1 mL/min;柱温:26 ℃。
2 结果与分析
2.1 ARTP诱变致死率曲线
ARTP诱变育种技术中所用的等离子体射流能打断细胞内C-N键、氨基键和P-O键,会导致大部分微生物死亡,但少部分会通过自身修复系统而存活下来,从而导致基因突变[21]。活跃链霉菌经ARTP诱变处理的致死率如图1所示,菌株致死率随诱变时间的增加而增加,当处理时间为30 s时,菌株已经受到明显损伤,致死率达60%;当处理时间从30 s增加至40 s,致死率从60%急剧增加到90%;当处理时间超过70 s后,菌株的致死率接近100%。
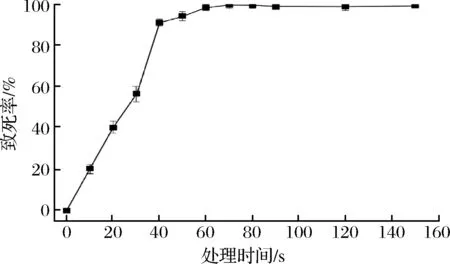
图1 ARTP诱变致死曲线Fig.1 The lethality curve of ARTP treatment
研究报道ARTP诱变处理的致死率在90%以上的突变效果较好[22]。因此,本研究选取40~60 s间之的时间作为后续的诱变处理时间。
2.2 高通量筛选方法的建立
目前,那西肽常用的检测方法包括高效液相色谱法、分光光度法。高效液相色谱法检测精准性高、范围广,但并不适用于高通量筛选检测;分光光度法操作步骤繁琐,处理时间长,检测方法存在准确度不高和重复性较差等问题[23]。那西肽为sp杂化化合物,具有的羟基与sp2杂化的C原子相连,易与FeCl3发生络合反应,生成的络合物在某一特定波长下具有较大的响应值。通过全波长扫描发现在,该络合物在520 nm可见光处的响应值更高。为了选择出最合适的FeCl3添加量(母液浓度为10 mmol/L),比较了200 μL总反应体系中加入不同比例FeCl3溶液(VFeCl3母液∶V总体积,20∶200、40∶200、60∶200、80∶200、100∶200、120∶200)对检测方法的影响,静置10 min后用酶标仪检测OD520(检测过程那西肽的终质量浓度分别为0、125、250、375、500、625和750 μg/mL)。结果如图2所示,当FeCl3的加入体积比例为80∶200时,检测方法的线性化程度最佳,其线性方程为:Y=6.770 3×10-4X+0.369 8,R2=0.994 6。
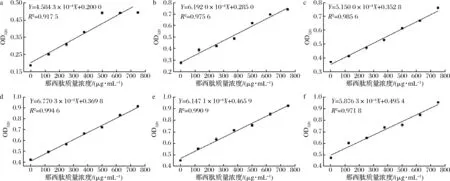
FeCl3加入体积与总体积之比;a-20∶200;b-40∶200;c-60∶200;d-80∶200;e-100∶200;f-120∶200图2 总体系中不同FeCl3溶液体积比的对比Fig.2 Comparison of different adding ratio of FeCl3 solution to the total system
2.3 高产菌株的高通量筛选
QPix 420微生物智能筛选系统和移液工作站具有准确、快速、灵敏、高通量和多参数同时分析等优点,已应用于工业微生物的高通量筛选过程,从而实现优良菌株的高效筛选[20]。本研究应用ARTP诱变处理那西肽工业生产菌株11-27,共进行3轮次诱变处理,构建了共有14 400株菌(96×150)的突变菌库。应用建立的高通量筛选方法从突变菌种库中筛选出125株那西肽含量提高的突变菌株(图3)。继续对这125株突变菌进行摇瓶复筛,以10%接种量转接至25 mL筛选培养基中,30 ℃、220 r/min条件下培养6 d,高效液相色谱法检测那西肽量。结果如图4所示,其中有6株生产那西肽含量提升10%以上的突变株,分别为16-7D8、10-2F3、12-6G8、19-1F9、22-3B6、20-5D4,那西肽的效价较出发菌株11-27分别提高了10.3%、11.5%、12.0%、10.7%、13.7%、12.8%。
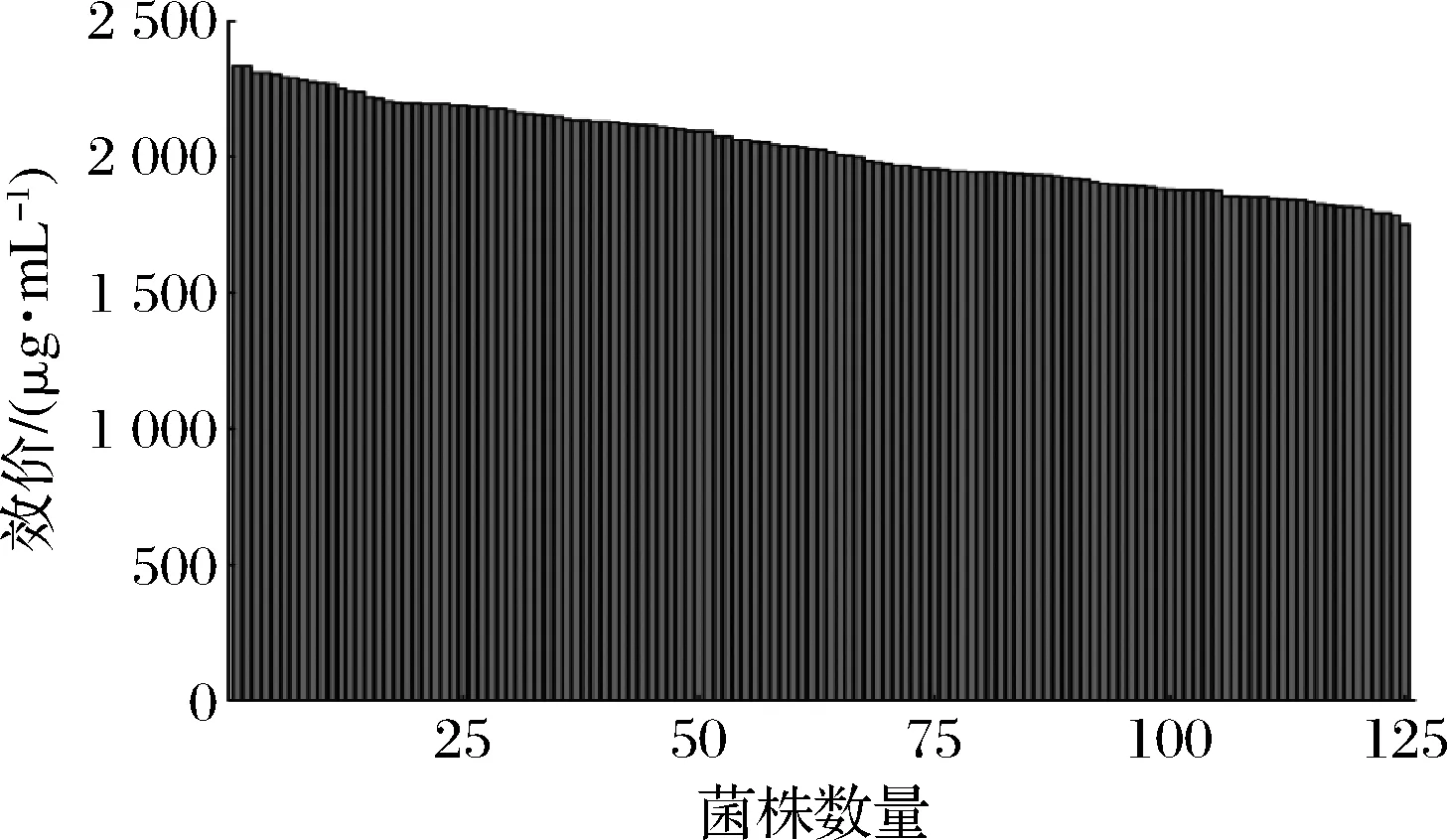
图3 ARTP诱变初筛Fig.3 Primary screening with ARTP mutation

图4 摇瓶复筛Fig.4 Second screening in the shake flasks
2.4 高产菌株的遗传稳定性分析
为了验证突变菌株的遗产稳定性,对ARTP诱变处理后获得的6株高产菌株进行连续传代8次,以工业出发菌株11-27为对照。对其中第1代、第4代和第8代进行摇瓶发酵,检测突变菌株的发酵特性。结果如表1所示,传代至第4代时,突变体积累那西肽的含量基本没大变化。传至第8代时,所有突变菌株积累的那西肽的含量与第1代和第4代的含量基本相当。摇瓶验证结果表明6株高通量筛选获得的突变菌株具有稳定的遗传特性。

表1 突变菌株遗传稳定性Table 1 The genetic stability of mutant strains
2.5 高产菌株的生产发酵验证
将那西肽效价提高最显著的诱变株22-3B6继续进行工业化生产验证。菌株活化后在50 m3罐发酵生产16批次,发酵200 h后,发酵液经预处理提取干燥后检测效价,生产过程以原始菌株11-27为对照。结果如图5所示,诱变菌株22-3B6生产16个批次的那西肽的平均效价为5 272 μg/mL,相比对照株11-27(4 788 μg/mL),其效价提高了10.1%,生产过程的转化效果提升明显。

图5 突变菌株22-3B6的生产验证Fig.5 Industrial verification of mutant 22-3B6
3 结论
那西肽是一类典型的可抑制革兰氏阳性菌的含硫类抗生素,由于其安全、低毒性、无残留和促生长等特点,已被广泛应用于饲料添加剂中[24-25]。目前,那西肽的生产主要以活跃链霉菌发酵法生产。近年来,研究人员通过诱变育种、基因组重排、那西肽合成前导肽的改造和发酵过程优化与控制等策略提高了那西肽的效价[26-27]。但由于筛选通量低和人工负担重的限制,那西肽优良工业生产菌株的获得仍面临许多挑战。
本研究基于那西肽分子杂化的特征,其与FeCl3形成的络合物在可见光520 nm处具有较明显的响应值,构建了一种用于筛选那西肽高产菌株的高通量筛选方法。结合ARTP诱变育种技术,从14 400株突变菌株中筛选出6株那西肽效价明显提高的突变菌,检测该6株菌在合成那西肽方面具有较高的遗传稳定性。最终,将优良菌株22-3B6在50 m3发酵罐中进行生产性能的验证,结果表明,与原始菌株相比,22-3B6积累那西肽的效价提高了10.1%。本研究应用ARTP诱变技术和高通量筛选技术,高效、快速地获得了高产那西肽的突变菌株,表明应用突变菌株能有效降低那西肽的生产成本,增强企业的核心竞争力。近年来,通过基因组学和转录组学等生物信息学技术解析了链霉菌合成那西肽的合成基因簇,并应用代谢工程手段强化了菌株中那西肽的合成[28-29]。另外,合成生物学技术的兴起为强化抗生素等次级代谢产物的生物合成带来了机遇。因此,在后续研究中,可继续采取流式细胞分选、重离子诱变、基于代谢工程和合成生物技术的理性改造以及基于微型反应器优化发酵过程等策略进一步提高活跃链霉菌生产那西肽的能力。
