纤维蛋白胶复合博莱霉素对兔下肢浅静脉的损伤效应及纤维化研究
2021-04-27沈艳玲刘源杨霞闫志伟杨涛张春谊宋昌龙冯瑶杨耀武
沈艳玲 刘源 杨霞 闫志伟 杨涛 张春谊 宋昌龙 冯瑶 杨耀武
静脉畸形(venous malformations,VMs) 是来源于血管系统的发育畸形,过去称为海绵状血管瘤。病变由扩张的静脉管腔或血窦组成。VMs好发于头颈部,可造成颜面畸形及言语、吞咽、呼吸等功能障碍。平阳霉素(pingyangmycin,PYM)、博莱霉素(bleomycin,BLM)硬化治疗是VMs重要的治疗方法[1-3]。PYM是我国自主生产的抗肿瘤抗生素,其成分与国外生产的BLM相近,区别是PYM以博莱霉素A5成分为主。在大范围、高回流VMs治疗方面,单纯PYM或BLM注射后使用效率低,治疗周期长,疗效欠佳。2005年,杨耀武治疗团队提出了纤维蛋白胶(fibrin glue,FG) 复合PYM栓塞硬化治疗VMs的方案,在PYM一度停产期间,应用BLM替代PYM进行治疗。该方案在治疗口腔及面颈部VMs方面疗效理想,优势明显[4-5]。为了揭示其治疗机制,本研究通过观察FG/BLM 注射后家兔下肢浅静脉的大体及组织病理学变化,探索该技术导致静脉纤维化的过程以及闭锁VMs的可能作用机制。
1 材料与方法
1.1 实验动物与分组
选择健康成年家兔12 只,体重3.5~4.5 kg,双侧共24 根下肢浅静脉作为实验对象。分为FG注射组和FG/PYM注射组,每组注射12 根静脉。用电动剃毛刀由下向上术区剃毛,显露下肢浅静脉后备用。
1.2 实验方法
1.2.1 注射药物配制 FG配制方法:外用冻干人纤维蛋白粘合剂(护固莱士,上海莱士血液制品股份有限公司),其中两组分冻干人纤维蛋白原、冻干人凝血酶分别用灭菌注射用水、氯化钙溶液中各2 mL溶解,然后抽入双联注射器备用。FG/PYM配制方法:FG配制方法同上。注射用盐酸博莱霉素(日本化药株式会社)15 mg+2%利多卡因1 mL+地塞米松1 mL溶解,然后将BLM溶液分别加入FG两组分各1 mL。混匀后抽入双联注射器备用。
1.2.2 注射方法 FG组:用止血带捆扎兔下肢浅静脉近心端(图1),皮肤消毒后应用5 mL注射器从下肢浅静脉远心端穿刺,抽到回血后用双联注射器注射FG 1.5 mL。注射后止血带捆扎保持3 min。FG/BLM组:选择家兔另外一侧下肢浅静脉,抽到回血后用双联注射器注射FG/BLM复合物1.5 mL。穿刺及静脉捆扎方法同FG注射组。
图1 兔下肢浅静脉(近心端捆扎后)
1.3 取材及标本处理
注射后3、7、14、28 d各取3 只动物,盐酸赛拉嗪注射液(陆眠宁,吉林华牧动物保健品有限公司)肌肉注射麻醉后解剖、显露经注射处理的下肢浅静脉,大体观察血管外观及形态。切取标本,4%多聚甲醛液固定,系列脱水,石蜡包埋,切片,HE及Masson三色法染色。光镜(奥林巴斯)观察静脉壁结构及管腔,纤维组织形成情况等。
2 结 果
2.1 大体观察
注射后3 d: FG、FG/BLM组大部分血管切断后无血流,内见半透明或暗红色栓子。部分血管直径正常,部分血管收缩变细。FG组胶栓成形较FG/BLM组更为明显,FG/BLM组部分血管变细,管壁变薄,血管呈暗红色。注射后7 d:从外观看FG、FG/PYM组血管均变细、充盈不明显,血管切断后无血流。FG组仍可见透明或暗红色栓子,部分成形,提示FG仍未降解,部分成形不明显。FG/BLM组管腔内也可见暗红色血栓,难以从管腔内挤压出来,提示有纤维化栓子形成可能。注射后14 d:FG、FG/BLM组血管外形、轮廓可见,触摸呈条索状,从表面看血管颜色为浅粉红色,管腔内以实性为主,无血流。大部分静脉内未见明显的FG胶栓,提示FG降解、血管逐渐纤维化。注射后28 d: FG组血管显著变细或闭锁。FG/BLM组血管颜色与周围接近,几乎消失(图2)。
2.2 组织学观察
注射后3 d,FG、FG/BLM组血管内均以不定形物为主,有纤维细胞增生,不成熟纤维组织增生现象(图3)。FG组血管内皮细胞结构尚可见,连续性缺失。FG/PYM组血管内皮细胞结构大部消失。注射后1 周,FG、FG/BLM组血管腔内可见裂隙,FG组血管壁被增厚的纤维组织取代,管腔内纤维组织形成少于FG/BLM组。FG/BLM组血管壁被显著增厚的纤维组织取代,血管腔内有大量成熟或不成熟的纤维组织形成。注射后2 周,FG、FG/BLM两组管腔均显著纤维化。FG组管腔可见少量裂隙,FG/BLM大部分血管壁被增生的纤维组织取代。注射后4 周,FG组血管血管腔基本被被纤维组织取代,血管壁依稀可见,FG/BLM组血管腔、血管壁基本消失,被纤维组织取代(图3)。
3 讨 论
BLM类药物常被用于抗肿瘤治疗[6-8],同时也被广泛应用于血管瘤和脉管畸形的治疗。BLM、PYM导致实验动物静脉以及人类静脉畸形纤维化的作用已经被大量基础及临床研究证实。高庆红等[9]通过观察家兔耳后静脉PYM注射后的组织学变化,认为PYM硬化治疗的可能机制为:血管内皮细胞及管壁组织产生非特异性损伤,使细胞的代谢发生紊乱,诱导血管平滑肌细胞、血管内皮细胞及管壁组织同时增生,管壁增厚,管腔缩窄及闭锁。Zhao等[10]研究发现,兔耳缘静脉PYM注射后,内皮细胞肿胀并空泡化,血管内膜连续性中断,管壁增厚、管腔狭窄、闭锁。
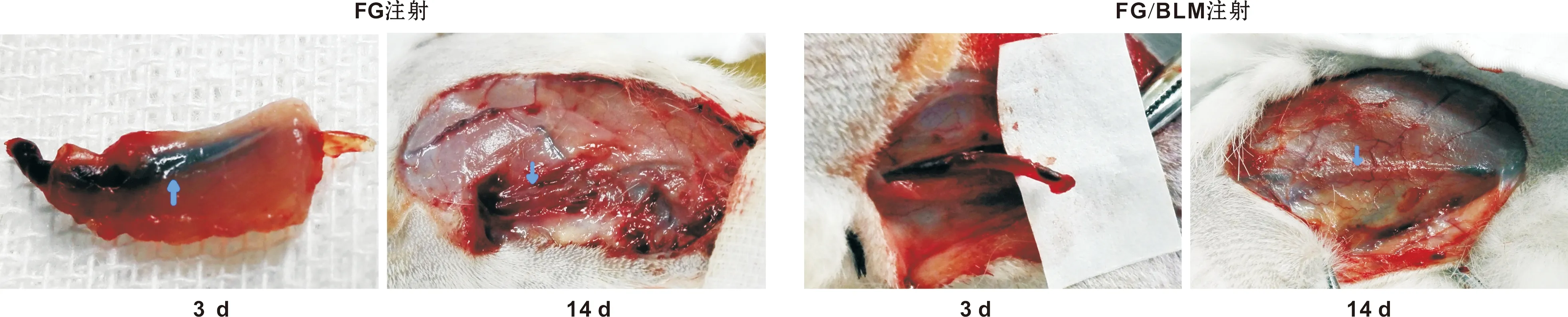
图2 兔下肢浅静脉FG、FG/BLM注射后大体观察

图3 兔下肢浅静脉注射后组织学观察(HE染色,×100)
本研究发现,兔下肢浅静脉FG、FG/BLM注射后对静脉血管有明确的栓塞作用,同时与FG复合的PYM得以长期存留。在一项有关该技术的影像学研究中,也证实了FG/BLM 注射到VMs 瘤腔后对回流静脉有栓塞、阻断作用,对注射到瘤腔的硬化剂有贮存作用[11]。组织学观察发现,FG/BLM复合注射后能够早期破坏内皮细胞、血管内膜并诱导纤维组织增生。随着FG的降解,管腔内逐渐被纤维组织取代。后期血管壁结构消失,被成熟纤维组织取代。
研究的一个重要发现是尽管单纯FG注射破坏血管、促纤维组织作用弱于于FG/BLM复合注射,但是仍可导致家兔下肢浅静脉纤维化。文献中鲜有单纯应用FG治疗或辅助治疗静脉畸形的报道,Jemec等[12]报道了1 例应用单纯FG注射治疗面颊部VMs的个案,病变消退且未见复发。其它报道则以FG辅助手术减少出血为主。FG的主要成分由冻干人纤维蛋白原、人凝血酶组成,常作为止血剂或粘合剂使用,并非用于治疗血管畸形的硬化剂。结合Jemec等[12]的分析,本研究认为FG致家兔下肢浅静脉和人VMs病变纤维化的可能机制是:(1)FG注射后占据血管内原有血液的空间,导致血管栓塞,胶块内或外周存留部分血凝块,胶块及血凝块与血管内皮直接接触发挥类似于“血栓”的作用,诱导内皮细胞破坏、血管内膜断裂及成纤维细胞增生;(2)FG的网状支架结构有利于成纤维细胞增殖以及纤维组织增生,随着FG的降解,成纤维细胞逐渐取代FG并大量分泌胶原,形成纤维组织;(3)管腔内的血凝块可以机化并逐渐形成纤维组织。
另一个发现是FG/BLM复合注射后对家兔下肢浅静脉的早期、快速破坏作用。家兔下肢浅静脉孔径略大于耳缘静脉,静脉壁略厚,为了更有利于观察FG的栓塞功能,本研究选择下肢浅静脉作为观察对象。虽然选择的静脉不同,与以往的实验研究结果[9-10]对比,FG、BLM复合注射后能够在更早期损伤静脉内皮细胞、破坏血管内膜。其可能的机制是:FG/BLM注射后BLM能够较长时间贮存于血管腔局部,逐渐释放并不断损伤血管内皮。尽管实验中对家兔静脉给予了血流阻断措施,但是阻断解除后管腔内的血液仍有流动性,因此单纯BLM注射后药物会有不同程度的流失,理论上讲,其作用于血管内皮的有效性会低于FG/BLM复合注射。
本研究通过观察FG/BLM对家兔下肢浅静脉的作用过程,从组织学的角度揭示了其破坏静脉并导致其纤维化的机制。由于家兔下肢浅静脉与人类VMs在解剖形态、血流动力学等方面有一定的差异,在后续研究中,课题组将进一步设计、构建与人类VMs更为接近的动物模型并展开相关研究。
