不同神经因子联合应用促进重型脑外伤大鼠神经细胞增殖
2021-04-27朱业淘
朱业淘 刘 阳△ 王 童 王 雪
1)西南医科大学临床医学院,四川 泸州646000 2)绵阳市第三人民医院(四川省精神卫生中心),四川 绵阳621000
重型创伤性颅脑外伤(severe traumatic brain injury, sTBI)是全球性的公共卫生问题,也是导致人类残疾和死亡的主要因素之一[1-2]。严重脑外伤后病理发展过程错综复杂,主要是伤后自由基生成、去极化和水肿形成以及血脑屏障破坏[3]等。重型颅脑外伤的病理生理学包括对组织的直接物理损伤和继发性损伤,其中原发性脑损害已经是不可逆转的,所以避免继发性脑损伤造成的二次脑损害成为研究的焦点。神经元是神经系统的基本构成单位,其稳态、存活可以通过神经系统另一大类细胞——神经胶质细胞得以维持[4],目前重型颅脑外伤后神经功能难以恢复,究其原因还是在于神经细胞受损后难以再生。神经因子是一类具有神经营养活性,可以滋养神经细胞并促进神经细胞存活和再生的生长因子[5]。目前已有部分研究证实了神经生长因子(nerve growth factor,NGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)具有促进神经细胞增生的作用[6-7]。神经生长因子是神经因子家族中的一员,已被多个研究证实其对神经细胞具有保护作用,同时在神经细胞的增殖、防止神经细胞凋亡方面起着重要的作用[8-9]。碱性成纤维细胞生长因子则是一类在中枢神经系统中高度表达的因子,已知其可以通过抑制过度自噬和抗神经细胞凋亡而对神经产生保护作用[10],同时碱性成纤维细胞生长因子还能够促进神经元的增殖从而保护受损的神经[11]。目前国内外对神经生长因子和碱性成纤维细胞生长因子在神经疾病方面的研究多集中在缺血性神经性疾病和功能性神经疾病,少见于颅脑外伤,且多见于对其中某一种因子的研究,而将二者联合应用来观察其对重型脑外伤后神经细胞增殖的促进作用更是罕见。本实验通过脑室途径给重型脑外伤大鼠注入NGF与bFGF,探索这两种神经因子联合应用对重型脑外伤大鼠神经细胞的影响。
1 材料与方法
1.1 主要试剂 神经生长因子(北京义翘神州科技有限公司),碱性成纤维细胞生长因子(北京博奥森生物技术有限公司),兔抗胶质纤维酸性蛋白(GFAP)抗体(Anti-GFAP)(Abcam 公司),兔抗神经元核抗原(NeuN)抗体(Anti-NeuN)(Abcam 公司),Alexa Flour山羊抗兔荧光二抗(Abcam公司)。
1.2 实验动物 48 只成年SD 大鼠,雌雄不限,由西南医科大学动物饲养中心提供,体质量250~300 g,随机分为治疗组A、B、C组和对照组D组,每组12只,每组再分为3 d、7 d、14 d 3个亚组,每个亚组4只[12]。
1.3 实验方法 脑外伤模型制备及神经因子注射分别建立NGF 注射组(A 组)、bFGF 注射组(B 组)、NGF+bFGF注射组(C组),对照组(D组)注射生理盐水,创伤性脑损伤模型的制作参考改良Feeney法[13],造模成功后经脑室内注入神经因子。A 组注入NGF 10 μL,B组注入bFGF 10 μL,联合组注入NGF及bFGF各5 μL,对照组注入生理盐水10 μL。
1.4 大鼠脑组织取材及免疫组化、免疫荧光染色在造模后的第3、7、14 天麻醉大鼠,采用多聚甲醛对大鼠灌注后进行断头取脑,将脑组织固定于多聚甲醛中24 h,将含有海马、侧脑室的组织块取出脱水、石蜡包埋后切片。免疫组化和免疫荧光:对大脑石蜡切片进行免疫组化和免疫荧光染色,方法参考Envision法,分别在光镜和荧光显微镜下计数损伤侧皮质、室管膜下区、海马以及对侧相对应部位的阳性细胞。
1.5 统计学方法 应用SPSS 17.0 软件进行数据分析,成组设计的两均数比较采用t 检验,多组间比较采用方差分析,计量数据以均数±标准差(±s)表示,组间比较采用LSD 检验,以P<0.05 为差异有统计学意义。
2 结果
免疫组化及免疫荧光结果显示,在不同时间点,大鼠脑损伤侧皮质、室管膜下区、海马区以及对侧相对应的区域,联合组以及单一注射组神经细胞、神经胶质细胞数量均显著多于对照组,差异有统计学意义(P<0.05);而单一因子组之间阳性细胞数量无显著差异(P>0.05)。见表1~3、图1~3。对于造模后不同时间点取材所检测到的相应部位阳性细胞也有差别,其中造模后第7 天各部位阳性细胞数量最多(图4),且损伤侧皮质、室管膜下区部位阳性细胞均多于损伤对侧相对应区域(图5)。
表1 各组大鼠损伤侧海马和对侧海马神经元数比较 (±s,n=4)Table 1 Comparison of neuron numbers between injured hippocampus and contralateral hippocampus of rats in each group (±s)
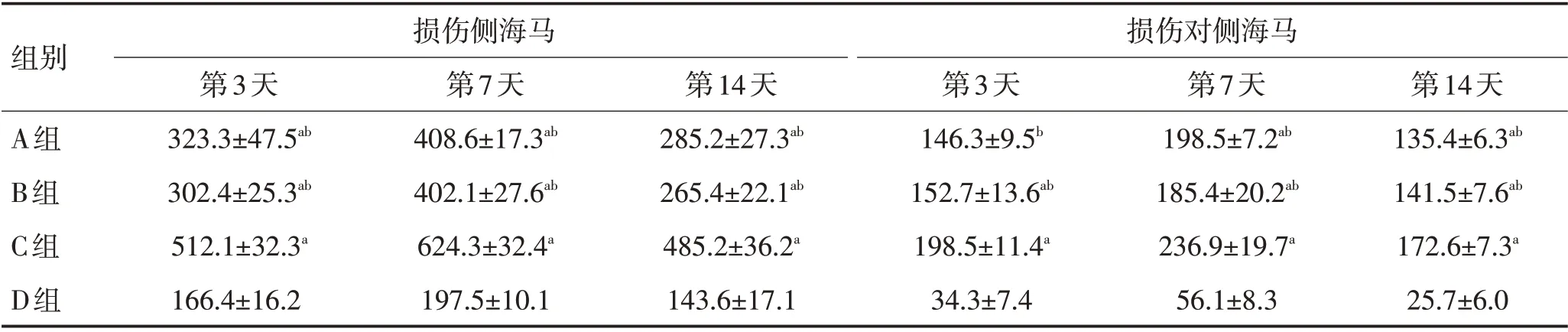
表1 各组大鼠损伤侧海马和对侧海马神经元数比较 (±s,n=4)Table 1 Comparison of neuron numbers between injured hippocampus and contralateral hippocampus of rats in each group (±s)
注:与D组比较,aP <0.05;与C组比较,bP <0.05
组别损伤侧海马损伤对侧海马A组B组C组D组第14天135.4±6.3ab 141.5±7.6ab 172.6±7.3a 25.7±6.0第3天323.3±47.5ab 302.4±25.3ab 512.1±32.3a 166.4±16.2第7天408.6±17.3ab 402.1±27.6ab 624.3±32.4a 197.5±10.1第14天285.2±27.3ab 265.4±22.1ab 485.2±36.2a 143.6±17.1第3天146.3±9.5b 152.7±13.6ab 198.5±11.4a 34.3±7.4第7天198.5±7.2ab 185.4±20.2ab 236.9±19.7a 56.1±8.3
表2 各组大鼠损伤侧皮质和对侧皮质神经胶质细胞数比较 (±s)Table 2 Comparison of glial cells in injured cortex and contralateral cortex of rats in each group (±s)
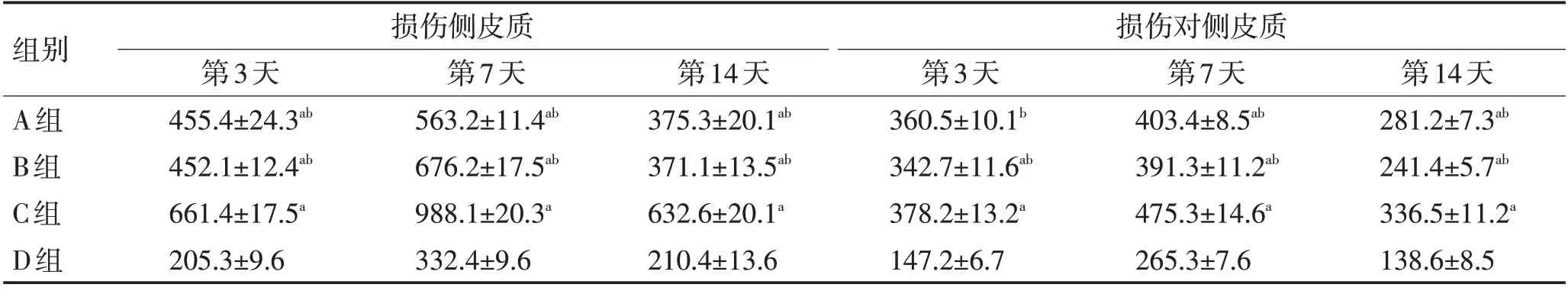
表2 各组大鼠损伤侧皮质和对侧皮质神经胶质细胞数比较 (±s)Table 2 Comparison of glial cells in injured cortex and contralateral cortex of rats in each group (±s)
注:与D组比较,aP <0.05;与C组比较,bP <0.05
组别A组B组C组D组损伤侧皮质损伤对侧皮质第3天455.4±24.3ab 452.1±12.4ab 661.4±17.5a 205.3±9.6第7天563.2±11.4ab 676.2±17.5ab 988.1±20.3a 332.4±9.6第14天375.3±20.1ab 371.1±13.5ab 632.6±20.1a 210.4±13.6第3天360.5±10.1b 342.7±11.6ab 378.2±13.2a 147.2±6.7第7天403.4±8.5ab 391.3±11.2ab 475.3±14.6a 265.3±7.6第14天281.2±7.3ab 241.4±5.7ab 336.5±11.2a 138.6±8.5
表3 各组大鼠损伤侧室管膜下区和对侧室管膜下区神经元数比较 (±s)Table 3 Comparison of the number of neurons in the injured subependymal area and contralateral subependymal area of rats in each group (±s)
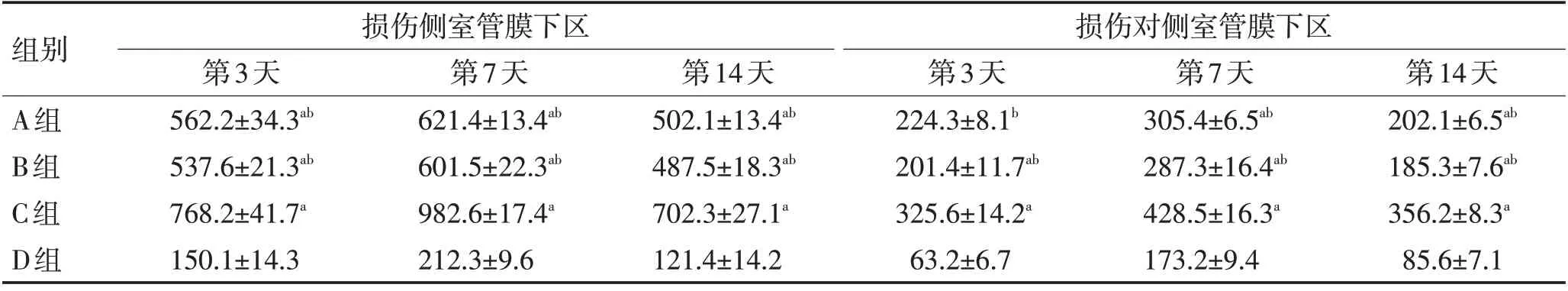
表3 各组大鼠损伤侧室管膜下区和对侧室管膜下区神经元数比较 (±s)Table 3 Comparison of the number of neurons in the injured subependymal area and contralateral subependymal area of rats in each group (±s)
注:与D组比较,aP <0.05;与C组比较,bP <0.05
组别A组B组C组D组损伤侧室管膜下区损伤对侧室管膜下区第3天562.2±34.3ab 537.6±21.3ab 768.2±41.7a 150.1±14.3第7天621.4±13.4ab 601.5±22.3ab 982.6±17.4a 212.3±9.6第14天502.1±13.4ab 487.5±18.3ab 702.3±27.1a 121.4±14.2第3天224.3±8.1b 201.4±11.7ab 325.6±14.2a 63.2±6.7第7天305.4±6.5ab 287.3±16.4ab 428.5±16.3a 173.2±9.4第14天202.1±6.5ab 185.3±7.6ab 356.2±8.3a 85.6±7.1

图1 造模7 d后联合组(D)损伤侧海马区域神经胶质细胞(箭头所示)广泛增殖,明显多于神经生长因子组(A)、碱性成纤维细胞生长因子组(B)和对照组(C)(×400)Figure 1 Seven days after modeling, glial cells (as shown by the arrow) in the hippocampus of the injured side in combination group (D) proliferated extensively, significantly more than those in nerve growth factor group (A), basic fibroblast growth factor group (B) and control group (C)(×400)
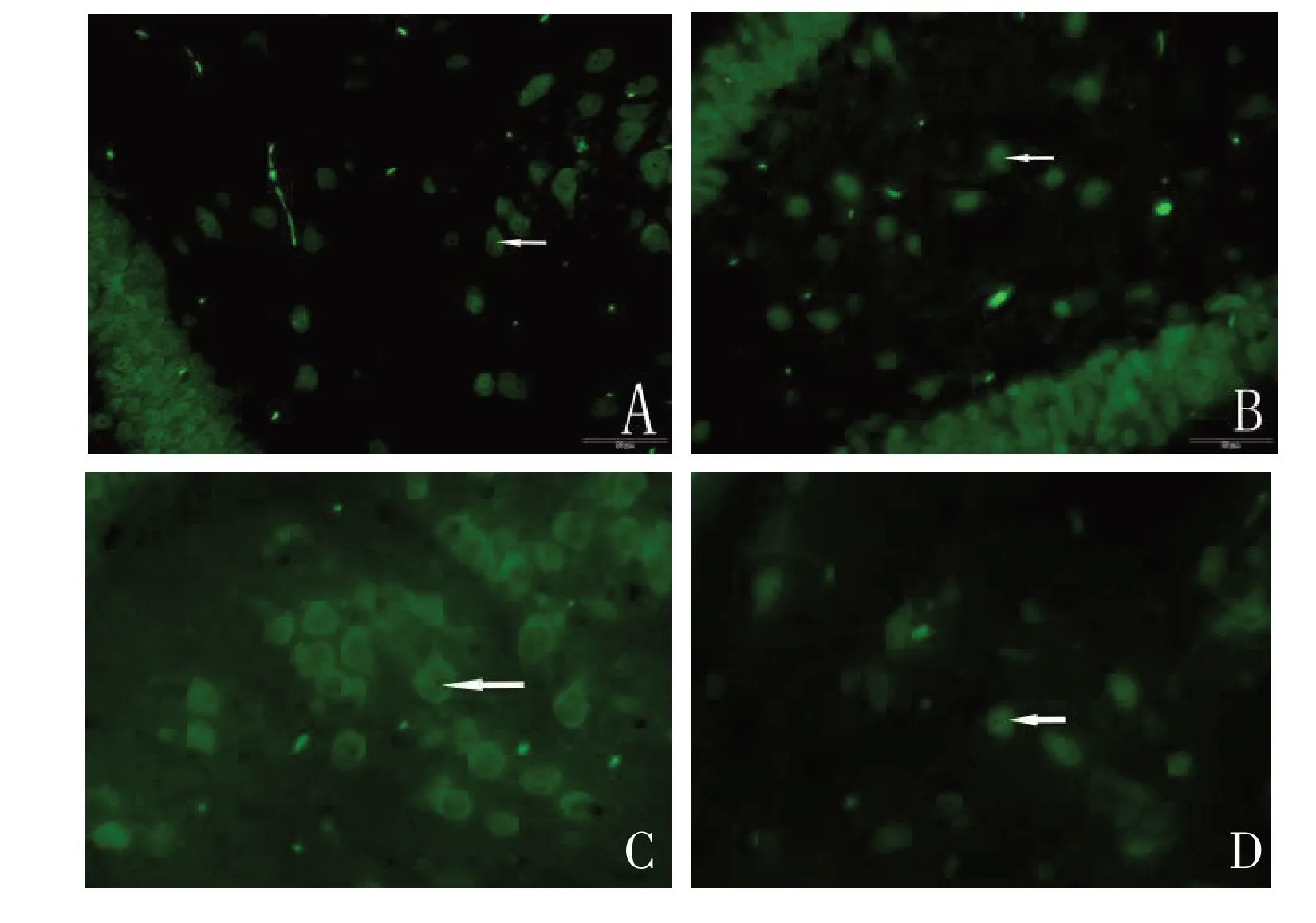
图2 联合组造模7 d后损伤侧海马区域神经元(箭头所示)增殖情况(C),明显较碱性成纤维细胞生长因子组(B)、神经生长因子组(A)及对照组(D)神经元数量多(×400)Figure 2 Seven days after modeling, the proliferation of neurons (as shown by the arrow) in the injured side hippocampus of rats in the combination group (C) was significantly higher than that in the basic fibroblast growth factor group (B), nerve growth factor group (A), and control group (D)(×400)
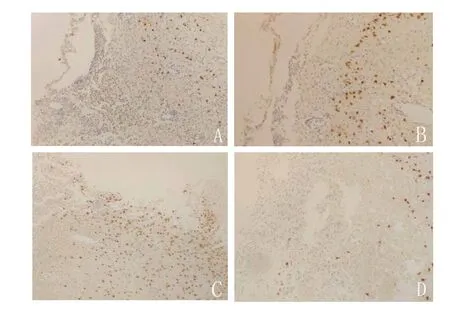
图3 免疫组化结果显示,联合组(C)在造模7 d后损伤侧皮质新增神经元数量明显多于神经生长因子组(A)、碱性成纤维细胞生长因子组(B)和对照组(D)(×200)Figure 3 Immunohistochemical results showed that the number of new neurons in the injured lateral cortex of combination group (C) was significantly more than that of nerve growth factor group (A), basic fibroblast growth factor injection group (B) and control group (D) seven days after modeling (×200)

图4 免疫组化显示联合组在造模后第7天(B)损伤侧皮质胶质细胞数量明显多于造模后第3天(A)和第14天(C)(×200)Figure 4 Immunohistochemistry showed that the number of glial cells in the damaged lateral cortex on day 7(B) after modeling in the combination group was significantly more than those on day 3(A) and 14(C) after modeling(×200)
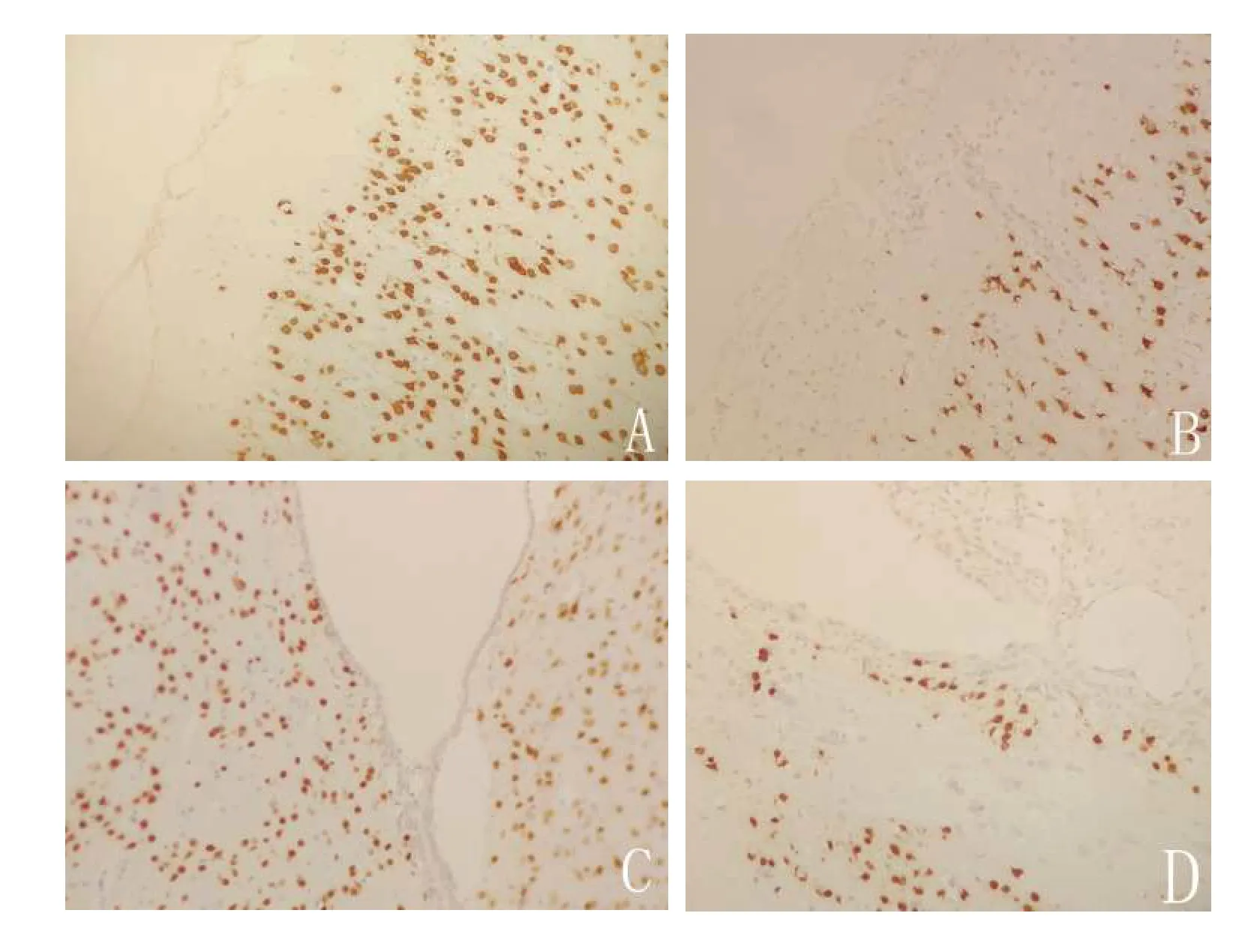
图5 免疫组化显示,联合组在造模7 d 后损伤侧皮质(A)与损伤侧室管膜下区(C)神经元数量明显多于损伤对侧皮质(B)及损伤对侧室管膜下区(D)(×200)Figure 5 Immunohistochemistry showed that the number of neurons in the damaged lateral cortex (A) and the damaged lateral ependymal region (C) was significantly more than that in the damaged contralateral cortex (B) and the damaged contralateral ependymal region (D)(×200)
3 讨论
目前世界上针对脑外伤的各种治疗方法效果均欠佳,究其原因还是在于神经细胞受损后难以再生。大脑中的海马齿状回颗粒层(hippocampal dentate gyrus,HDG)和室管膜下区(subventricular zone,SVZ)存在大量的神经细胞[14-15],神经细胞受损后凋亡,且再生极其困难,因此要达到修复神经的目的可以选择通过促进受损部位神经细胞的增殖进而促进神经功能的恢复,已有部分研究证实了神经营养因子可以防止神经细胞凋亡和促进其增殖[16-18]。因此,本次实验中使用了一些特殊的神经营养因子改变脑外伤后局部脑组织的微环境,以保护受损神经细胞和促进神经细胞增殖,达到脑外伤后神经修复的治疗目的。目前,一些研究证实了神经生长因子可以促进神经细胞的增殖,而碱性成纤维细胞生长因子也有同样的作用[10,19-21]。神经生长因子是神经营养因子中的一员,目前对于神经生长因子的研究已非常透彻,是一类可以营养神经元、调节神经突起生长的因子,研究表明神经生长因子可以保护神经元和促进神经纤维再生,从而使神经系统损伤得到一定程度的恢复[22],而神经生长因子也被证实可以改善脑外伤后大鼠的认知功能[23]。碱性成纤维细胞生长因子则具有保护神经、抵抗神经元凋亡作用[24-25],同时还能维持神经细胞和胶质细胞的存活,促进交感神经和副交感神经轴突的生长,促进受损神经的修复和神经突触的生长。碱性成纤维细胞生长因子可以在脑外伤后保护血脑屏障的完整性,减轻脑损伤,改善脑外伤后神经功能[26-27]。SUN 等[28]研究则证实通过脑室注射途径将碱性成纤维细胞生长因子注入创伤性脑损伤大鼠模型后,可以促进脑外伤后大鼠的认知恢复。由此可见,碱性成纤维细胞生长因子与神经生长因子对神经细胞的增殖作用是明确的,且能够促使脑损伤后神经功能得到一定的恢复。本次实验表明神经营养因子能够促进脑外伤后神经细胞的增殖,证实了将碱性成纤维细胞生长因子与神经生长因子联合应用能促进内源性神经细胞增殖,增殖数量明显高于对照组,且较单一注射组阳性细胞数量多,在不同时间点造模后检测出相应部位的阳性细胞数量也有明显差别,其中造模后第7 天各部位相应的阳性细胞数量明显多于造模后第3天和第14天。通过回顾相关文献得知,这种结果的可能原因在于重型脑外伤的急性期损伤部位局部微环境改变会释放大量兴奋性氨基酸、自由基以及一些炎性因子等,可能抑制神经因子作用,亦或抑制新生神经元的产生导致早期相应部位新生神经细胞较少;随着时间推移,在损伤后第7 天左右局部微环境的恢复以及自身一些神经营养因子的分泌达到高峰,新生细胞也在此时达到高峰,在损伤后第14 天自身分泌神经营养因子下降,瘢痕组织增生从而导致神经细胞数量有所下降[29]。本次实验还发现各组大鼠损伤侧相应部位的阳性细胞数量均多于损伤对侧相应部位,可能原因在于脑组织损伤刺激损伤部位自身神经营养因子的分泌,以防止局部神经细胞凋亡及促进新生神经细胞的增殖[30-36]。本次实验不足之处在于运用的免疫组化与免疫荧光单标仅从侧面反映神经细胞的增殖与表达情况,具体二者联合运用对于内源性神经细胞的作用机制并未得到阐明,同时二者联用是否增强了内源性神经干细胞的增殖和分化还需进一步研究以明确。
外源性神经生长因子联合碱性成纤维细胞生长因子可以使重型脑外伤大鼠内源性神经细胞增殖,且二者联合运用效果最为显著,这也为运用神经营养因子改善脑外伤后神经功能的恢复提供了重要参考。
作者贡献:实验设计为刘阳,实验实施为朱业淘、王童、王雪,实验评估为朱业淘、王童,资料收集为朱业淘、王雪
经费支持:该研究接受了“绵阳市卫计委资助项目(201801、201901)、绵阳市第三人民医院重点培育项目(201905、202003)”的资助,所有作者声明经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道
利益冲突:文章的全部作者声明,在课题研究和文章撰写过程中不存在利益冲突
机构伦理问题:实验方案经西南医科大学动物实验伦理委员会批准,实验过程遵循了国际兽医学、编辑协会《关于动物伦理与福利的作者指南共识》和本地及国家法规
