非洲马瘟在东南亚的暴发及其对云南马属动物的威胁
2021-04-27朱建波董国栋杨振兴肖雷
朱建波, 董国栋, 杨振兴, 肖雷
(1.云南省畜牧兽医科学院云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224;2.云南省动物疫病预防控制中心,云南 昆明 650201)
非洲马瘟(African Horse Sickness,AHS)是由非洲马瘟病毒(AfricanHorseSicknessVirus,AHSV)引起的一种严重危害马、骡和驴等马属动物的非接触性烈性传染病,以发热、头部皮下水肿和病毒血症为特征,世界动物卫生组织(OIE)《陆生动物法典》将其列为必须报告的动物疫病,我国将其列为一类动物疫病[1,2]。AHS 是目前已知的对马危害最大的传染病,马感染AHSV后的死亡率为 50%~95%;骡和驴对AHSV易感,通常骡感染后的死亡率约为 50%,驴的死亡率为10%;斑马对 AHSV的抵抗力很强,除发热外无其他临诊症状,但可能长期处于病毒血症状态。AHSV只能通过媒介昆虫库蠓叮咬才能传播[3-5]。
2020年2月泰国发生AHS,这在东南亚国家是有史以来首例,也是时隔60年后,亚洲再次发生AHS[6,7]。云南省邻近泰国,靠近泰国的西双版纳、普洱、临沧和德宏等州市具有与泰国一样的潮湿温暖的生态环境,库蠓种类多、数量大,AHSV传入云南的风险极高。从事动物疫病管理、监测、检验检疫、科学研究与诊疗以及马属动物的饲养、屠宰、经营、运输等活动的单位和个人需对该病给予高度关注。
1 非洲马瘟病毒特征
AHSV与蓝舌病病毒(BluetongueVirus, BTV)、流行性出血热病毒(EpizooticHemorrhagicDiseaseVirus, EHDV)和马脑病病毒(EquineEncephalosisVirus,EEV)等同属呼肠孤病毒科(Reoviridae) 环状病毒属(orbivirus)成员,它们均是通过库蠓进行传播的虫媒病毒[1,2]。AHSV与BTV及EHDV具有相似的形态和生化特性,但病理、抗原性及宿主范围完全不同。采用病毒中和试验可将目前已知的AHSV分为 9个血清型,其中1型与2型、3型与7 型、5型与8型、6型与9型毒株之间存在一定的血清交叉中和反应,AHSV与BTV及EHDV等其他已知的环状病毒均无交叉反应[1,5]。
AHSV 颗粒无囊膜,大小约80 nm。病毒基因组由 10 个双链 RNA 节段组成,编码 7 种结构蛋白(VP1-7)和 4 种非结构蛋白(NS1、NS2、NS3 和 NS3A)。病毒结构蛋白构成内外两层衣壳,其中,VP2 和 VP5 构成外衣壳,是AHSV中和抗体的主要靶标;VP3和VP7构成内衣壳,VP7在不同血清型间较保守,是主要的群特异性抗原蛋白。VP1、VP4和VP6组成转录复合体,直接结合在VP3蛋白层下,与病毒RNA一起组成核芯[1,3,8]。
AHSV在pH 6.0~12.0的条件下都可存活,最适pH为7.0~8.5, pH低于6.0时易失活,低于3.0 则迅速失活[4,5]。病毒颗粒热稳定性相对较好,尤其是有其他蛋白质存在的情况下,加有柠檬酸盐的血浆中AHSV在55~75℃加热10min后仍具有感染力[5]。在有稳定剂(如血清、甘油加草酸钠和苯酚液等)的情况下,病毒可长期保持感染性。4 ℃条件下,在含10%血清的盐溶液中可保存6个月以上,在加有甘油草酸钠苯酚液的血液中保存20年以上仍有感染性。但在-30~-20 ℃则相当不稳定,易失活。病毒在腐败的血液中保存2年以上还可保持感染,但在肌肉等组织中则会随着pH值降低而失活。AHSV对乙酸(2%)、次氯酸钠(3%)和Virkon(1%)等消毒剂敏感,对乙醚、氯仿等脂质溶剂不敏感。福尔马林、β丙内酯和二乙烯亚胺可用于病毒灭活[4-6]。
2 流行病学特征
据史料记载,最早的AHS类似病例出现在1327年阿拉伯半岛上的也门,1569年在东非发现的病马是最早的确诊病例,1719年在南非好望角AHS的暴发导致约1700匹马死亡[1,3,6]。1932年,从采集自南非濒死病马的样品中首次分离获得AHSV。AHS 在撒哈拉以南非洲地区呈地方性流行,偶尔也在非洲北部(1965年和1989—1990年)、中东(1959—1961年)、欧洲(西班牙,1966年和1987—1990年;葡萄牙,1989年)发生[1,3,6]。
在亚洲,历史上也发生过多起AHS。1930年也门发生AHS疫情, 1944年巴基斯坦、叙利亚、黎巴嫩和约旦等国又有发生。1959年在伊朗发生由AHSV-9型毒株引发的疫情,随后于1960年蔓延到伊拉克、叙利亚、黎巴嫩、约旦、土耳其、阿富汗、巴基斯坦和印度等国,导致大量马匹死亡。1959—1963 年,中东和西南亚的AHS疫情导致三十多万匹马死亡[1,3]。
2020 年 3月27日,泰国向 OIE 报告该国首次发生AHS疫情[7]。仅2020年2—3月,在泰国呵叻府(Nakhon Ratchasima)、班武里府(Prachuap Khiri Khan)、春武里府(Chon Buri)和叻丕府(Ratchaburi)就发生5起AHS,导致196匹马病死。这是AHS首次在东南亚被确诊[7]。5月14日,泰国畜牧发展局(Department of Livestock Development,DLD)将18份马血液或血清样品送至西班牙马德里中央兽医实验室进行检测,结果所有样品均为AHSV-1型阳性[8]。到2020年12月底,已在泰国的17个府发生AHS疫情[7]。泰国国家动物卫生研究所(National Institute of Animal Health,NIAH)对采自这些疫点的样品进行分析,结果表明,此次的疫病流行都是由同一个AHSV-1型毒株引发,该毒株与源自南非(2004年,2006年)的毒株高度同源[8]。有记录显示,泰国分别于2019年7月、2020年1月和3月从南非进口过斑马[7]。此次泰国非洲马瘟的暴发可能与进口斑马相关。为控制疫情,泰国兽医相关机构采取了包括扑杀、控制马属动物流动、区域化管理、弱毒疫苗接种、消毒、检疫、控制媒介昆虫等在内的一系列措施[7]。
2020 年9月2日,马来西亚农业和农业基础产业部兽医服务局向OIE报告该国登嘉楼州发生一起非洲马瘟疫情,有5匹马被确诊感染后已扑杀。在12月28日该国向OIE提交的后续报告中称,未发现新的疫情,AHSV的血清型待定[9]。
泰国和马来西亚2020年的AHS疫情是该病时隔60年后再次在亚洲发生,也是该病首次出现在东南亚国家。与我国云南接壤的周边国家AHSV的流行情况尚不清楚,2018 年,OIE暂停了对缅甸无非洲马瘟区状态的认可,老挝和越南流行情况不明朗。
非洲马瘟不属于人畜共患病,目前没有任何人类感染AHSV野毒株的报道,也没有人通过接触自然或试验感染动物、实验操作AHSV而被感染的证据。
犬感染AHSV后可出现急性呼吸窘迫综合征或猝死,死亡率很高。犬可能在AHSV的传播中起一定作用。历史上将犬感染AHSV皆归因于食用受感染的马肉,但最近的证据显示可能也存在媒介昆虫叮咬犬而发生的传播[4,6]。在骆驼、非洲象和犀牛的血清样品中也发现了AHSV抗体,但目前认为这些动物在AHSV的流行中意义不大[5]。
3 临床症状
马属动物感染AHSV后的临床表现差异明显,按病程长短、症状和病变部位的不同,通常将AHS的临床症状划分为肺型、心型、 混合型和发热型。
肺型:潜伏期3~5d,以严重的呼吸困难及渐进性呼吸道症状为典型特征。初期仅表现急性发热,持续1~2d,体温可高达 40~41 ℃;随后出现呼吸窘迫,头颈伸展,大量出汗;最后可见咳嗽,有泡沫样液体从鼻孔流出,通常在出现这些症状后数小时内就窒息而死。感染强毒株的马群死亡率可超过95%[1,3,5]。
心型:潜伏期7~14d,以眶上窝肿胀为典型特征。初期体温升高,达39~41 ℃,持续3~6d,随后先在眶上窝、眼睑和颞部出现皮下水肿,再后头的其他部位及颈部水肿,有时向下延伸到胸部。眼结膜可见肿胀和瘀斑,还可能发生由于食道麻痹导致的吸入性肺炎,如出现舌下出血则预后不良。死亡率约为 50%[1,3,5]。
混合型:兼具肺型和心型两种形式的特征,常表现为急性。潜伏期多为5~7d,主要表现可分为两种,一种是肺部先出现轻微症状,然后头部和颈部出现水肿,最后心力衰竭而死;另一种是头颈部先出现水肿,然后突然因呼吸困难而亡。死亡率可达到70%[1,3,5]。
发热型:是一种经常被忽视的轻度疾病形式。潜伏期为 5~14d,可表现为弛张型发热,清晨体温较低,下午体温升高;可出现眼结膜轻微充血、厌食、脉搏加快或精神沉郁等一些轻微症状。主要发生在对AHSV有抵抗力的斑马和非洲驴身上[1,3,5]。
感染AHSV后动物的发病率和死亡率随畜种、免疫状态和临床表现形式的不同而不同。马最易感染,且主要表现出混合型和肺型症状,死亡率常在50%~95%;骡的死亡率常在50%左右;欧洲和亚洲驴的死亡率为5%~10%;非洲驴和斑马死亡率非常低。病愈后的动物对同一血清型AHSV毒株的攻击有良好的免疫力,对其他血清型毒株的攻击也有部分免疫力[1,3-5]。
AHS的一些临诊症状和病理变化很典型,如患心型AHS的马匹经常出现眶上窝肿胀,结合相应的流行病学特征就足以做出临时诊断。然而其他一些症状和病变的特异性不强,容易与炭疽、马病毒性动脉炎、马传染性贫血、马脑病、锥虫病、焦虫病、亨德拉病毒病或紫癜性出血病等相混淆,需进行实验室诊断才能确诊或排除。
4 实验室诊断技术
OIE 《陆生动物诊断试验与疫苗手册》(2018)推荐的用于AHSV 诊断的实验室方法可分为病原鉴定和血清学检测两大类。病原鉴定方法包括荧光定量RT-PCR、普通凝胶RT-PCR和病毒分离鉴定3种。血清学检测方法包含酶联免疫吸附试验(ELISA)、补体结合试验(CFT)和中和试验(VN)3种。
为提高诊断结果的可靠性,最好采用一种以上的试验方法来对样品进行检测,特别是对于首发病例更应如此。首先可采用ELISA或RT-PCR等方法进行快速检测,随后再对阳性带毒样品进行分离病毒。可采用病毒中和试验、型特异性RT-PCR或核酸序列分析来进行病毒血清型的鉴定,以便据此选择正确的疫苗毒株。
对于AHS的实验室诊断来说,采集合适的样品并将其安全送至实验室十分重要。从发热的动物体内采集抗凝血,或从病死动物采集脾脏、肺和淋巴结小块(2~4 g),都是进行诊断试验首选的样本,样品最好置于4 ℃暂存或运输,并尽快送到实验室进行检测。血清尽可能保持新鲜无菌少溶血,-20 ℃保存或运输。
5 疫苗免疫
马、骡和驴免疫接种用的单价或多价弱毒疫苗已在国际上应用很多年,早已商品化。目前,国外常用的弱毒疫苗主要有两种,一种是由AHSV-1、3和4型弱毒株组成的三价苗,另一种是由AHSV-2、6、7和8型弱毒株组成的四价苗[1,3,6]。
1987—1991年在西班牙和葡萄牙AHS流行期间,AHSV-4型毒株灭活疫苗曾商业化生产并大量应用,且被证明有效。但由于生产灭活疫苗需大规模培养AHSV,生产成本高,而且存在泄毒隐患,已停产[8]。
杆状病毒表达的衣壳蛋白VP2、VP5和VP7亚单位疫苗,病毒样颗粒疫苗(VLPs),痘病毒载体疫苗,DNA疫苗,反向遗传活病毒疫苗等AHSV基因工程重组疫苗均有大量的研究报道,但目前都还处于研究阶段,没有一种获批进入市场[8]。
6 预防控制措施
非洲马瘟在我国被列为一类动物疫病,不允许治疗,且目前无有效的治疗手段。故防控 AHS 的首要目标是采取一切措施防止AHSV传入我国。如不幸传入AHSV,则要尽早发现可疑病例并进行隔离,及时采集合适的样品送农业农村部指定的实验室进行确诊。一旦疫情被确诊,必须立刻按照《中华人民共和国动物防疫法》的相关规定采取紧急、强制性的控制和扑灭措施,这些措施包括封锁疫区,禁止马属动物流动;扑杀被感染动物,并对病死动物和被扑杀的动物进行无害化处理;喷洒杀虫剂杀灭饲养环境中的库蠓等吸血昆虫,消除其孳生地;隔离饲养同群未染疫马属动物,隔离厩舍,严密防范库蠓等吸血昆虫进入;在动物体表喷洒驱虫剂,在库蠓活跃的黄昏至黎明时段严禁动物出厩舍活动;对被病畜污染的环境进行彻底消毒等。
我国目前属于无非洲马瘟国家,因此,在得到国家兽医行政管理部门授权之前,任何单位或个人均不得擅自接种非洲马瘟疫苗。违规使用疫苗将不可避免导致我国在OIE无非洲马瘟国家状态的丧失,从而造成巨大损失。
7 AHSV传入云南的风险分析
泰国的气候常年炎热潮湿,缺乏寒冷的冬季,库蠓常年活动,有可能导致AHSV在泰国持续传播,继而传播到其周边国家,马来西亚的疫情可能就是由泰国毒株传入导致。从1959—1963年AHSV在中东和西南亚国家的传播来看,该病很难在短期内得到有效控制,极易跨境传播。AHSV在西班牙和葡萄牙的流行再次证明了这点。1987年在西班牙中部发生AHS,接下来很快传到该国南部,尽管西班牙和邻国葡萄牙采取了所有可能的控制措施,但AHSV还是在1989年跨境传播到了葡萄牙。
与泰国接壤的老挝、缅甸,以及云南省靠近泰国的西双版纳、普洱、临沧和德宏等州市具有与泰国一样的潮湿温暖的生态环境,库蠓种类多、数量大,BTV和EHDV的虫媒病毒血清型众多且常年都有活动,表明该地区吸血库蠓种类丰富、活动频繁。AHSV一旦跨境传入这些地区,将很难控制和根除。
云南省目前仍有四十多万匹马、骡和驴,2016—2018年马属动物的年底存栏量见表1。此外在动物园还有少量的斑马供观赏。2020年对采自云南8个边境州市48个县(市、区)的马属动物样品4197份进行了检测,其中,RT-PCR检测3277份,AHSV核酸均为阴性;ELISA检测血清920份,AHSV抗体均为阴性。这一结果显示AHSV可能尚未传入云南。
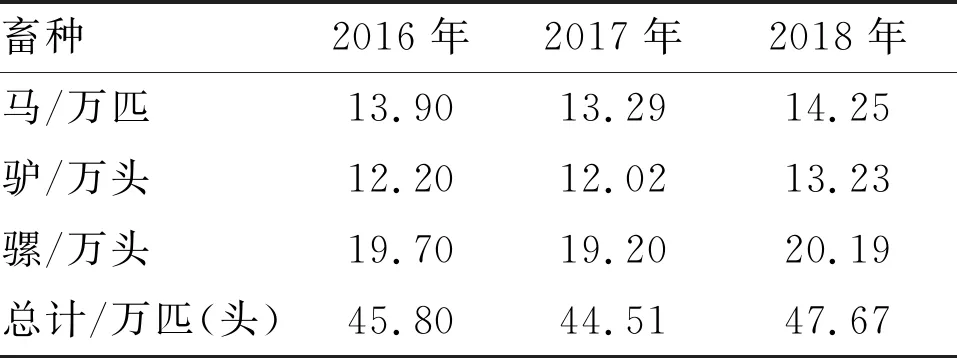
表1 2016—2018年云南省马属动物年底存栏量
我国历史上从未发生过AHS,本地的马、骡和驴对AHSV均无免疫力。AHS已出现在与缅甸和老挝接壤的泰国一些府,这两国兽医力量薄弱,对跨境动物疫病的防控能力不强,AHSV极有可能传入这两国,随后经这两国再传入云南的风险极大。若AHSV传入云南,无论是强毒株还是疫苗用弱毒株传入,都将可能对云南省甚至我国的马、骡和驴养殖业造成巨大损失,继而影响休闲骑乘、马术和赛马等相关产业。
8 云南应采取的应对措施
考虑到云南面临AHSV从周边东南亚国家跨境传入的巨大风险,兽医相关管理、技术部门和研究机构以及马属动物养殖、经营等相关从业人员应未雨绸缪,积极做好预防控制AHSV的各项措施,以应对可能出现的挑战。可视情况采取以下措施。
8.1 加强边境动物疫病防控
动物检疫和疫病防控相关部门要高度警惕AHSV境外传入风险, 密切关注泰国、老挝、缅甸和越南等国的疫情动向,做好AHS疫情预警、边境地区疫病防控、禁止或限制这些国家马属动物的入境、野生马属动物巡查等工作,严防AHSV传入。
8.2 加强AHSV监测
根据泰国当前已在其国内大范围使用弱毒疫苗控制AHS疫情的实际情况,制定适合云南省科学合理的AHSV监测方案,在边境地区长期持续地抽样采集马属动物抗凝血和血清以及库蠓,使用RT-PCR或ELISA方法进行抗原、抗体检测。对检测到的阳性样品立即送农业农村部指定的实验室进行病毒分离鉴定、核酸序列分析或中和试验,鉴别是疫苗弱毒株还是强毒株传入,以便国家兽医主管部门及早采取有针对性的措施。
8.3 加强马属动物饲养和流动管理
马属动物饲养者应强化防疫隔离带、隔离围墙等设施建设,规范马厩建设,设置防库蠓装置,在库蠓活跃的黄昏至黎明时段减少动物外出活动,采取驱虫措施,使用化学药剂彻底灭杀饲养场所的库蠓成虫和幼虫,消灭其孳生地。每日观察动物健康状况,发现发病或疑似染病的动物,立即将其转入封闭隔离舍,限制同群马属动物移动,并及时按规定向当地畜牧兽医部门报告[10]。
兽医管理机构要根据周边国家AHS疫情发展动态,结合云南省各地马属动物分布、库蠓活动及近年来BTV和EHDV活动等情况,确定云南省各地AHSV传播风险等级,有效管理马属动物在不同等级地区之间的移动。
8.4 加强AHS防控知识和技术的宣传与培训
采取多种形式加大AHS防控知识的宣传普及力度,提高全社会对防控AHS的认识。 提升马属动物养殖、经营等相关从业人员防范AHSV传播的认识,提升兽医相关人员对AHS早期识别、及时报告及快速处置等能力。
8.5 加强AHS防控技术研究
相关动物疫病防控机构、科研院所及高校要加强AHS诊断检测、监测、流行病学、病原特性、动物流动控制和媒介控制等技术研究,做好技术储备。要根据周边国家疫情发展动态,制定适合省情的科学合理的AHS防控预案。
8.6 加强动物疫病防控国际合作
加强与周边东南亚国家在跨境动物疫病,特别是AHS防控方面的合作,及时掌握国外疫情信息,分享相关的预防和控制经验。与OIE AHS参考实验室、国际上知名的AHS研究机构开展AHS防控技术国际合作研究。
8.7 开展媒介控制
应在AHSV传入中高风险地区实施蚊蠓控制计划,调查库蠓分布,采取有效消杀库蠓的控制措施。在马属动物饲养场所及其周围环境可用杀螟硫磷、马拉硫磷或溴氰菊酯等杀虫剂喷洒杀灭成虫,在蚊蠓等幼虫的孳生场所可使用吡丙醚颗粒剂处理,也可用溴氰菊酯、顺式氯氰菊酯等杀虫剂喷洒杀灭幼虫[4]。
8.8 做好应急人员、物质的准备
建立完善的 AHS 监测体系和应急队伍,一旦发现马属动物出现 AHS临床症状或大量发病死亡等情况,能进行快速反应、及时处置,防止疫情扩散。加强州(市)级实验室对AHSV的检测能力建设,做好疫情处置相关物资的储备。
9 结语
非洲马瘟是马类疾病中致死率最高的一种疾病,近年来,随着全球一体化进程加快,疫病流行范围急剧扩大。随着AHS 2020年在泰国和马来西亚的暴发, AHSV经由邻近国家传入云南省的风险越来越大。兽医管理和技术人员及马属动物相关从业人员要对该病加以重视,提高防控意识。要针对 AHSV 流行病学以及病原学特征与周边国家加强联防联控,努力将疫病拒之于境外。 如一旦传入,要尽可能做到早发现、早报告、早隔离和早处置,减少云南省马属动物养殖业和休闲骑乘、马术和赛马等相关产业可能遭受的损失,防止因AHSV传入内地而造成更大损失。
