基于PPAR-α/TFEB 通路的大豆苷抑制高糖诱导的肾小球系膜增殖作用机制
2021-04-27谢治深王梦瑶吴丽敏孙宁李真珍张振强
谢治深 王梦瑶 吴丽敏 孙宁 李真珍 张振强*
1.河南中医药大学中医药科学院,郑州 450046;2.郑州大学第一附属医院医学研究中心,郑州450000
糖尿病肾脏疾病(Diabetic kidney disease,DKD)是糖尿病主要并发症之一[1],已成为引发终末期肾脏病发病和死亡的首要原因[2]。DKD 又被称为肾小球硬化症,主要病理表现为肾脏体积增大、肾小球硬化和间质纤维化,与肾小球和肾小管基底膜增厚、系膜细胞增殖、系膜扩张伴细胞外基质积聚密切相关[3-4]。转录因子 EB (Transcription Factor EB,TFEB)是调节溶酶体和自噬的关键转录因子,受到核受体转录因子过氧化物酶体增殖剂激活受体-α(Peroxisome proliferators-activated receptors-α,PPARα)的调控[5-6],大量研究[7]表明高糖诱导系膜溶酶体自噬系统被抑制,激活PPAR-α/TFEB 改善系膜增生和基质增多是缓解DKD 的关键所在[8-9]。大豆苷是大豆中的主要成分之一,前期有文献[10]报道能够改善DKD 病理损伤。本研究重点探讨大豆苷对高糖(High glucose,HG)条件下肾小球系膜增殖的影响,采用PPAR-α、TFEB 荧光素酶报告基因系统评估大豆苷的活性,Docking 模拟与PPAR-α 配体结合区(PPAR-α-LBD)结合情况,测定下游靶基因,探讨相应作用机制。
1 材料方法
1.1 仪器
Series ⅡWater Jackxet 型CO2细胞培养箱(美国Thermo Fisher Scientific 公司);SW-CJ-ZF 型超净工作台(苏州苏洁净化设备有限公司);Eclipset S100 型倒置显微镜(日本Nikon 公司);荧光倒置显微镜(北京元中锐科集成检测有限公司);Multiskan GO 型酶标仪(美国Thermo Fisher Scientific 公司);7500 Fast 型实时荧光定量聚合酶链式反应(PCR)仪(美国ABI 公司)。
1.2 实验试剂
大豆苷(Daidzin,成都普菲德生物技术有限公司,批号552669,纯度≥98%);丙酮酸钠(国药集团化学试剂有限公司,批号20190606,纯度≥99%);葡萄糖;四甲基偶氮唑蓝(MTT)、青-链霉素双抗、胰蛋白酶、HEPES、Trizol(北京索莱宝科技有限公司,批号分别为 725C056、P1400、T1320、H1090、20201016);胎牛血清(FBS)、F-12K 培养基、DMEM无糖培养基(美国 Gibco 公司,批号分别为2114598P、21127022、11966025);DMEM 高糖培养基(美国Corning 公司,批号10013CVR);PolyJetTMDNA 体外转染试剂(美国SignaGen 公司,批号SL100688),BeyoRTMⅢcDNA 第一链合成试剂盒(上海碧云天生物技术有限公司,批号分别为103118190503);Power UpTMSYBRTMGreen PCR Master Mix 试剂盒(美国Thermo Fisher Scientific 公司,批号00837276)。
1.3 细胞系
小鼠肾小球系膜细胞SV40MES13、人胚胎肾细胞HEK293,购自中科院细胞库。
1.4 细胞相对增殖活力检测
采用MTT 法检测细胞增殖情况,取对数生长期的SV40MES13 细胞,以0.5×104个/孔接种于96 孔板中,培养24 h 后,更换为含0.5%(v/v) FBS、1%(v/v)青-链霉素双抗、14 mmol/L HEPES 的DMEM高糖/F12K 培养基(DMEM 高糖、F12K 配比=2 ∶1)的进行饥饿处理24 h,将细胞分为正常糖组(Normal glucose,NG,5.6 mmol/L 葡萄糖+19.4 mmol/L 甘露醇)、高糖组(HG,25 mmol/L 葡萄糖)、HG+5、10、20 μmol/L 大豆苷组,孵育48 h 后,加入20 μL MTT溶液(5 mg/mL),继续培养4 h,弃去培养基,每孔加入DMSO 150 μL,振摇10 min,使用全波长酶标仪于490 nm 波长处测定各孔的光密度(OD)值,并计算细胞的相对增加活力。相对增殖活力=(试验组OD值-空白对照组OD 值)/空白对照组OD 值。
1.5 q-PCR 法检测基因表达量
使用Trizol 法提取细胞总mRNA,并参照BeyoRTMⅢcDNA 试剂盒将mRNA 逆转录为cDNA,使用SYBRTMGreen PCR Master Mix 试剂盒以实时荧光定量PCR 分析,反应体系为10 μL,其中cDNA 4 μL,SYBR Green Mix 试剂5 μL,上、下游引物各0.5 μL(序列见表1)。反应条件:50 ℃加热2 min,95℃预变性2 min;95 ℃变性15 s,60 ℃退火1 min,72 ℃延伸30 s。共40 个循环。以18SRNA 为内参基因,采用2-ΔΔCt法分析目标基因mRNA 的相对表达量。

表1 PCR 引物序列
1.6 荧光素酶报告基因检测PPAR-α 和TFEB 的转录活性
取对数生长期的HEK293T 细胞,接种于96 孔板中,待细胞铺板融合度超过80%时,使用PolyJetTMDNA 体外转染试剂瞬时转染PPAR-α 或TFEB 荧光素酶报告基因质粒,6 h 后更换DMEM 高糖培养基,继续培养。24 h 后给药处理,培养18 h 后,弃去培养基,采用荧光素酶报告基因试剂盒测定,计算相对荧光素酶活力。
1.7 PPAR-α-LBD 与大豆苷的分子对接
采用Chem2D Ultra 8.0 及Chem3D Ultra 8.0 软件绘制大豆苷分子结构作为配体,从蛋白质结构数据(https://www.rcsb.org)中获取PPAR-α 蛋白配体结合域“PDB”文件作为受体(PDB:2REW)。利用Autodock Vina 进行分子对接,并使用PyMOL 2.3.0及Discovery Studio 2016 Client 软件进行可视化处理,模拟PPAR-α-LBD 与大豆苷的相互作用。
1.8 数据处理与分析
采用GraphPad Prism 6.0 软件对数据进行统计分析。所有数据均以表示,组间比较采用单因素方差分析(Oneway ANOVA)。P<0.05 为差异有统计学意义。
2 结果
1.1 大豆苷抑制高糖诱导的肾小球系膜细胞增殖
肾小球系膜细胞增殖是DKD 发病的重要因素。我们采用MTT 法检测了大豆苷对肾小球系膜细胞增殖的影响,见图1,结果与文献报道一致。与正常组相比,高糖刺激下肾小球系膜细胞增殖率明显增加(P<0.001);与高糖组比较,除5 μmol/L 大豆苷组外,10、20 μmol/L 大豆苷组可显著降低高糖情况下肾小球系膜细胞的增殖率(P<0.05 或P<0.001)。
2.2 大豆苷抑制高糖诱导的TGF-β1 和collagen Ⅳ的mRNA 表达
TGF-β1 调节细胞生长和分化,collagen Ⅳ是肾小球基膜的主要成分之一,两者是系膜扩张伴细胞外基质积聚的主要成分。与空白组相比,在高糖的诱导下,TGF-β1 和collagen Ⅳ的mRNA 表达量均显著增加(P<0.001);与高糖组相比,而给药不同浓度大豆苷后,TGF-β1 和collagen ⅣmRNA 表达量均显著下降(P<0.05)。见图2。
2.3 大豆苷增加PPAR-α 和TFEB 转录活性
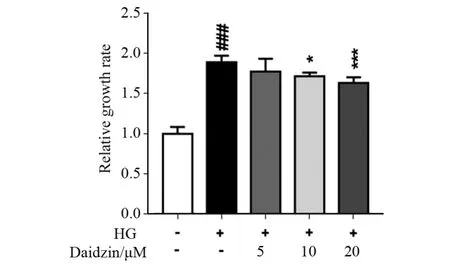
图1 大豆苷对肾小球系膜细胞增殖率的影响
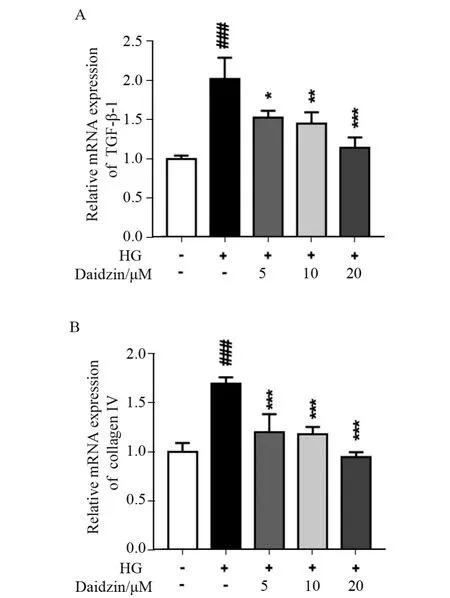
图2 大豆苷对肾小球系膜细胞的TGF-β1 和collagen Ⅳ的mRNA 表达量影响
接下来,我们初步探讨了大豆苷抑制高糖诱导的肾小球系膜细胞增殖的可能机制,采用荧光素酶报告基因法评估了大豆苷对PPAR-α 和TFEB 转录活性的影响。结果表明:Gemfibrozil(阳性药)组和5、10、20 μmol/L 大豆苷组显著增加了PPAR-α 的转录活性(P<0.05 或P<0.001),见图3A;除5 μmol/L 大豆苷组外,阳性药组和10、20 μmol/L 大豆苷组均明显增强TFEB 的转录活性(P<0.05),见图3B;在PPAR-α 阻断剂GW6471 的存在下,大豆苷促进TFEB 的转录活性几乎被完全逆转(P<0.001),见图3C。

图3 大豆苷促进PPAR-α 和TFEB 转录活性
2.4 大豆苷促进TFEB 和LIMP2 mRNA 的表达量
为了进一步确定大豆苷激活了PPAR-α/TFEB通路,我们检测了PPAR-α 的靶基因的TFEB 的mRNA 表达量,HG 刺激下TFEB 表达量显著降低(P<0.001),而大豆苷5、10、20 μmol/L 的作用下TFEB mRNA 的表达量有所增加(P<0.01 或P<0.001),见图4A;LIMP2 是TFEB 的靶基因也是溶酶体生成的关键基因,在高糖HG 刺激下LIMP2 mRNA 的表达量显著降低(P<0.01),同样的20 μmol/L大豆苷能够有效逆转高糖诱导LIMP2 mRNA 的表达量降低(P<0.01),见图4B。
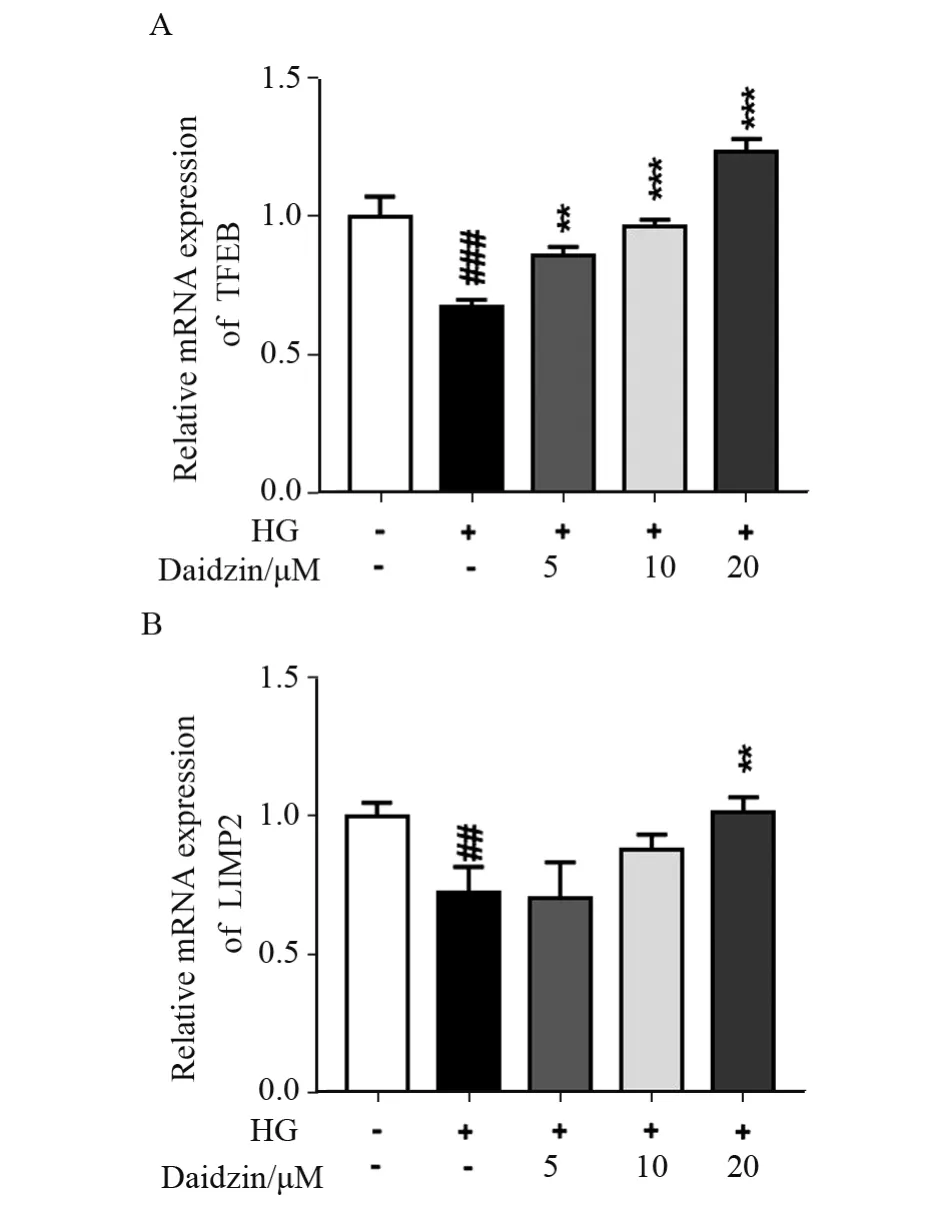
图4 大豆苷促进TFEB 和LIMP2 的mRNA 表达量
2.5 大豆苷能与PPAR-α-LBD 结合
采用Docking 方法探讨大豆苷调控PPAR-α,结果显示:大豆苷可完全嵌入PPAR-α-LBD 的结合口袋中,并以氢键与3 个氨基酸残基结合,分别为THR279、CYS-278、GLU282;最低结合能为-34.3 kJ/mol,见图5。
3 讨论
糖尿病患病率随着生活水平的提高,呈增高趋势。DKD 作为糖尿病的主要并发症,目前尚无特效药物,大豆苷作为大豆的主要成分,前期文献报道能够有效改善DKD,但其作用机制尚未阐明。近年来,自噬失调在DKD 病理损伤中作用不断被阐明,血糖升高、氧化应激、炎症等因素导致细胞内受损蛋白和细胞器集聚,自噬流被阻断[7,11-12],而胶原蛋白Ⅳ(collagen Ⅳ)不断蓄积从而导致系膜增生和系膜基质[13]。与此相一致,本研究发现大豆苷显著降低高糖诱导的系膜细胞过度增殖。PPAR-α 的激活促进下游转录因子TFEB 的转录活性,促进溶酶体生成,从而促进溶酶体自噬的发生,减少胶原基质的增加,改善系膜细胞的增生和基质的沉积。本研究表明,在减少TGF-β1 和collagen Ⅳ的mRNA 表达量的同时,大豆苷还能激活PPAR-α 和TFEB,更重要的是大豆苷激活TFEB 依赖于PPAR-α 的激活。Docking 结果提示,大豆苷能够与PPAR-α-LBD 形成稳定的氢键,见图5。PPAR-α 可能是大豆苷的直接靶点,从而调控TFEB 是其抑制肾小球系膜增殖的潜在机制。
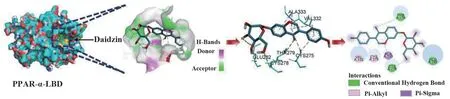
图5 大豆苷与PPAR-α-LBD 蛋白的对接模式图
