两种方法制备冷沉淀凝血因子质量的比较
2021-04-26王惟柴婷婷李云强韩瑜
王惟,柴婷婷,李云强,韩瑜
长春市中心血站,吉林长春 130033
冷沉淀凝血因子是临床上常用的血液制品之一, 含有凝血因子Ⅷ、纤维结合蛋白(Fibronectin,Fn)、血管性血友病因子(Von Willebrand Factor,VNF)、纤维蛋白原(fibrinogen,FIB),非常适用于抢救临床大出血或大量输血的患者,如甲型血友病、纤维蛋白缺乏症等,它的制备是指保存期内的新鲜冰冻血浆在1~6℃融化后,分离出大部分的血浆,并将剩余的冷不溶解物质在1 h内速冻呈固态的成分血[1]。 冷沉淀来源于新鲜冰冻血浆的再加工产品,因其容量小,不稳定凝血因子含量高等优点,在临床广泛应用[2-4]。 容易受到制备过程冷链控制及时间等因素影响, 从而导致冷沉淀凝血因子质量存在较大差异[5],因此在制备过程中尽量减少Ⅷ因子受多种因素影响,根据现有工作条件,将2019 年12 月采集的96 袋400 mL 合格血液制备的新鲜冰冻血浆96 袋,使用不同方法制备冷沉淀凝血因子, 对其质量进行对比分析,现报道如下。
1 材料与方法
1.1 血浆来源
该站2019 年12 月采集的96 袋400 mL 合格血液,采血时间<13 min、采血顺利、无凝块儿。按新鲜冰冻血浆标准操作规程制备,平板速冻机速冻后,移至-40℃医用保存冰箱保存待用。
1.2 设备、耗材与试剂
设备:数字控制水浴式血浆融化箱(CT-4T.6C 型,美国)、-50℃平板速冻机(MBF21,卢森堡)、-40℃医用低温保存冰箱(DW-40L508,海尔)、4℃血液保存冰箱[MBR-506D(H),三洋]、低温离心机(赫利氏6000i,德国)、微电脑配平仪(LPYⅢ,苏州市医用仪器厂)、血液成分分离机[G5,费森尤斯卡比(中国)股份有限公司]、全自动凝血分析仪(ACL TOP300,沃芬);耗材:CPDA抗凝剂一次性使用去白细胞塑料血袋 (山东威高医用高分子生物制品股份有限公司)、试剂:纤维蛋白原测定试剂、 因子Ⅷ缺乏血浆试剂、APTT 试剂、 因子稀释液、 正常值血凝试剂质控品、 低值血凝试剂质控品、ClcanA、ClcanB、冲洗液(沃芬)。
1.3 实验分组
将96 袋新鲜冰冻血浆,随机分为A、B 两组,每组48 袋,分别采用不同方法制备。
1.3.1 第一种方法(A 组),为将新鲜冰冻血浆(冷沉淀半成品)从-40℃医用低温保存冰箱取出,在血液低温操作台上放置3~5 min,移至4℃血液保存冰箱,每层放置10 袋,不能挤压或叠放,5 h 左右移到4℃数字控制水浴式血浆融化箱中水浴融化,30 min 后将血浆袋内的冰捏碎后继续水浴,待新鲜冰冻血浆(冷沉淀半成品)大部分融化,里面含部分冰渣,用时约50 min。 取出擦干血浆袋表面水份,配平离心,离心转速为4 000 r/min,相对离心力为5 170 g,离心时间为20 min,离心温度为2℃。 离心后用血液成分分离机进行分离、-50℃平板速冻机速冻。
1.3.2 第二种方法(B 组),为前期操作同上,新鲜冰冻血浆(冷沉淀半成品)在4℃血液保存冰箱16 h 左右,待新鲜冰冻血浆几乎全部融化,取出直接配平离心,后期操作同上。
1.4 检测方法
将待检测的冷沉淀凝血因子置于37℃恒温水浴箱,完全融化充分混匀后将袋内血浆挤入至塑料试管内3 mL,开始离心,离心转数3 000 r/min,离心时间20 min,离心后取上清约1 mL 左右,然后上机检测。
1.5 质量标准
来源于200 mL 全血的冷沉淀凝血因子(1 U):Ⅷ因子含量≥40 IU/袋,纤维蛋白原含量≥75 mg/袋;来源于300 mL 全血的冷沉淀凝血因子(1.5 U):Ⅷ因子含量≥60 IU/袋,纤维蛋白原含量≥113 mg/袋;来源于400 mL全血制备的冷沉淀凝血因子(2U):Ⅷ因子含量≥80 IU/袋;纤维蛋白原含量≥150 mg/袋[1]。
1.6 统计方法
采用SPSS 22.0 统计学软件分析数据,计量资料用()表示,组间比较采用t 检验,P<0.05 为差异有统计学意义。
2 结果
两组质控检测的各项指标均高于国家标准, 差异无统计学意义(P>0.05),但B 组的各项指标均略高于A组,但差异无统计学意义(P>0.05)。 见表1。
表1 两组血液质控检测结果对比
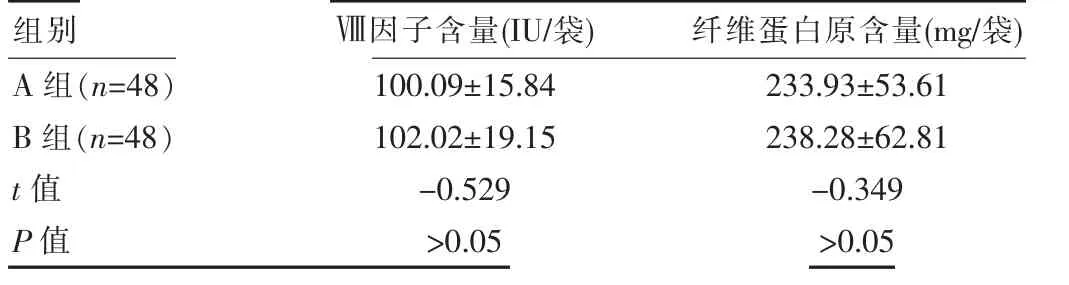
表1 两组血液质控检测结果对比
组别Ⅷ因子含量(IU/袋) 纤维蛋白原含量(mg/袋)A 组(n=48)B 组(n=48)t 值P 值100.09±15.84 102.02±19.15-0.529>0.05 233.93±53.61 238.28±62.81-0.349>0.05
3 讨论
近年来,冷沉淀凝血因子临床应用日益广泛,制备量呈逐年上升的趋势。 根据国家标准来源于400 mL 全血制备的冷沉淀凝血因子(2U)Ⅷ因子含量≥80 IU/袋、纤维蛋白原含量≥150 mg/袋[1]。冷沉淀凝血因子制备离心法是取出待制备冷沉淀凝血因子的新鲜冰冻血浆,置2~6℃冰箱中过夜融化或在1~6℃水浴装置中融化,当血浆基本融化时,在2~6℃环境下重离心,冷沉淀凝血因子宜在制备后1 h 内完成速冻[6]。 其原料浆为新鲜冰冻血浆,在国家标准中,新鲜冰冻血浆是采集后储存于冷藏环境中的全血,最好在6 h(保存液为ACP)或8 h(保存液为CPD 或CPDA-1)内,但不超过18 h 将血浆分离出并速冻呈固态的成分血[1]。 尽量缩短在室温内停留的时间,可减少凝血因子Ⅷ的损失,提高活性[7]。 所以说冷沉淀凝血因子制备从原料浆开始到制备全过程对时间、温度要求比较高,全程需要冷链控制,而且凝血因子Ⅷ的活性还可受到献血者自身凝血因子的水平、采集血液的时间、全血运输时的温度、血浆制备的方法和时间等因素的影响[8]。 该组实验数据显示,冷沉淀凝血因子的质量主要看Ⅷ因子含量和纤维蛋白原含量,A组48 袋中的Ⅷ因子含量为(100.09±15.84)IU/袋,纤维蛋白原含量为(233.93±53.61)mg/袋,B 组48 袋中的Ⅷ因子含量为 (102.02±19.15)IU/袋, 纤维蛋白原含量为(238.28±62.81)mg/袋,均高于国家标准。 A 组方法制备冷沉淀凝血因子是在4℃血液保存冰箱融化后再放到4℃数字控制水浴式血浆融化箱中融化, 融化程度是需要控制的关键步骤,因为是肉眼观察,主要凭经验做出判断,存在人为因素的影响,易出现融化时间短或融化过度,也存在反复融化现象,冷沉淀复融或纤维蛋白析出,对工作人员责任心、操作技术要求比较高;B 组的方法是将新鲜冰冻血浆放到4℃血液保存冰箱融化16 h 左右取出直接离心、分离、速冻,最大的优势是不受外界因素影响,操作步骤和操作人员数量减少,对人员的技术要求和培训要求显著降低。 不同方法制备冷沉淀凝血因子虽然Ⅷ因子和纤维蛋白原含量, 差异无统计学意义(P>0.05),但是B 组将新鲜冰冻血浆放到4℃血液保存冰箱融化16 h 左右取出直接离心、分离、速冻的方法制备冷沉淀凝血因子Ⅷ因子含量、 纤维蛋白原含量略高于A 组,与侯贻莉等[9]的采用将新鲜冰冻血浆置于4℃冰箱隔夜融解17 h 后取出离心, 制备冷沉淀凝血因子的方法一致, 其所研究结果为Ⅷ因子含量为(163.07±56.81)IU/袋,纤维蛋白原含量(215.54±56.47)mg/袋,B组数据与其相对比, 二者Ⅷ因子含量和纤维蛋白原含量均为高出国家标准1.5~2 倍,B 组方法与其研究结果相一致。从而看出,B 组方法更为简便、减少人为因素的影响,更能保证质量。
冷沉淀凝血因子临床需求量日益上升, 在增加制备量的同时又能提高产品的质量越来越引起重视。 现有血站已经采用全自动冷沉淀制备仪制备冷沉淀凝血因子,其具有精确的水温控制系统,保证冷沉淀解冻过程的水温恒定,且每袋新鲜冰冻血浆(FFP)均有独立水浴槽位,消除了血浆袋之间相到互紧贴、重叠甚至堆积的可能性,使每1 袋血浆均具有最大浴接触面[10],做到自动化、精准控制,做到自动截停虹吸、智能称重、自动热合、记录和保存制备过程关键数据,能够保证血袋条形码、制备时间、人员及每袋冷沉淀凝血因子制备过程全程追溯。 但是在血站不具备冷沉淀制备仪设备时,可以采用B 组方法制备冷沉淀凝血因子,其质量稳定、操作方便、效率更高,更适宜推广。
