青年胃癌的临床特征及预后影响因素分析
2021-04-26冯时曹先东
冯时 周 波 曹先东
安徽医科大学第一附属医院胃肠外科,安徽合肥 230000
胃癌是威胁人类健康的重要疾病之一,近年来每年全球新增病例超过100万例,发病率在恶性肿瘤中排第五位[1]。我国是胃癌的高发地区,2020年我国胃癌新发病例约34.6万例,其发病率和死亡率仅次于肺癌[2]。胃癌的发病年龄段主要在50~70岁,青年人胃癌患者是其中较为特殊的群体,其发病率低,占胃癌群体的2%~9%[3-6]。虽然近年来我国胃癌总体发病率趋于平稳,但我国青年胃癌的发病率和死亡率却有上升趋势[7]。目前青年胃癌没有明确的定义,年龄分界值因不同的原因被定义在30~50岁,Takatsu 等[4]将年龄直方图中第五个百分位数内的患者,即≤40岁的人群定义为青年群体,而Bleyer 等[8]根据美国国家癌症研究所的要求将15~39岁人群定义为青年群体。本研究中以40岁为界限,这与多数关于青年胃癌的研究统一[3,4,6]。
既往研究中,因为青年胃癌患者的比例低于中老年患者,所以选择年轻患者的小病例群体与中老年患者的大病例群体进行比较[3,9]。本研究中,采用倾向评分匹配法(PSM)进行配对,目的是选择具有相似观察协变量的研究组和对照组的样本,减少数据偏差和混杂变量,以此来增加观察性研究中的证据水平[5]。
1 资料与方法
1.1 研究对象
收集2013年1月~2017年12月安徽医科大学第一附属医院收治的4154例胃癌病例,依照纳排标准,共纳入3024例患者。其中94例年龄≤40岁的患者作为研究组,使用倾向评分匹配法在纳入患者中按1∶1 进行配对,选择与研究组具有相同手术时间、手术方式、手术时长以及体重指数的中老年患者(年龄>40岁)作为对照组,以减少无关变量对于预后分析的干扰。本研究经医院医学伦理委员会审核批准,并征得所有患者的书面同意。
纳入标准:①年龄≥18岁;②行R0或R1 胃癌根治术;③术后病理诊断为腺癌。排除标准:①已行新辅助化疗的患者;②残胃癌患者;③失访患者。
1.2 数据采集
本研究中对于临床分期为cT1N0M0的患者采取胃切除加D1 淋巴结清扫术;cT2N0M0 以及Ⅱ/Ⅲ期的患者采用胃切除加D2 淋巴结清扫术。术后病理分期为Ⅱ期及Ⅲ期的患者,进行以S-1 单药或者氟尿嘧啶联合奥沙利铂的辅助化疗方案。随访间隔为术后1~2年每3个月复查1次,3~5年每半年复查1次,此后每年随访1次,随访截止至2019年10月1日。患者的临床特征包括人口统计学特征,初发症状,家族史,胃癌大体类型等。同时使用查尔森合并症指数(CCI评分)对基础疾病情况进行量化,比较两组患者基础疾病情况,其中评分>1分指患者合并有多种或较重的基础疾病。肿瘤的组织分化类型采用WHO分类标准。肿瘤分期按照美国癌症联合委员会(AJCC)第8版进行分期[10]。肿瘤部位分为:①胃近端,包括胃食管交界处和胃的近端1/3;②胃中端,包括以胃体为主的胃中部1/3;③胃远端,包括从角切迹处,胃窦到幽门;④全胃,病变累及范围超过上述任一区域或原发病灶多发。
1.3 统计学方法
应用SPSS 22.0 统计学软件进行数据分析,计量资料用均数±标准差()或者中位数表示;计数资料用率表示,组间比较采用χ2检验或Fisher 确切概率法。生存分析采用Kaplan-Meier 方法,并对生存率的比较进行Log-Rank 检验;与预后相关的危险因素采用非参数Cox 回归分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 临床特征
本研究共纳入94例青年胃癌患者,中位年龄35岁。5年内,安徽医科大学第一附属医院青年胃癌患者新发数量逐年升高,且发病率有总体升高趋势(图1)。由图2可见,发病人群主要集中在50~80岁年龄段,青年患者占比仅为3.37%。研究组女性发病多于男性,对照组各年龄段男性均多于女性。
两组患者临床资料如表1所示,研究组女性比例高于对照组,差异有统计学意义(P<0.05);研究组CCI评分低于对照组,即研究组基础疾病少于对照组,差异有统计学意义(P<0.05)。

图1 每年新发青年胃癌人数及其占胃癌总体人数的比例
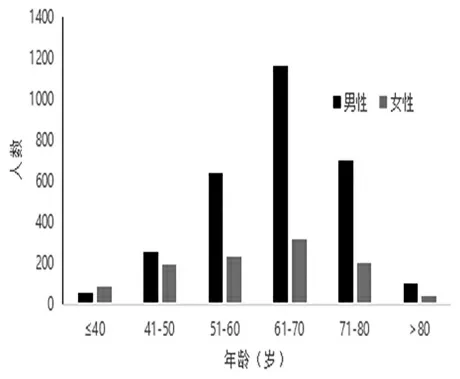
图2 胃癌发病人数年龄直方图
两组患者的初发症状不同,差异有统计学意义(P<0.05);研究组中以上腹部疼痛不适为初发症状者多于对照组,进食哽咽者少于对照组,胃近端肿瘤的发病率低于对照组,差异有统计学意义(P<0.05);研究组的低分化型比例高于对照组,差异有统计学意义(P<0.05);两组的肿瘤标志物阳性率比较,差异无统计学意义(P>0.05);两组胃癌家族史、肿瘤最大径、肿瘤浸润深度T分期、N分期、TNM分期、大体分型以及术后完成化疗人数的比较,差异无统计学意义(P>0.05)。
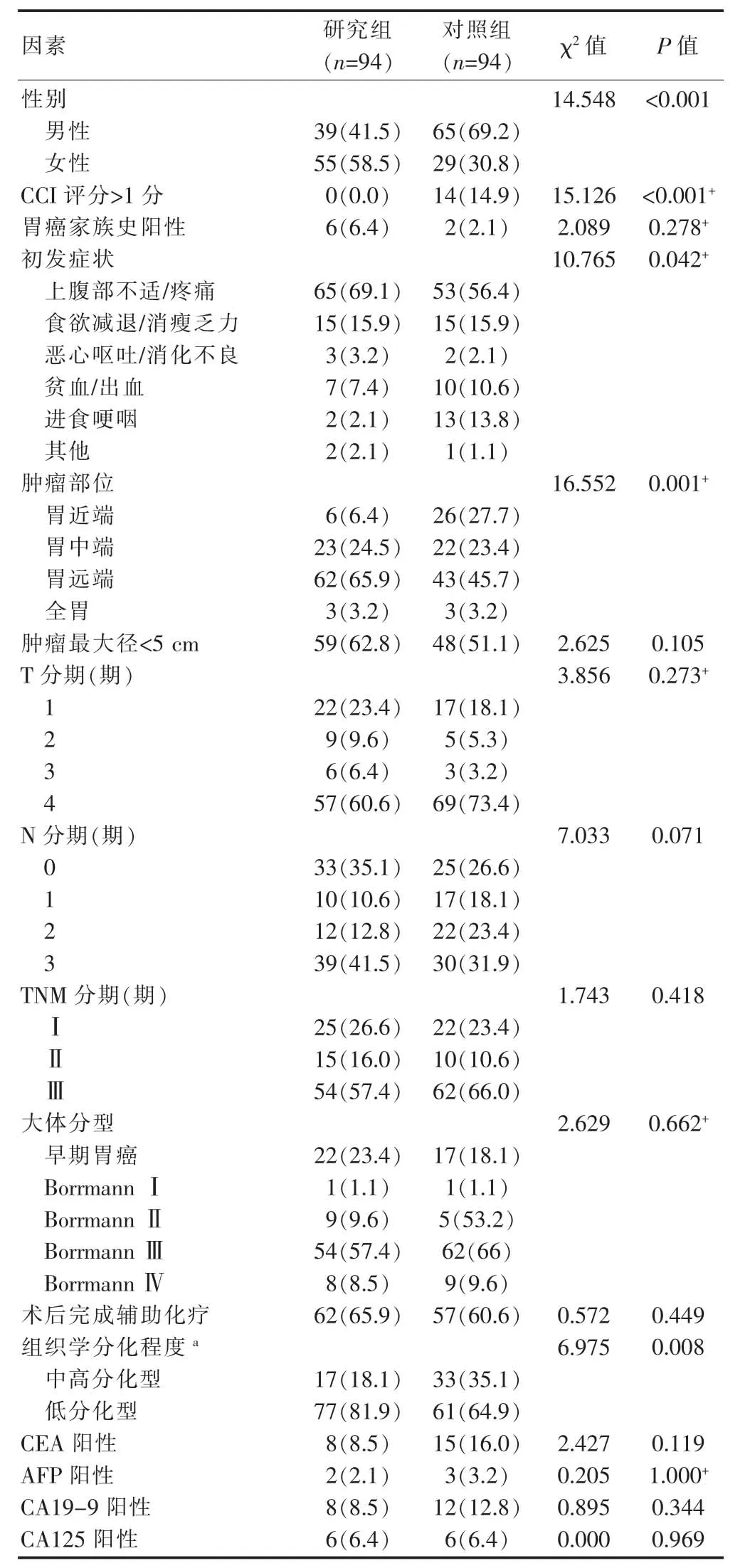
表1 两组患者临床资料的比较[n(%)]
2.2 生存预后分析
研究组和对照组的中位生存时间分别为26.5个月和27.5个月。两组的1、3、5年生存率分别为69.1%、58.5%、41.3%和70.2%、59.5%、45.8%。两组总体累计生存率比较,差异无统计学意义(P=0.675)(图3,封三)。不同TNM分期的生存曲线如图4、5、6(封三)所示,分别描述了两组在Ⅰ~Ⅲ期的生存曲线,各期的累计生存率比较,差异无统计学意义(P=0.329、0.079、0.621)。通过单因素分析可见与预后有关的影响因素包括肿瘤部位、肿瘤大小、淋巴结转移、TNM分期、大体分型、癌胚抗原(CEA)、甲胎蛋白(AFP)、糖类抗原125(CA125)和糖类抗原(CA19-9)(P<0.05);通过多因素分析,独立的不良预后因素包括CA125阳性(HR:3.876,95%CI=1.518~9.896,P<0.05)以及进展期胃癌(HR:11.909,95%CI=2.844~49.861,P<0.05)(表2)。

图3 青年组和老年组胃癌患者总体累计生存率
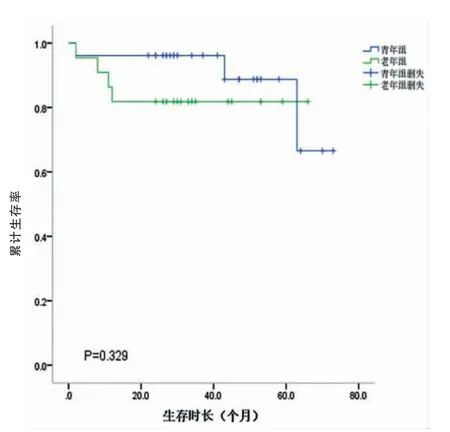
图4 Ⅰ期累计生存率

图5 Ⅱ期累计生存率
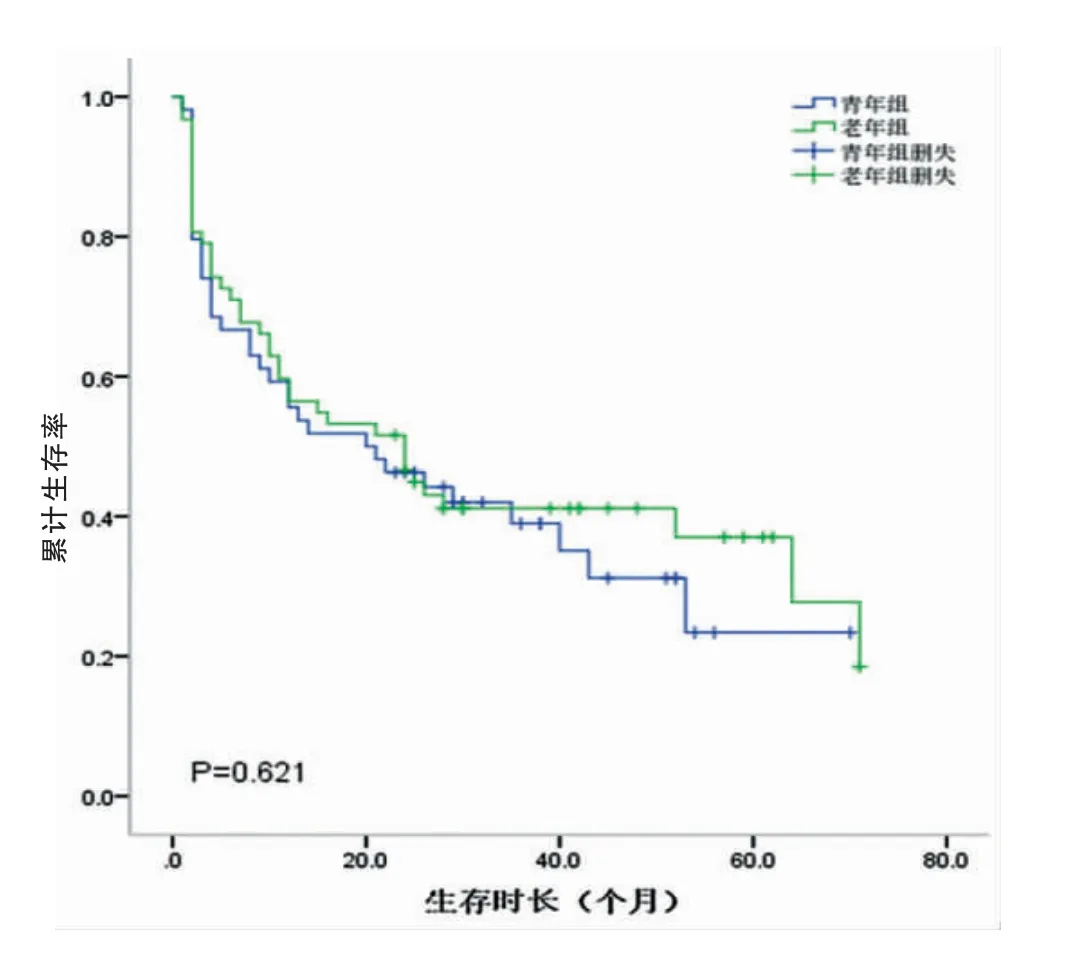
图6 Ⅲ期累计生存率

表2 青年胃癌患者预后影响因素分析
3 讨论
近年,我国青年的胃癌发病率有升高趋势,这与我国青年人饮食与生活习惯的改变密不可分[11]。且年轻人早期发现癌症比其他年龄段的人更难,主要原因是年轻人本身及医护人员普遍缺乏对该年龄段癌症风险的认识,癌症的征兆或症状往往被视为心身表现或其他疾病。
与Zhou 等[9]的研究结果相同,本研究中对照组女性患者比例低于研究组。导致这一现象的原因,一方面是胃癌危险因素如吸烟和饮酒的长期累积,会导致中老年患者中男性比例升高,女性比例降低;另一方面,雌激素对胃癌的发生起到一定防护作用[12],并且自然绝经年龄较大或绝经后激素替代治疗的女性胃癌发病风险也比较低,因此青年女性受雌激素保护作用时间较短可能是其发病率高的原因[13]。此外,年轻女性胃癌患者雌激素受体的高表达与胃癌发病相关[14]。总之,雌激素及雌激素受体在青年胃癌发展过程中的作用与机制仍有待进一步研究。
本研究中青年患者的肿瘤主要位于胃远端,而中老年人以胃近端为主,这一差异与国内先前的研究相同[9,15]。然而,来自日本的Isobe 等[16]研究显示青年患者近端胃癌更多,巴西的一例研究则报告了年龄和肿瘤部位之间没有关联[17]。这可能是因为不同国家人群遗传及饮食的差异所导致的。胃食管反流的发病率会随着年龄的增长而增长[18],而其导致的贲门肠上皮化生是贲门癌的癌前病变,这可能是中老年人贲门癌发病率较青年人高的原因。
本研究中研究组与对照组的总体生存率比较,差异无统计学意义(P>0.05),在根据TNM分期进行分组后,这两个年龄组之间比较,差异无统计学意义(P>0.05),由此可见存活率与年龄无关。尽管青年患者肿瘤侵袭性较强,分期较晚,但其基础疾病较少,对根治性手术及化疗耐受性较高,这使得两组患者在不同分期中的生存期相近。这与Liu 等[5]的研究结果是一致的。但也有研究报告了青年患者的生存率较低[16]或者较高[3],这种不一致有多种原因。青年胃癌的定义是多种多样的,在最近的研究中,青年与中老年患者的年龄界限从40岁到50岁不等,这也与不同地区胃癌发病率和死亡率不同有关[3-6]。研究发现,在我国年轻患者与中老年患者相比,存活率无差异或者更高,而在日本更多研究发现年轻患者预后较差[16,19]。此外不同的治疗方案以及部分研究中青年患者较少的样本量也会导致这种偏差。
血清肿瘤标记物对检测癌症的复发和远处转移、预测患者生存起着重要作用。通过多变量生存分析,CA125阳性是青年患者预后的独立危险因素,这与Zhou 等[9]的研究结果相同。CA125阳性患者预后较差是因为高水平的CA125 不仅与胃癌腹膜扩散的发生显著相关,而且是淋巴结转移及远处转移的危险因素[20]。此外,CEA、AFP 和CA19-9 均是胃癌的独立预后危险因素[21]。然而在本研究中,CEA、AFP 和CA19-9对青年胃癌患者没有预后价值,可能是因为样本量相对较少。
综上所述,相对于老年人胃癌而言,青年人胃癌不仅在性别分布及肿瘤部位、内镜下大体分型等方面不同,而且具有组织学分化程度低、临床分期差等特点。临床工作中应增强对青年胃癌的警惕性,提高其早期诊断率,同时根据患者的临床特征建立个体的预后评估,使用适合个体的治疗方法以改善预后。
