实时影像融合的超声虚拟导航技术用于腹腔寡转移肿瘤射频消融治疗8例
2021-04-26谷春苗徐飞谢贵林王敏
谷春苗 徐飞 谢贵林 王敏
腹膜腔转移是许多恶性肿瘤常见的转移途径,不同大小的转移性肿瘤可以发生在从膈肌到盆腔的任何位置[1]。部分患者原发病灶已手术切除,当发现腹腔寡转移病灶时,特别是全身治疗效果佳的患者,强烈要求切除病灶,但手术对机体损伤大,有些患者不能耐受,因此研究一种微创、有效的方法代替传统外科手术将有重要意义。笔者使用实时影像融合的超声虚拟导航技术对二维超声难以显示清楚的原发肿瘤术后腹腔寡转移肿瘤进行消融治疗,取得良好效果,现报道如下并对此技术在射频消融治疗中的应用价值作一探讨。
1 对象和方法
1.1 对象 选取2019年1至11月在绍兴文理学院附属医院肝细胞性肝癌术后发现腹腔寡转移肿瘤的患者8例,男6例,女2例,平均年龄58岁。纳入标准:(1)原发肿瘤已切除,CT、MRI检查显示原发脏器未见复发病灶;(2)增强 CT、MRI检查提示腹腔可见转移肿瘤;(3)活检提示肿瘤为原发肿瘤的腹腔转移灶。排除标准:(1)腹腔转移性肿瘤>2个,单个病灶最大直径>5 cm;(2)影像学提示血管受侵征象、有其他脏器转移或已出现腹腔积液;(3)凝血功能障碍:PLT<50×109/L,PT 延长>3 s;(4)有严重心、肺功能障碍不能耐受射频消融治疗。本研究经本院医学伦理委员会批准,所有患者均签署知情同意书。
1.2 仪器 超声检查采用GE Logiq晶准E9彩色多普勒超声仪(美国GE公司),实时虚拟导航技术采用GE Logiq E9超声配备的图像融合导航计划系统和磁定位器套件等,凸阵探头 C1-9,频率 3.5~5.0 MHz。射频消融治疗采用Olympus Celon POWER系统,射频发生器频率 460~480 kHz,最大功率 200~250 W,电极针 14~16 G。
1.3 方法
1.3.1 术前准备 经增强MRI检查明确腹腔占位,增强MRI与超声融合导航下穿刺活检,病理诊断明确。术前充分清洁肠道并禁食、水24 h以上,根据肿瘤位置及大小选择消融针,确定进针点、最佳进针路线和进针角度,制订布针方案。对较大病灶则根据肿瘤的大小及形态设计成多个消融区,进行多点布针,逐次消融。
1.3.2 术中操作 患者全麻,消毒铺巾、超声仪套无菌套及探头套,将增强CT或增强MRI图像导入GE Logiq E9图像融合导航计划系统。图像配对采用两步法:第一步,超声图像与CT或MRI图像利用脾静脉、腹腔干、双肾动脉起始部3个固定的解剖标志进行第1次配对。第二步,对肿瘤周围结构以及肿瘤中心位置进行第2次配对。精准配对成功后,实现同步显示图像,按预先制定的方案,在实时超声引导下多影像学融合对比进针进行射频消融(图1、2)。操作时应注意以下几个方面:(1)操作者应熟练掌握实时影像融合的超声虚拟导航系统以及超声引导下射频消融技术,使因技术产生的并发症发生率降到最低;(2)对于肿瘤周边紧邻肠管、血管等重要组织器官时,在其软组织中注入0.9%氯化钠注射液,增大两者的距离;(3)尽量一次性穿刺成功,避免多次穿刺肿瘤,如射频电极针已进入肿瘤,仍需调整位置时,须原位消融后再回撤调整,消融结束后出针要注意烧灼针道,以减少穿刺针道转移的机会[2]。

图1 超声虚拟导航术中精准匹配
1.3.3 术后监测与复查 术后密切监测和复查肝肾功能、血常规和超声,以及时发现并处理消融相关并发症。术后1个月复查增强MRI。
1.4 疗效评价
1.4.1 术中指标 图像融合成功判定:设定当肿瘤周围3个解剖结构的对位误差均约5 mm时,为图像融合成功,否则为图像融合失败。图像融合成功率=(图像融合成功病灶数/总病灶)×100%。
1.4.2 并发症和死亡情况 观察射频消融术中及术后出血、胃肠穿孔等并发症和死亡发生情况。
1.4.3 消融率 术后1个月复查。判定标准[2]:(1)病灶完全消融:患者复查增强 CT或MRI,肿瘤所在区域为低密度(超声表现为高回声),动脉期未见强化;(2)不完全消融:肝脏三期CT/MRI或超声造影随访发现,肿瘤病灶内局部动脉期有强化,提示肿瘤残留。消融有效率=[(部分消融病灶数+完全消融病灶数)/总病灶数]×100%,完全消融率=(完全消融病灶数/总病灶数)×100%。
2 结果
本组8例患者虚拟导航下超声检查显示病灶最大直径18.7~48.6 mm,平均26.25 mm,其中右上腹5例,胃周3例;肿瘤圆形2例,椭圆形3例,不规则形3例。8例患者虚拟导航匹配成功率100%,其中3例消融术后有残留,消融有效率100%(8/8),完全消融率62.5%(5/8)。肿瘤残留的3例患者影像学显示,1例位于右上腹腹膜中,增强MRI检查显示有一较粗的动脉紧贴肿瘤,术后1个月增强MRI复查显示残留肿瘤位于动脉血管周围。1例肿瘤位于横结肠与小肠之间,形态不规则,因肠道气体影响,超声下横结肠后侧部分肿瘤显示欠清。最后1例肿瘤直径48.6 mm,且紧邻胃窦,消融时为避免损伤胃壁,而未能使肿瘤达到完全消融。
本组患者术中及术后未发生与消融相关的出血、胃肠穿孔等严重并发症,无一例死亡,均在术后1周内出院。腹腔寡转移肿瘤消融前后对比如图3、4。
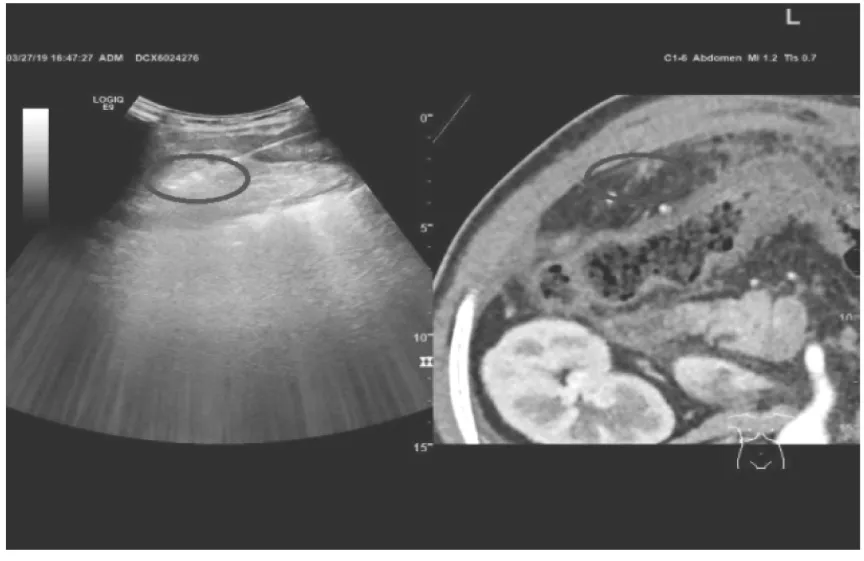
图2 射频消融腹腔寡转移肿瘤

图3 射频消融前增强MRI图像显示右肝下大网膜转移病灶

图4 射频消融治疗1个月增强MRI图像显示后转移病灶未扩散
3 讨论
原发肿瘤术后产生腹腔转移性肿瘤的患者,病情发展快、预后差,但随着医疗技术的发展,实体肿瘤的治疗模式由单一治疗逐渐向多学科联合治疗转变,而在众多的非手术切除治疗方式中,射频消融以其创伤小、安全有效、可重复性强等优点,在肿瘤的治疗中得到了越来越广泛的应用[3-5]。基于影像融合的超声虚拟导航技术在腹腔寡转移肿瘤射频消融中的应用就是多学科联合治疗肿瘤的一个重要组成部分,本组患者治疗有效率达100%,完全消融率达62.5%。
原发肿瘤术后,受腹腔组织粘连、肠腔气体以及消融术中产生的气体影响,腹腔转移性肿瘤及其周围组织在二维超声下显示不佳或仅部分显示,选择消融穿刺路径时,难以准确避让重要结构[6]。虚拟导航技术采用磁定位系统对位,融合了CT/MRI静态图像和常规超声实时成像,既可以利用CT/MRI准确、敏感的空间分辨能力,又可以保留超声实时动态显示的优势,以便显示常规超声难以显示和定位的腹腔转移性肿瘤[7-8],便于术前手术方案的制定[9]。
术中操作过程采取两观察法:(1)观察消融区域,尤其是消融气化增强区域,使增强区完全包裹肿瘤,对不规则肿瘤采用分块消融,使消融范围能完全包裹肿瘤,但又避免过度消融。(2)观察肠蠕动情况,以确保手术安全。当射频针穿刺进入肿瘤时,紧邻的肠管同时被固定,肠蠕动消失,当消融热量传到肠壁时,在自我保护机制下,肠内会有液体通过,带走热量,并且随着消融热量传至肠壁增多,肠腔内通过的液体随之增多,进而肠蠕动亢进。本组中3例患者为确保消融彻底,略增大了消融范围,术后按照胃肠手术标准护理,均未见肠穿孔等并发症。
术后1个月复查增强MRI提示肿瘤有残留3例,1例紧邻肠系膜动脉,血液流动带走了一部分热量导致肿瘤未能完全灭活。受到邻近膈肌、胃肠道等危险脏器的病变在微波消融时可以采用人工胸腹水的方法降低并发症[8]的启发,在后续1例类似患者治疗中,在肿瘤和动脉间隙注入0.9%氯化钠注射液,人为造成组织水肿带压迫血管,术后复查该肿瘤完全消融。另1例受肠道气体影响,肿瘤局部显示欠清,导致消融不全,后续方案中利用虚拟导航精准确定目标穿刺后,针尖向远离肠腔侧加压,使肠腔远离,以提高肿瘤完全消融率。最后1例肿瘤直径48.6 mm,因肿瘤较大且紧邻胃窦导致消融不完全,后续消融时,在两者间隙中注入0.9%氯化钠注射液,增大间隙,同时先在紧邻区小范围消融,然后再次布针大范围消融相对安全区的肿瘤,以提高肿瘤完全消融率。
本组患者术中及术后未发生与消融相关的死亡、出血以及胃肠穿孔等严重并发症。但本研究尚存在不足之处,由于原发肿瘤术后发生腹腔寡转移肿瘤的患者中位生存期短,导致消融治疗的远期效果如何无从考证;其次本研究为小样本研究,因此无法进行多种危险因素的分析。
综上所述,实时影像融合的超声虚拟导航射频消融技术在原发肿瘤术后腹腔寡转移肿瘤局部治疗上是有价值的,其安全、微创、可靠,可作为原发肿瘤术后腹腔寡转移肿瘤全身治疗中的有效补充。
