基于肺磨玻璃结节CT征象的诊断模型列线图评估肺癌浸润性
2021-04-26郑慧李建玉王珊钟飞扬王彬宸安文婷廖美焱
郑慧,李建玉,王珊,钟飞扬,王彬宸,安文婷,廖美焱
肺磨玻璃结节(ground glass nodules,GGNs)的诊断和治疗已成为临床关注的焦点,国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)/美国胸科学会(American Thoracic Society,ATS)/欧洲呼吸学会(European Respiratory Society,ERS)病理分类中将肺腺癌分为非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinoma in situ,AIS)、微浸润性腺癌(minimally invasive adenocarcinoma,MIA)和浸润性腺癌(invasive adenocarcinoma,IAC)。有学者提出AAH、AIS和MIA是肿瘤逐步进展的假设[1-2],AAH和AIS为浸润前病变,MIA和IAC为浸润性病变。目前对肿瘤进展过程的准确病理机制尚不明确,浸润前病变与浸润性病变的治疗方式不同且术后5年无病生存率可达100%,因此术前准确判断十分必要。薄层CT是术前诊断肺部GGNs的主要手段。本研究拟对浸润前组与浸润组GGNs的薄层CT影像资料和临床特点进行回顾性分析,利用多因素logistic回归分析建立GGNs浸润性肺癌诊断模型,并通过nomogram图进行量化,旨在为临床治疗提供建议。
材料与方法
1.临床资料
对2017年6月-2019年10月在本院手术切除的GGNs的病例资料进行回顾性分析。纳入标准:①术前薄层CT肺窗图像(窗位-600 HU,窗宽1600 HU)上显示为纯磨玻璃结节或混合磨玻璃结节;②均获得病理确诊且有完整的临床资料;③图像质量满足诊断要求。
2.CT影像资料
CT扫描采用Siemens Somatom Definition 64排CT扫描仪,扫描参数:120 kV,150 mA,螺距1.0,层厚1.0 mm。采用锐利算法对原始扫描数据进行高分辨重建。由两位有丰富胸部影像诊断经验的放射科医师对每个GGN的CT征象进行评估,通过讨论达成统一意见。主要评估内容包括结节类型(纯磨玻璃结节、混合磨玻璃结节)、长径、平均CT值、位置、分布区域(周围区,中央区)、形态(圆形或椭圆形,不规则)、边界(清晰,模糊)、空泡征、空气支气管征、胸膜改变、脐凹征、血管改变(血管扩张、扭曲或纠集)、毛刺征和分叶征。在横轴面图像上使用依图分析软件测量病变的长径和CT值(图1)。区域划分方法:肺实质的外周三分之一区域为周围区、内侧的三分之二的区域为中央区。脐凹征是指支气管、血管进入结节引起的近肺门侧肿瘤生长受阻而形成的凹陷(图2)。
3.统计分析
统计分析使用SPSS 23.0(IBM Corporation,Armonk,NY)和R4.0.1软件(R Statistical Computing Foundation,Vienna,Austria)。计量资料符合正态分布时采用平均值±标准差的形式进行描述,组间比较使用独立样本t检验;非正态分布时使用中位数(四分位数)表示,组间比较使用Mann-WhitneyU检验;计数资料的比较采用卡方检验或Fisher检验。以P<0.05为差异有统计学意义。使用二项logistic回归分析来确定浸润组的独立危险因子,并建立回归诊断模型,使用ROC曲线分析其诊断效能。使用R语言软件分析独立危险因素,构建浸润性肺癌预测风险的nomogram列线图,通过校正曲线和C指数对nomogram图进行内部验证,评估模型的准确性和一致性。
结 果
166例患者共166个GGNs符合纳入标准。其中,男48例,女118例,年龄(58.33±10.11)岁。浸润前组24例,包括AAHs 13例,AISs 11例;浸润组142例,包括MIAs 56例,IACs 86例。浸润前组和浸润组的临床资料和CT影像学特征的比较见表1。单因素分析结果显示浸润前组纯磨玻璃结节的占比高,两组病灶的直径、平均CT值及胸膜改变、空气支气管征、脐凹征、血管改变、毛刺征和分叶征出现率的差异有统计学意义(P<0.05)。
二项logistic回归分析结果见表2。两组间血管变化、毛刺征和脐凹征的差异有统计学意义。建立的影像诊断模型为logit(P)=1.212×脐凹征+1.463×血管改变+1.299×毛刺征。此诊断模型的ROC曲线见图3,AUC为0.805(95%CI:0.713~0.898;P<0.05),最大约登指数为0.893,对应的最佳截取值为2.121,敏感度为62.0%,特异度为87.5%。
根据二项logistic回归的结果,构建包含3个与浸润性相关的独立危险因素量化nomogram图(图4),每个结节根据是否出现相应的征象在0到100的分数线上给出相应的分数,将每个变量的分数相加计算总分,然后将总分投影到总分风险标度轴上来预测浸润性的可能性。Nonogram图可以对每个结节进行良好评估,计算浸润性的风险度。校正曲线显示预测概率与实际概率关系的校准图(图5),C指数为0.828(95% CI:0.732~0.924),表明预测的可靠性高。
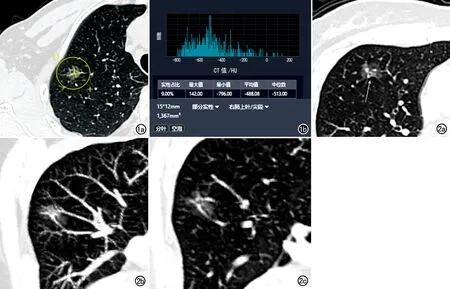
图1 患者,男,56岁,病理证实为AIS。a)CT示右肺上叶外周区类圆形GGN; b) 依图软件分析显示结节的长径为15mm,平均CT值约-448HU,有分叶和空泡征。 图2 患者,女,54岁,病理证实为MIA。a)CT示右肺上叶外周区GGN,形态不规则;血管穿行处边缘锐利、局部可见凹陷(脐凹征,箭);b)MIP图显示结节邻近血管扭曲、纠集;c)薄层图像显示结节邻近血管扭曲、纠集。
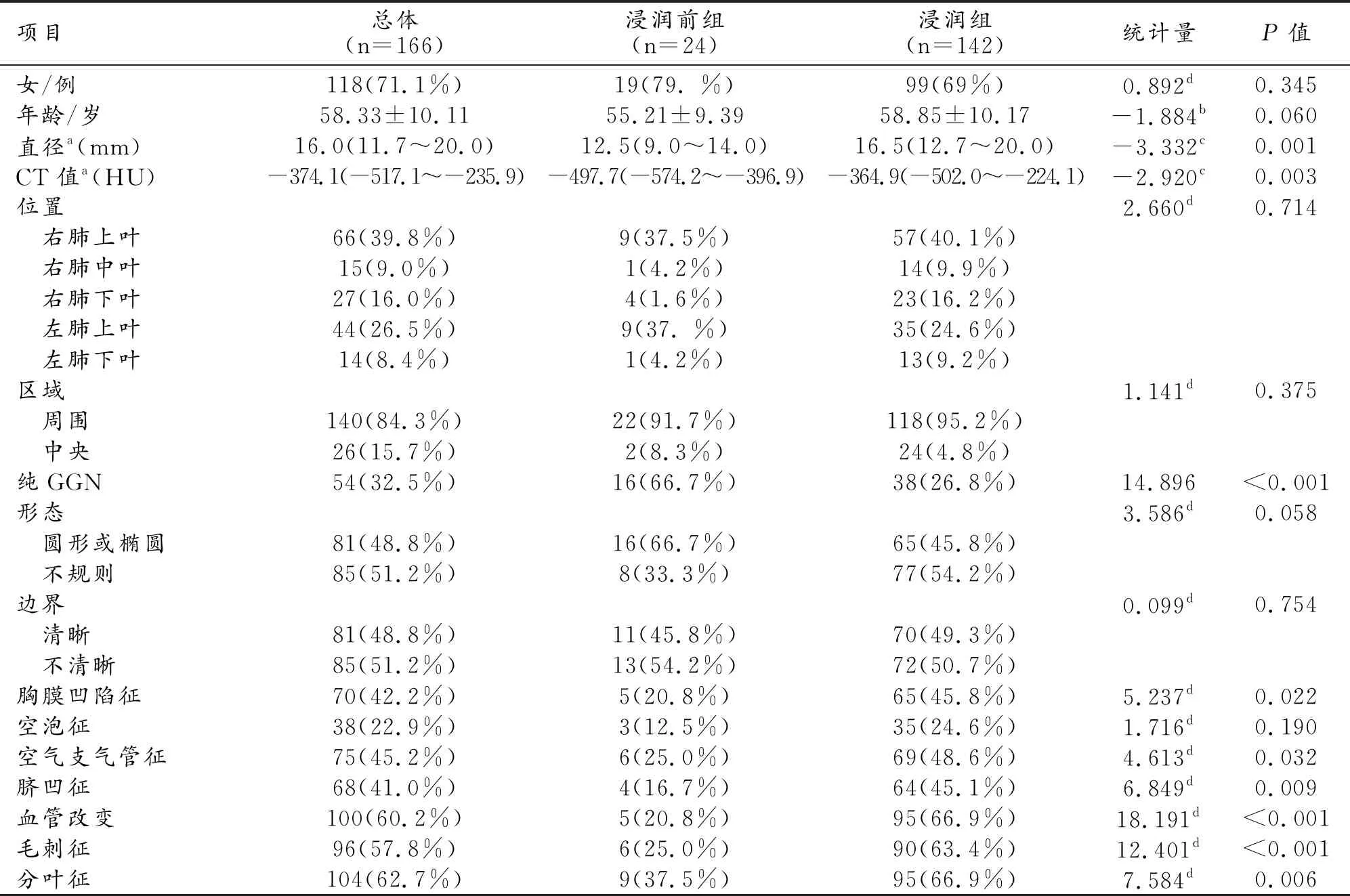
表1 浸润前组和浸润组的临床和影像特征的比较

图3 浸润前组和浸润组二项logistic回归分析模型的ROC曲线,曲线下面积为0.805。 图4 浸润前组和浸润组二项logistic回归分析模型的nomogram图。毛刺、血管改变、脐凹征这三个变量的值在Point轴上给出分数0到100的分数,通过将每个因子的分数相加来计算总分,然后将总分投影到Total Point标度轴上来预测浸润性的可能性。 图5 Nomogram图的校正曲线。横坐标为预测概率,纵坐标为实际概率,45°虚线为标准曲线,表示实际(Y轴)和列线图预测(X轴)之间的完美匹配,实线为模型的预测曲线,该曲线越贴近标准曲线,则说明列线图的预测能力越好。

表2 两组病变CT征象的二项logistic回归分析结果
讨 论
肺癌结节的临床及影像特点可见诸多报道[3],表现为实性结节的肺癌病灶的特点较明显;而表现为磨玻璃结节的肺癌多为早期肺腺癌,其临床及影像特点不显著,采用亚肺叶切除的浸润前病变的术后5年生存率较高,因此术前通过CT准确判断肺结节的浸润性对临床治疗和预后具有重要意义。对浸润前和浸润性肺癌的影像征象进行鉴别的相关文献报道比较多[4]。病灶直径对鉴别浸润前和浸润性肺癌具有重要意义[5-6],病变至今>10 mm的纯磨玻璃结节有助于区分浸润性和浸润前病变,AUC为0.773,敏感度和特异度分别为53.33%和100%[6]。另有有研究者分析了209例GGN病变,发现直径>8.9 mm预测浸润性病变的AUC为0.683[7]。纯磨玻璃结节病理上多提示为早期肺癌,本研究中浸润前病变中纯磨玻璃结节占比为66.7%,明显高于浸润组,亦提示纯磨玻璃结节多为浸润前期病变。实性成分的出现常提示为浸润性肿瘤,5 mm的固体成分对IAC判断的敏感度达100%[8]。二项logistic回归分析显示空气支气管征不是判断磨玻璃结节浸润性的重要诊断因素[6,9],我们的结果与之前研究一致。
本研究中二项logistic回归结果显示毛刺征、血管改变和脐凹征是浸润性肺癌的独立危险因素,具有重要鉴别诊断价值。这3个征象所建立的诊断模型分析预测浸润性病变的AUC为0.805,敏感度62.0%,特异度87.5%。毛刺征是恶性肿瘤的重要影像学表现,这与之前的大量研究结果一致。浸润前组和浸润组结节的血管表现不同,浸润前组病变更多表现为血管通过但没有明显形态学改变,浸润组中出现血管僵硬、扭曲、扩张或纠集征象的病灶更多[10]。脐凹征的形成可能与肺小叶间质、血管和支气管等结构阻碍瘤体生长有关,导致肿瘤各部分生长或浸润的速度不一致,在影像上表现为血管穿行处病灶局部凹陷,脐凹征的出现提示浸润性肿瘤的可能性大。
Nomogram图广泛应用于对癌症的诊断和预后评估,其能够将统计预测模型简化为针对单个病例单个事件的概率估计[11]。有研究者基于瘤体大小、肿瘤消失率(tumour disappearance rate,TDR)和最大标准化摄取值(maximum standard uptake value,SUVmax)三个变量开发了预测肿瘤分级继而预测三年无病生存可能性的列线图,结果显示TDR、肿瘤越大则SUVmax越高,TDR越小则患者的三年无病生存率越低[12]。本研究中基于毛刺征、血管改变和脐凹征这3个可预测肿瘤浸润性的独立危险因素来建立nomogram图,可直观地量化肺癌浸润性的风险度,显示了较好的预测能力,可以无创性的对单个GGNs进行术前风险评估。
本研究尚存在不足之处:①本研究为单中心回顾性研究,可能存在病例的选择偏倚;②建立的模型尚缺少外部验证,需要进一步进行大样本的验证分析。
总之,表现为肺磨玻璃结节的浸润性肺癌更容易出现血管改变、毛刺征和脐凹征,nomogram图可量化分析肺结节的浸润性,为临床鉴别诊断提供帮助。
