模块化HBc-VLPs 载体微针疫苗的制备及其特性和免疫效果分析
2021-04-23刘地高惠仙燕平梅李娜李博武晓英
刘地 ,高惠仙 ,燕平梅 ,李娜 ,李博 ,武晓英
1.太原师范学院生物系,山西晋中030619;2.太原师范学院生物系天然生物活性成分创制兽药工程中心,山西晋中030619
面对由新型病原体引发的传染病,缩短疫苗研发周期,尽早开发出安全、有效的疫苗仍是目前重要的研究方向。近年来,经皮给药系统发展迅速,成为仅次于口服和注射的第三大给药系统[1-2]。皮肤含有大量抗原提呈细胞能够捕捉抗原,将抗原转移至淋巴结并呈递给T 细胞,激活抗原特异性的T 细胞和B细胞,实现全身的免疫反应[3]。微针疫苗方便、安全、无痛,微针输送系统可提高给药效率和药物的生物利用度,降低疫苗成本和冷链运输要求[4-5]。此外,微针疫苗的接种不需要专业的医护人员,利于大规模的快速接种[6]。到目前为止,微针在药物输送、组织修复及美容保健等领域已得到了广泛应用[7-8]。
乙型肝炎病毒核心蛋白病毒样颗粒(hepatitis B virus core protein virus-like particles,HBc-VLPs)是一种安全、有效的疫苗载体[9],这种纳米级的载药平台为新型疫苗的研发提供了新的思路,在生物医学研究、疫苗、药物载体开发和基因治疗等领域具有广阔的应用前景[10-11]。本研究以定向改造的HBc-VLPs为载体,将模式抗原偶联于HBc-VLPs 表面的主要显性区域,制备具有纳米结构的重组抗原,再将抗原制成图层式微针疫苗,并对微针疫苗以及疫苗的免疫效果进行初步评价。
1 材料与方法
1.1 质粒及菌株 表达载体pET-28a(+)购自美国Novagen 公司;工程菌株 E.coli DH5α 和 E.coli BL21(DE3)购自美国Invitrogen 公司。
1.2 主要试剂及仪器 质粒DNA 提取试剂盒和DNA片段纯化试剂盒购自日本TaKaRa 公司;卡那霉素(Kan)、IPTG 和4-(N-马来酰亚胺甲基)环己烷-1-羧酸3-磺基-N-羟基琥珀酰亚胺酯钠盐(Sulfo-SMCC)购自美国Sigma-Aldrich 公司;羧甲基纤维素钠和Lutrol F-68 购自上海昌为医药辅料技术有限公司;Ni-NTA亲和介质购自美国Thermo Scientific 公司;Sepharose凝胶购自美国GE 公司;小鼠抗A 型流感M2e 单克隆抗体购自英国Abcam 公司;HRP 标记的羊抗鼠IgG 抗体购自生工生物工程(上海)股份有限公司;PE-anti-mouse CD8 和FITC-anti-mouse CD4 抗体购自美国Biolegend 公司;其他分析纯化学试剂购自上海凌峰化学试剂有限公司;金属微针购自深圳诚之德精密管业有限公司;JEM-1400 透射电子显微镜购自日本JEOL 公司;A1R 激光共聚焦显微镜购自日本Nikon 公司;ChemiDoc XRS 多功能成像仪购自美国BioRad公司;FACSCalibur 流式细胞仪购自美国BD 公司。
1.3 实验动物 SPF 级 BALB / c 小鼠,6 周龄,雌性,体重16 ~18 g,购自上海斯莱克实验动物有限公司。动物合格证号:SCXK(沪)2012-0002,SYXK(沪)2012-0002。
1.4 微针疫苗抗原的设计 以流感病毒基质蛋白2胞外区(matrix protein 2 ectodomain,M2e)作为主体模式抗原,其为一种跨膜蛋白,易于接近抗体,在各种甲型流感病毒中具有极高的保守性,其抗血清有抑制流感病毒复制的功能,序列为SLLTEVETPIRNEWGKRSNDSSD,其中赖氨酸用四甲基异硫氰酸罗丹明(TRITC)标记侧链,由合肥国肽生物科技有限公司合成。HBc-VLPs 作为抗原的载体,通过定向改造HBc 单体,将其主要免疫显性区域的第80 位丙氨酸Ala 变为半胱氨酸Cys,利用双功能交联剂Sulfo-SMCC 将 M2e 抗原的氨基与 HBc-VLP 载体 Cys 的巯基连接,制备M2e-HBc-VLPs 疫苗抗原(图1)。
1.5 重组质粒的构建 基因hbc 序列来源于NCBI GenBank(HE981189.1),利用重叠延伸 PCR 技术将序列中238-240 位的GCA 转变为TGT,翻译后的多肽序列80 位氨基酸由Ala 变为Cys。目的DNA 片段与载体pET-28a(+)分别经限制性内切酶NdeⅠ和XhoⅠ双酶切12 h 后回收,使用T4 连接酶将回收产物16 ℃连接8 h。连接产物转化至感受态E.coli DH5α,从平板上挑取经 Kan 抗性(终浓度 50 μg /mL)筛选的单克隆菌落,初步培养后由华大基因公司进行商业化基因测序,筛选出序列完全正确的重组菌株并提取质粒。
1.6 目的基因的诱导表达 将重组质粒转入E.coli BL21(DE3)中,挑取单克隆,转接至含有 Kan 抗性(终浓度 50 μg / mL)LB 培养液的试管中培养过夜,将培养液按1 ∶100 的比例转接至摇瓶中,37 ℃,200 r / min 振荡培养至菌液 A600约 0.6 时,加入终浓度为 0.5 mmol / L 的 IPTG,30 ℃诱导表达 10 h。取样进行15% SDS-PAGE 分析,ImageJ 软件分析目的蛋白的表达量。
1.7 重组蛋白的纯化 表达的重组蛋白在含6 mol/L尿素的磷酸盐缓冲体系中,通过Ni-NTA 亲和介质纯化获得HBc 单体蛋白,15% SDS-PAGE 分析目标蛋白的纯化情况。将纯化的蛋白在不含尿素的磷酸盐缓冲液中4 ℃透析12 h,缓慢除去溶液中的尿素,完成单体蛋白自组装,期间更换2 ~3 次透析液。最后使用Sepharose 凝胶将组装后的纳米微粒进一步纯化,超滤浓缩洗脱的样品。
1.8 载体微粒的染色及电镜表征 HBc(A80C)蛋白单体纯化后,在适宜的条件下能够进行自组装,形成VLPs。将30 μL 悬浮样品滴于带有支持膜的铜网上,静置5 min;用滤纸吸去多余液体,待样品风干后,缓慢滴加5%磷钨酸染液至样品表面,静置5 min;用滤纸吸去多余的磷钨酸染液,自然干燥,使用JEM-1400 透射电子显微镜观察并拍照。
1.9 抗原与载体的偶联 将2 mg/mL Sulfo-SMCC 溶液与 2 mg / mL M2e 抗原溶液按照 1 ∶1 的比例混合,室温反应1 h,4 ℃透析6 h;将透析后的M2e 溶液与1 mg / mL HBc-VLPs 溶液按照 10 ∶1 的比例混合,室温反应4 h,4 ℃透析6 h,除去未交联的抗原肽。
1.10 微针疫苗的制备 将金属微针按照12 × 8 的阵列嵌入聚乙烯材料基质中,微针底部直径为150 μm,针长为700 μm。将嵌入聚乙烯材料支架的实心金属微针根据设计位置放入聚二甲基硅氧烷模具中,加入含 1%(w / v)羧甲基纤维素钠、0.5%(w / v)Lutrol F-68、15%(w / v)D-(+)-海藻糖二水合物及一定浓度抗原纳米微粒的涂层混合溶液,抽真空使涂层溶液完全填充模具,4 ℃硅胶盒中干燥后脱模完成制备(图2)。
皖河流域洪水发生期长,洪水过程具有“四大、两快、一短”的特征。水患有自然原因,也有人为因素,根本原因在于气候的不稳定性。历史上,人类不合理开发利用资源放大了不稳定因素。径流含沙量反映了水土流失状况。暴雨引起的洪水暴涨,含沙量猛增,形成峰值,大量泥沙输送到下游,使水土流失。

图1 通过Sulfo-SMCC 介导的定点交联抗原肽M2e 与HBc-VLPs 示意图Fig.1 Scheme for conjugating M2e peptide and HBc-VLPs with Sulfo-SMCC
图2 涂层式微针制备模式图Fig.2 Scheme for preparation of coated microneedles
1.11 微针疫苗的穿刺 将琼脂糖含量为1%的立方体凝胶于37 ℃预热,将微针疫苗贴片至于凝胶立方表面,轻压5 min 后揭下,除去表面未深入凝胶的涂层,观察微针穿刺情况。将微针疫苗贴片至于新鲜的皮肤表面,轻压5 min 后揭下,O.C.T 包埋剂固定,使用切片机制备组织切片,切片固定后采用苏木精-伊红染色法对组织切片染色,光学显微镜下镜检、拍照。未染色的组织切片放置在35 mm 玻璃底培养皿上,使用A1R 激光共聚焦显微镜观察、拍照。
1.12 疫苗涂层的释放 将附载疫苗的涂层微针刺入小鼠皮肤一段时间后取下,前10 min 内,每2 min取下 1 次,10 ~ 30 min 之间,每 5 min 取下 1 次,将微针上剩余涂层溶解于缓冲液中,使用荧光酶标仪测定溶液样品在550 nm 处的荧光强度,根据附载疫苗的总荧光强度计算抗原的释放比例,并绘制释放曲线。
1.13 偶联抗原的抗原性检测 采用Western blot法。将M2e-HBc-VLPs 微粒解聚,样品经电泳分离后转移至PVDF 膜上,以5%脱脂牛奶室温封闭2 h;加入小鼠抗 A 型流感 M2e 单克隆抗体(1 ∶1 000 稀释),室温孵育2 h;经PBST 缓冲液漂洗后,加入HRP 标记的羊抗鼠 IgG 抗体(1 ∶500 稀释),孵育 2 h;漂洗后加入ECL 试剂,在ChemiDoc XRS 多功能成像仪中检测。
1.14 微针疫苗的动物免疫 将小鼠随机分为4 组:空白组、试验1 组、试验2 组和对照组,每组5 只,试验前将小鼠背部提前进行脱毛处理。试验1、2 组使用微针涂层疫苗进行皮内免疫,剂量分别为50 和100 μg / 只;对照组按 100 μg / 只的剂量溶于缓冲液进行皮内免疫;空白组不处理。共免疫3 次,间隔14 d。每次免疫1 周后,经小鼠尾静脉采血,分离血清,间接ELISA 法测定血清抗体效价。
1.15 特异性抗体效价检测 将 5 μg / mL 的 M2e抗原包被液加入 96 孔板中,100 μL / 孔,4 ℃包被过夜;次日加入 300 μL 封闭液,37 ℃孵育 2 h;加入血清样品(1 ∶100 稀释),100 μL / 孔,37 ℃孵育 2 h;加入 HRP-山羊抗小鼠 IgG 抗体,100 μL /孔,37 ℃孵育1 h;加入 OPD 显色液,37 ℃避光孵育 20 min;H2SO4溶液终止反应后,经酶标仪测定A492值。
1.16 T 淋巴细胞亚群分析 取100 μL 小鼠外周静脉血液样品,肝素钠抗凝,200 × g 离心 20 min 分离细胞,取中层细胞,PBS 溶液洗涤2 次,依次加入1 μL PE-anti-mouse CD8 与 1 μL FITC-anti-mouse CD4抗体,室温避光孵育20 min;PBS 溶液洗涤2 次,使用FACSCalibur 流式细胞仪进行分析。
2 结 果
2.1 表达及纯化产物的鉴定 诱导后的全菌体裂解液经15% SDS-PAGE 分析,可见相对分子质量约16 800 的特异蛋白条带,大小与目的蛋白理论值相符,见图3。经ImageJ 软件分析,目的蛋白含量达总蛋白的26%。HBc(A80C)蛋白经亲和纯化后,杂蛋白被有效除去,目标蛋白电泳条带单一,无杂带,纯度达95%以上,见图4。
2.2 HBc-VLPs 的形貌特征 透射电镜观察显示,HBc-VLPs 微粒呈较为均一的球形,微球直径约为30 nm,与HBc-VLPs 粒径的理论值相符,见图5。
2.3 微针涂层的形貌特征 显微镜观察可见,未结合疫苗涂层的微针呈平滑的圆锥体形态;疫苗涂层附着于微针表面后,整体呈三角锥形。使用荧光显微镜进行成像时,TRITC 被激发后产生橙色荧光,可清楚地看见微针涂层除在针尖顶部附着较少外,其余部分均有大量附着。见图6。
2.4 微针的穿刺结果 凝胶穿刺试验结果显示,疫苗涂层在含水的凝胶中能够快速释放,重组纳米抗原沿着微针穿刺后形成的微孔向周围扩散(图7A、B)。皮肤组织穿刺试验结果显示,附载疫苗共聚物涂层的微针可刺穿皮肤角质层,在皮肤表面形成微孔(图7C),微针能将疫苗送达至皮肤真皮层,进行释放(图7D)。

图3 表达产物的SDS-PAGE 分析Fig.3 Expression of HBc(A80C)recombinant protein analyzed by SDS-PAGE
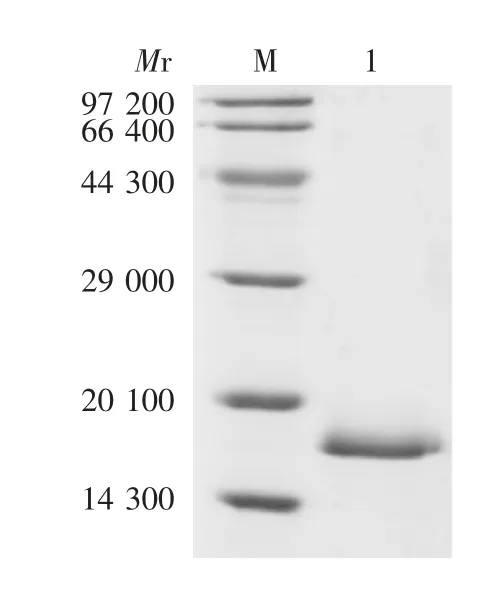
图4 纯化产物的SDS-PAGE 分析Fig.4 SDS-PAGE profile of purified recombinant HBc(A80C)protein
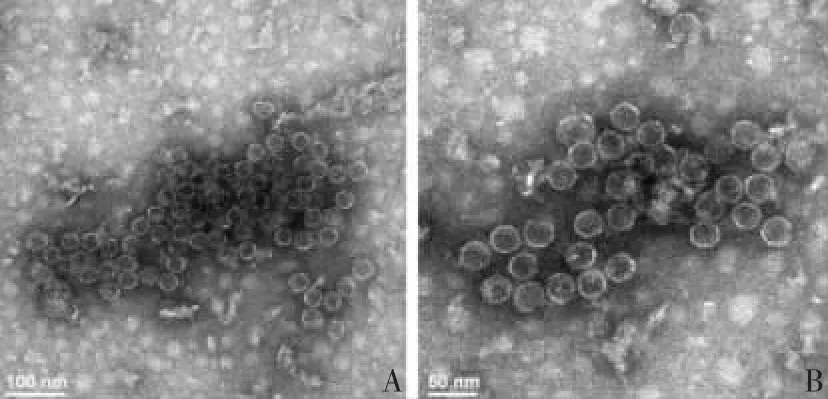
图5 HBc-VLPs 微粒的透射电镜观察Fig.5 Transmission electron microscopy of HBc-VLPs
2.5 微针涂层的溶解与疫苗释放 微针表面的涂层能在皮肤内快速溶解,释放出混合于涂层中的HBc-VLPs 纳米重组抗原,前10 min 涂层内的疫苗快速释放,呈指数型释放曲线,10 min 内即可将涂层内的抗原释放超过90%,随后抗原释放速率趋于平缓,约15 min 涂层内疫苗基本释放完全,见图8。
疫苗涂层进入皮肤后开始溶解,涂层聚合物微粒暴露在表皮,微粒从皮肤组织中吸取组织液,水平扩散至表皮,并随着时间的推移扩散至内皮,随后垂直扩散至真皮层(图9A)。大多数微粒随着时间的推移逐步进入皮肤组织,最终输送至微通道中心的一个空洞内(图9B)。

图6 荧光显微镜下微针涂层的表面形态Fig.6 Surface morphology of microneedle coating under fluorescence microscope
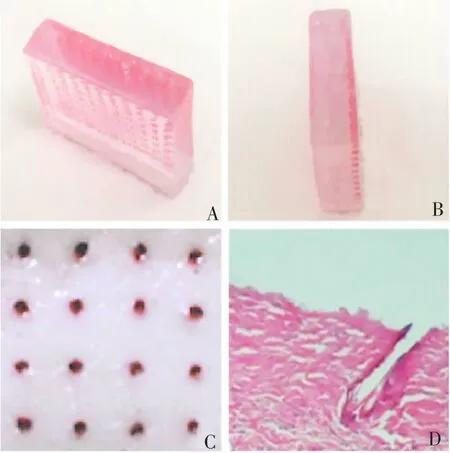
图7 微针列阵的凝胶和皮肤穿刺情况Fig.7 Gel and skin puncture of microneedle vaccine
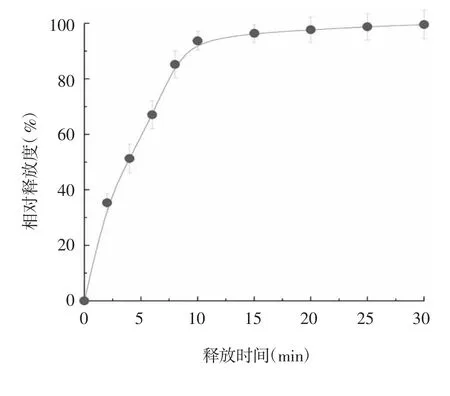
图8 微针涂层疫苗的释放曲线Fig.8 Release curve of coated microneedle vaccine
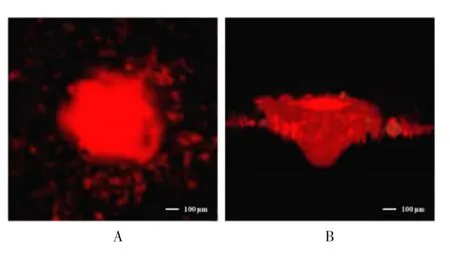
图9 共聚焦显微镜下微针穿刺后涂层中疫苗在皮肤组织的释放情况Fig.9 Release of vaccine in coatings on skin tissue after microneedle micropuncture under confocal microscope
2.6 M2e-HBc 单体的抗原性 Western blot 分析显示,M2e-HBc 单体蛋白能与小鼠抗A 型流感M2e 抗体发生特异性结合,见图10,表明其抗原性良好。由于M2e-HBc 单体聚合形成纳米结构微粒时,整体的抗原性会进一步加强,因此能够更好地激活机体的免疫系统。
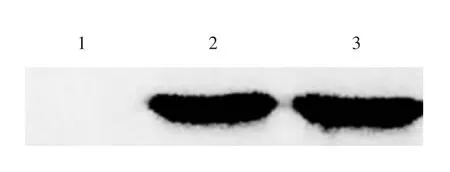
图10 M2e-HBc 单体蛋白的Western blot 分析Fig.10 Western blotting of M2e-HBC monomer protein
2.7 M2e-HBc-VLPs 微针疫苗的免疫效果
2.7.1 特异性抗体效价 初次免疫后,各组小鼠血清中仅检测到少量的抗原特异性IgG 抗体,差异无统计学意义(P > 0.05)。第 2 次免疫后,试验 1、2组和对照组小鼠血清中的特异性抗体均明显升高,其中试验2 组和对照组抗体含量较高。第3 次免疫后,试验1、2 组和对照组小鼠血清中均检测到了抗原特异性IgG 抗体,试验1 组抗体效价差异有统计学意义(t = 4.32,P < 0.05),试验 2 组抗体效价进一步升高,差异有统计学意义(t = 6.49,P < 0.01),微针疫苗诱导机体产生的抗体效价几乎与等剂量注射免疫相同。见图11。
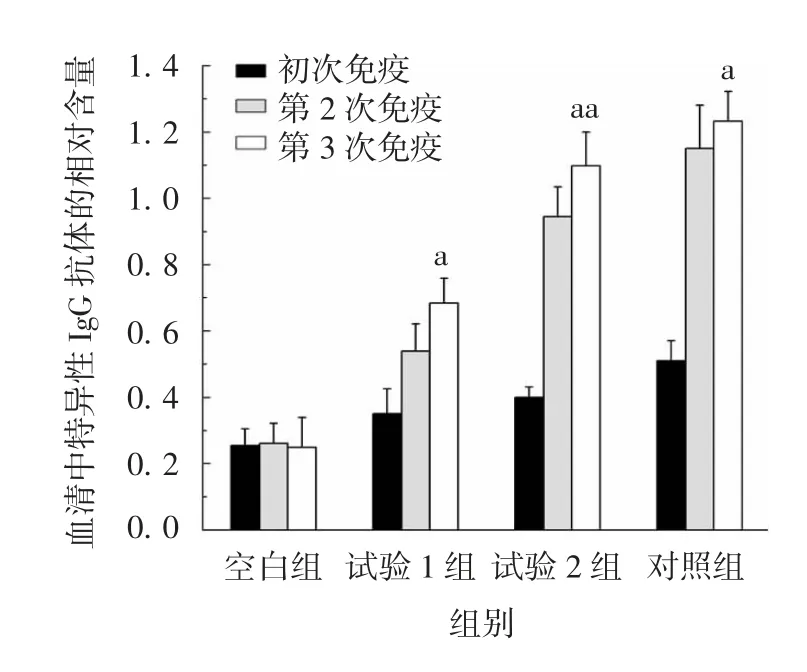
图11 免疫后各组小鼠血清中抗M2e 特异性抗体的含量Fig.11 Serum M2e-specific antibody levels of mice in various groups after immunization
2.7.2 CD4+和CD8+T 细胞含量的变化 与空白组相比,试验2 组与对照组小鼠CD4+T 细胞比例均明显升高,而CD8+T 细胞比例小幅下降,CD4+T/CD8+T比值显著升高。试验2 组CD4+T 比例提高了约11.1%,CD4+T / CD8+T 比值达2.42%,差异有统计学意义(t = 4.74,P <0.05)。见表1。表明疫苗抗原能够在一定程度上激活机体的细胞免疫,而微针疫苗激活机体细胞免疫的能力强于同等条件的注射疫苗。
表1 各组小鼠免疫后CD4+与CD8+T 细胞含量的变化(±s,n = 5)Tab.1 Changes of contents of CD4+ T and CD8+ T cells in mice of various groups after immunization(±s,n = 5)

表1 各组小鼠免疫后CD4+与CD8+T 细胞含量的变化(±s,n = 5)Tab.1 Changes of contents of CD4+ T and CD8+ T cells in mice of various groups after immunization(±s,n = 5)
注:a 表示与空白组比较,P < 0.05。
组别 CD4+T(%) CD8+T(%) CD4+T/CD8+T空白组 33.83 ± 1.55 22.57 ± 0.95 1.50 ± 0.11试验 2 组 44.90 ± 2.16 18.57 ± 0.78 2.42 ± 0.11a对照组 39.03 ± 1.14 18.10 ± 0.93 2.15 ± 0.13
3 讨 论
疫苗是预防和控制传染病最有效的措施,尽早研制出有效的疫苗能更好地救治患者和控制疫情。能够更换“抗原模块”的工程疫苗可在一定程度上缩短疫苗制备和评价周期,通用的疫苗平台可用于结合各种抗原,减少过程变化,降低成本,缩短开发时间[12-13]。VLPs 载体能够增强抗原稳定性,产生高而持久的抗体反应,具有较高的安全性,是一种较为理想的疫苗载体[14]。目前,已有包括乙型肝炎病毒、流感病毒等多种VLPs 疫苗获批上市[15]。本研究对HBc-VLPs 载体进行改造,将其作为连接“抗原模块”的核心,可将针对不同病原微生物的抗原定点连接至该载体上。在HBc(A80C)单体蛋白纯化过程中,存在于菌体破碎液上清中的部分蛋白在缓冲液中发生了自组装,His 亲和标签被包裹在微粒的内部,难以结合到Ni 亲和填料上,导致蛋白收获率降低。通过在缓冲体系中加入6 mol / L 的尿素,利用尿素对蛋白可逆的变性作用,使聚合的蛋白能够解聚,纯化标签得以暴露,提高了蛋白的获取率[16]。HBc(A80C)蛋白单体自组装形成VLPs 后,通过Sepharose 凝胶柱层析,能够除去未组装的单体蛋白,可进一步获取纯度较高的HBc-VLPs 纳米微粒。
微针疫苗方便、无痛、安全,可用于特定皮肤区域的药物输送,特别是大分子活性药物,是未来新式疫苗的一个发展方向。根据给药方式,可将微针疫苗分为固体、涂层、空心和溶解微针4 种类型,其中涂层微针是研究最为广泛的一种[17-18]。微针涂层一般以安全无毒、生物相容性好、能够快速溶解的材料为基质。本研究选取羧甲基纤维素钠作为基质,将Lutrol F-68 作为乳化剂与稳定剂,再辅以一定浓度的海藻糖。羧甲基纤维素钠是一种高分子网状化合物,无臭、无味、有吸湿性,安全性好,在食品领域应用广泛;Lutrol F-68 易溶于水,具吸湿性,与皮肤相溶性好,能够增加皮肤通透性,可促进外用药物的吸收;海藻糖能够使蛋白质分子保持含水状态时的构型,对抗原蛋白起到一定的保护作用[19]。羧甲基纤维素钠与Lutrol F-68 结合后,形成了表面的均匀阴离子电荷层,通过静电作用使涂层更加紧密地沉积在微针表面[20]。微针刺入皮肤前,涂层共聚物的电荷为负,进入皮肤后,皮肤与疫苗涂层相互作用,电荷发生变化,由于静电作用,疫苗涂层会逐层分解,释放出疫苗涂层中的纳米微粒。
在模式疫苗免疫阶段,M2e-HBc-VLPs 微针疫苗能有效刺激小鼠产生抗原特异性的IgG 抗体,与皮内注射的免疫方式相比,使用微针疫苗进行皮肤免疫,试验组小鼠几乎产生了同等水平的抗体,而激活机体细胞免疫的能力强于同等条件的注射疫苗,这也进一步说明了皮肤给药方式的有效性。微针疫苗与注射疫苗相比具有许多优势,但也存在包括皮肤免疫机制尚未完全阐明,目前可用的基质材料较少,疫苗活性不稳定等问题[21],相信随着更多新型材料被发掘,人体免疫机理的不断完善,微针疫苗会得到进一步发展。
本研究以定向改造的HBc-VLPs 为载体,提供了一种利用具备定点偶联功能的HBc-VLPs 载药平台开发“模块化疫苗”的新思路,通过Sulfo-SMCC 将模式抗原锚定于HBc-VLPs 载体表面的特定位点,再将纳米抗原微粒混合于快速溶解材料基质中,制备涂层式的微针疫苗,通过物理性质的表征以及动物免疫等方式,验证模式疫苗的有效性。具备定点偶联功能的HBc-VLPs 载体能够搭载多种抗原模块,形成针对特定病原体的疫苗,在一定程度上缩短疫苗制备、评价周期。该方法能够应用于类似的VLPs载体,为HBc-VLPs 作为模块化疫苗载体奠定了研究基础,促进了基于HBc-VLPs 载体模块化微针疫苗的研发以及HBc-VLPs 在其他领域的应用。
