双歧杆菌对Ⅰ+Ⅲ型二价脊髓灰质炎减毒活疫苗黏膜免疫的影响
2021-04-23赵婷施红媛李菁陈诗怡赵钰萍杨晓蕾李国良杨净思
赵婷,施红媛,李菁,陈诗怡,赵钰萍,杨晓蕾,李国良,杨净思
中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118
在最近数十年中,许多国家和地区已清除了野生型脊髓灰质炎(简称脊灰)病毒的传播,在此情况下,世界卫生组织提出停止三价口服脊髓灰质炎减毒活疫苗(trivalent oral poliovirus vaccine,tOPV)的使用,改为二价口服脊髓灰质炎减毒活疫苗(bivalent oral poliovirus vaccine,bOPV),并引入至少 1 剂脊髓灰质炎灭活疫苗(inactivated poliovirus vaccine,IPV)[1]。近期,我国响应世界卫生组织的策略,开始实施脊灰序贯免疫程序(接种1 剂IPV 后,接种两剂bOPV),研究发现,IPV 和bOPV 的联合序贯免疫接种程序与全程接种tOPV 程序相比,其脊灰特异的肠道黏膜免疫有所降低[2]。在发展中国家,脊灰特异的肠道黏膜免疫十分重要,其可有效抑制病毒沿粪口途径传播,阻止脊灰快速传播[3-4]。因此,在疫苗策略转换后,增强脊灰特异的肠道黏膜免疫力成为一个新的问题。
在前期临床试验中发现,肠道菌群中富集双歧杆菌的婴幼儿群体在服用OPV 后,脊灰特异的免疫球蛋白 A(immunoglobulin A,IgA)阳性率更高[5]。该现象为提高疫苗激发的黏膜免疫效果提供了新的思路。本研究旨在观察服用和未服用双歧杆菌的脊灰受体转基因小鼠接种bOPV 后的黏膜免疫效应,探讨双歧杆菌与bOPV 肠道黏膜免疫效率之间的相关性及作用机制。
1 材料与方法
1.1 疫苗、菌株及载体 Ⅰ+ Ⅲ型脊髓灰质炎减毒活疫苗(人二倍体细胞)由中国医学科学院医学生物学研究所提供,规格:0.1 mL / 剂,含脊髓灰质炎活病毒总量不低于6.12 lgCCID50,其中Ⅰ型应不低于6.0 lgCCID50,Ⅲ型应不低于 5.50 lgCCID50;双歧杆菌菌株(Bifidobacterium animalis subsp.Lactis)购自中国工业微生物菌种保藏管理中心;pSP64 polyA 载体购自美国Promega 公司;大肠埃希菌Top10 工程菌购自日本TaKaRa 公司。
1.2 实验动物 SPF 级脊灰受体转基因C57BL / 6N小鼠,雌性,体重18 g,购自北京维通利华公司,动物合格证号:1103411911000199。
1.3 主要试剂 小鼠脊髓灰质炎抗体IgA 酶联免疫分析(ELISA)试剂盒购自默沙克生物公司;流式抗体 FITC anti-mouse CD3、Alexa Fluor®700 anti-mouse CD4、APC / Cyanine7 anti-mouse CD45、PE anti-mouse CD19 购自美国BD 公司;RNA 提取试剂盒购自天根生化科技(北京)有限公司;RNA 体外转录试剂盒(RiboMAXTMLarge Scale RNA Production System-SP6)购自美国Promega 公司;一步法绝对定量试剂盒(One Step Pri-meScript®RT-qPCR Mix 购自日本TaKaRa公司。
1.4 动物分组及免疫 将脊灰受体转基因小鼠分为两组:试验组和对照组,每组5 只。试验组以灌胃方式接种 bOPV,0.1 mL / 只,间隔 28 d 接种第 2 剂bOPV,每剂bOPV 接种前7 d 以灌胃方式接种双歧杆菌,0.1 mL / 只,含 1 × 106个菌落形成单位(colonyforming unit,CFU)/ μL[6];对照组同样间隔 28 d 接种相同剂量的bOPV,每剂bOPV 接种前7 d 以灌胃方式喂磷酸盐缓冲液(PBS),0.1 mL / 只。
1.5 灌胃双歧杆菌对小鼠影响的检测 灌胃当天记为第 1 天,在第 1、2、3、5、7 天分别测量两组小鼠体重。灌胃双歧杆菌后第3 天采集小鼠血清样本,基于Luminex 平台,利用Luminex 检测技术,测定血清中细胞因子 IL-1、TNF-α、IFNγ、IL-6、IL-10、IL-17A 的含量。
1.6 IgA 检测 在每剂bOPV 接种后的第3 和第7天收集当天新鲜的小鼠粪便,均质后秤取500 mg,加入 2 mL PBS 溶液并充分混匀,800 × g 离心 20 min后收集上清溶液,使用小鼠脊髓灰质炎抗体IgA 酶联免疫分析(ELISA)试剂盒测定粪便上清溶液中IgA 水平。
1.7 灌胃双歧杆菌对脊灰减毒活疫苗引发的肠道黏膜免疫效应影响的检测
1.7.1 淋巴细胞检测 采用流式细胞术。第2 剂bOPV 接种后第7 天处死小鼠,采集肠道淋巴结,放入含 4% FBS,0.5 mg / mL 胶原蛋白酶,0.5 mg / mL分散酶和 40 μg / mL DNaseⅠ的 RPMI1640 培养基中,37 ℃振荡消化 1 h;加入含4% FBS 的RPMI1640培养基终止消化,研磨,使用100 μm 尼龙网过滤,收集滤液,860 × g 离心 5 min;收集细胞,用 5 mL 40% Percoll 分离液重悬,使用淋巴细胞分离管,下层加入5 mL 80% Percoll 分离液,上层加入含细胞的 40% Percoll 分离液,860 × g 离心 30 min,取中间白色的淋巴细胞进行流式分析,标记抗体:FITC anti-mouse CD3、Alexa Fluor®700 anti-mouse CD4、APC /Cyanine7 anti-mouse CD45、PE anti-mouse CD19。CD4+T 淋巴细胞标记为 CD45+CD3+CD4+,B 淋巴细胞标记为CD45+CD3-CD19+。
1.7.2 细胞因子检测 首剂bOPV 接种后第1、3、6天,经小鼠尾静脉采血,分离血清,基于Luminex 平台,利用Luminex 检测技术,测定血清中细胞因子IL-1、IL-6、IL-10、IL-17A、IFNγ、TNF-α 绝对浓度。
1.8 病毒载量检测 采用实时荧光定量PCR 法。每剂bOPV 接种后第3 和第7 天收集当天新鲜的小鼠粪便,按照1.6 项步骤处理得到粪便上清溶液,取140 μL 上清溶液,使用RNA 提取试剂盒提取样品RNA。标准品制备:将Sabin1 和Sabin3 基因序列[由生工生物工程(上海)股份有限公司合成]酶切连接入pSP64 polyA 载体中,转化大肠埃希菌Top10 工程菌,挑取单克隆,提取载有基因片段的完整质粒作为模板。将分别载有Sabin1 和Sabin3 基因片段的完整质粒线性化,使用RNA 体外转录试剂盒体外转录获得Sabin1 和Sabin3 的RNA 序列作为绝对定量PCR 的标准品,使用一步法绝对定量试剂盒测定病毒载量。Sabin1 株实时定量引物为:Primer1:5′-CCACTGGCTTCAGTGTTT-3′,Primer2:5′-AGGTCAGATGCTTGAAAGC-3′,Probe:Cy5-TTGCCGCCCCCACCGTTTCACGGA-BHQ-3;Sabin3 株实时定量引物为:Primer1:5′-TTAGTATCAGGTAAGCTATC-3′,Primer2:5′-AGGGCGCCCTAACTTT-3′,Probe:ROX-TCACTCCCGAAGCAACAG-BHQ2。扩增条件为:第1步:42 ℃ 5 min,95 ℃ 10 s;第 2 步:95 ℃ 5 s,56 ℃30 s,35 个循环;在第 2 步 56 ℃扩增时检测信号。
1.9 统计学分析 应用GraphPad Prism 5 和SPSS 19.0 软件进行统计学分析。两组间平均值的比较采用t 检验,率的比较采用Fisher 确切概率法,假设检验水准为双侧α = 0.05,以P <0.05 为差异有统计学意义。
2 结 果
2.1 灌胃双歧杆菌对小鼠的影响 试验组和对照组小鼠体重在第 1、2、3、5、7 天均无明显差别,在第 2天由于灌胃禁食的原因,体重略有下降,恢复饮食后两组小鼠体重均上升至正常水平,见图1。试验组与对照组小鼠血清中 IL-1、TNF-α、IFNγ、IL-6、IL-10、IL-17A 含量差异均无统计学意义(t 分别为0.479 7、1.086、0.912 6、1.596、0.476 和 1.009,P 分别为0.644 3、0.309 2、0.308 1、0.149 2、0.646 8 和 0.342 7),见图2。
2.2 灌胃双歧杆菌对小鼠脊灰特异的肠道黏膜免疫IgA 抗体的影响 检测结果显示,试验组小鼠能在接种第1 剂bOPV 后迅速产生脊灰特异的肠道黏膜IgA,第1 剂bOPV 接种后第3 天,脊灰特异的肠道黏膜IgA 水平和阳转率均显著高于对照组(P 均<0.05);接种第 2 剂 bOPV 后第 3 天,试验组脊灰特异IgA 水平显著高于对照组(P < 0.01),但阳转率差异无统计学意义(P > 0.05);在两剂 bOPV 接种后的第7 天,两组脊灰特异肠道黏膜IgA 水平和阳转率差异均无统计学意义(P >0.05),且 IgA 阳转率在第7 天均达100%。见表1。
图1 灌胃双歧杆菌后小鼠体重的变化Fig.1 Changes in body weights of mice after inoculation with bifidobacteria by gavage
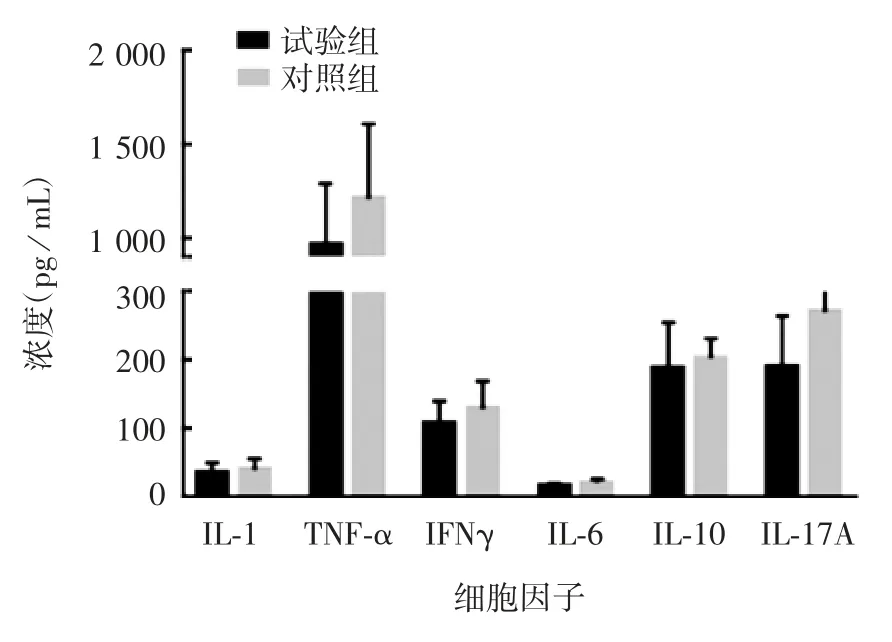
图2 灌胃双歧杆菌后小鼠血清中细胞因子分泌水平Fig.2 Cytokine secretion levels of mice after inoculation with bifidobacteria by gavage
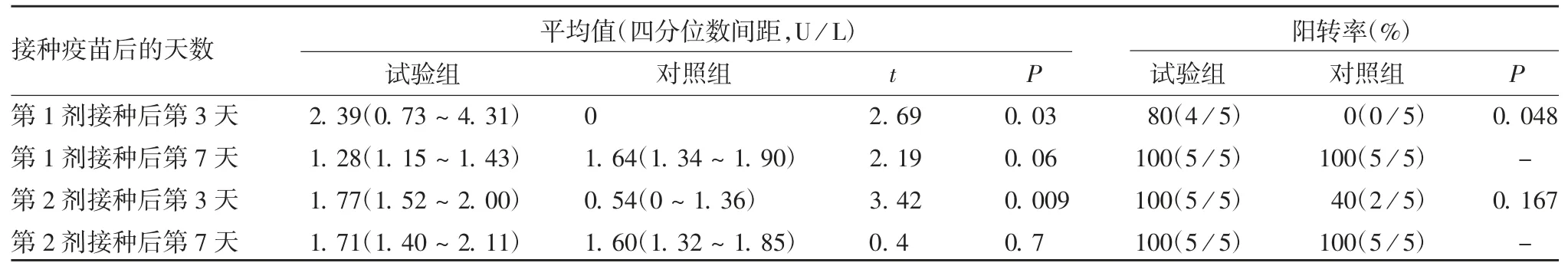
表1 两组小鼠接种第1 和第2 剂bOPV 后脊灰特异的IgA 分泌水平和阳转率Tab.1 Polio-specific IgA secretion levels and positive conversion rates of mice in test and control groups after immunization with the 1st and the 2nd doses of bOPV
2.3 灌胃双歧杆菌对脊灰减毒活疫苗引发的肠道黏膜免疫效应的影响
2.3.1 淋巴细胞水平 流式细胞术分析显示,试验组小鼠接种bOPV 后,其肠道淋巴结中的B 细胞数量(16.01%)显著高于对照组(4.92%)(t = 99.3,P <0.000 1),CD4+T 细胞数量两组之间差异无统计学意义(t = 0.85,P = 0.42),见图3。
2.3.2 细胞因子水平 首剂bOPV 接种后第3 天,试验组与对照组小鼠血清中Th1 类细胞因子IL-1 和TNF-α 水平差异有统计学意义(t 分别为 2.68 和 3.0,P 分别为 0.04 和 0.03);试验组 Th1 类细胞因子IFNγ 和 Th2 类细胞因子 IL-6、IL-10 水平高于对照组,但差异无统计学意义(t 分别为1.35、0.91 和1.57,P 分别为 0.23、0.40 和 0.19)。第 6 天两组间各细胞因子水平差异均无统计学意义(t 分别为0.99、0.69、0.49、0.69、0.37 和 2.70,P 分别为 0.37、0.52、0.65、0.52、0.73 和 0.054)。见图4。
2.4 灌胃双歧杆菌对接种bOPV 后排毒的影响 对于Ⅰ型脊灰疫苗株,第1 剂bOPV 接种后第3 天,试验组小鼠排毒量(972.3 个 / μL)显著低于对照组(6 627 个 / μL)(t = 3.71,P = 0.006);第 1 剂 bOPV接种后第 7 天和第 2 剂bOPV 接种后第 3、7 天,试验组小鼠排毒量略高于对照组,但差异均无统计学意义(t 分别为 1.70、1.53 和 1.25,P 分别为 0.13、0.16 和0.25)。Ⅲ型脊灰疫苗株与Ⅰ型有相同的趋势,但试验组与对照组之间差异均无统计学意义(t 分别为 0.31、1.43、1.23 和 2.02,P 分别为 0.76、0.19、0.25 和 0.08)。见图5。
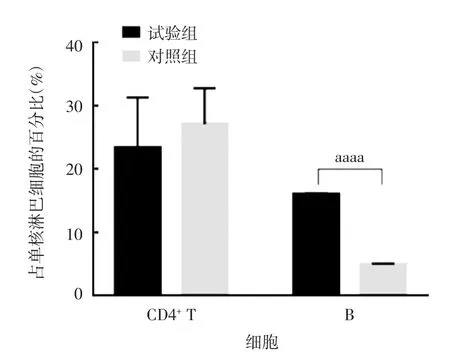
图3 灌胃双歧杆菌对脊灰减毒活疫苗激发的肠道淋巴细胞的影响Fig.3 Effect of inoculation with bifidobacterium by gavage on intestinal lymphocytes stimulated by bOPV
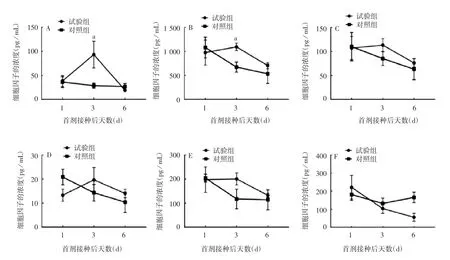
图4 灌胃双歧杆菌对脊灰减毒活疫苗激发的细胞因子分泌的影响Fig.4 Effect of inoculation with bifidobacterium by gavage on cytokine secretion induced by bOPV
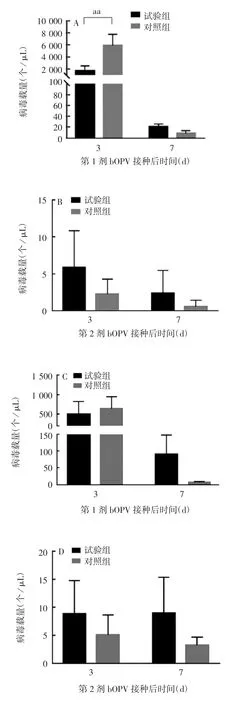
图5 灌胃双歧杆菌对bOPV 接种后排毒的影响Fig.5 Effect of inoculation with bifidobacteria by gavage on virus shedding after immunization with bOPV
3 讨 论
对于口服脊髓灰质炎疫苗,先前有研究表明鼠李糖乳杆菌[7]和干酪乳杆菌[8]能增强其特异性IgA水平,本研究发现,另外一种益生菌双歧杆菌也具有相同的效应。在脊灰受体转基因小鼠上开展的研究提示,接种bOPV 前服用双歧杆菌,可提高bOPV 激发的脊灰特异的黏膜IgA 分泌水平,且具有一定的减缓排毒效应的作用。
给脊灰受体转基因小鼠接种bOPV 前接种双歧杆菌可快速激发小鼠黏膜免疫反应,显著提高脊灰特异的肠道黏膜IgA 的阳转率,这种效应在首剂bOPV 接种后更为明显。在第1 剂bOPV 接种后第3天,接种过双歧杆菌的试验组小鼠中脊灰特异的黏膜IgA 阳转率显著高于未接种双歧杆菌的对照组,对照组小鼠无脊灰特异黏膜IgA 阳转的个体。在第2 剂bOPV 接种后的第3 天,两组中均有IgA 阳转个体,两组阳转率差异无统计学意义(P >0.05)。这种随着剂次增加,服用双歧杆菌提高脊灰特异的黏膜IgA 阳转率变得不明显的现象,可能与首剂bOPV已在两组均留下了免疫记忆有关。因此,如使用益生菌来提高疫苗激发的肠道黏膜 IgA 水平,需在早期使用效果更佳。
服用双歧杆菌不仅可帮助疫苗快速激发黏膜免疫,也可在服用bOPV 的最早期有一定的降低排毒量的作用。服用双歧杆菌的小鼠在接种第1 剂bOPV 后的第3 天,Ⅰ型脊灰排毒量低于未接种双歧杆菌的对照组小鼠,之后排毒量随着接种bOPV 的剂次慢慢减少。接种第1 剂bOPV 后的第3 天,Ⅲ型脊灰排毒量在服用双歧杆菌的试验组中略低,但差异无统计学意义(P >0.05)。服用双歧杆菌后,在早期减少Ⅰ型和Ⅲ型脊灰病毒排毒的效应有所不同,这可能与不同型别的脊灰病毒排毒模式差异有关。有研究表明,Ⅰ型OPV 比Ⅲ型OPV 到达排毒峰值的时间更早[9],本研究也观察到Ⅰ型OPV 在第3 天引起的排毒量远高于Ⅲ型OPV。在服用bOPV 后第3 天,Ⅲ型脊灰的排毒量不高,可能是服用双歧杆菌引起的Ⅲ型脊灰病毒排毒减少效应不明显的原因。在接种第2 剂bOPV 后,无论是接种还是未接种双歧杆菌的小鼠,其排毒量相比第1 剂接种后均显著降低,这与首剂bOPV 免疫后留下的黏膜免疫记忆有关。首剂bOPV 接种后刺激肠道黏膜产生脊灰特异的IgA 和脊灰特异的效应记忆性细胞,在第2 次bOPV 接种后,肠道的效应记忆性细胞可快速反应产生IgA 清除脊灰病毒,致使排毒大大减少。因此,在第2 剂bOPV 接种后,脊灰特异的免疫记忆对排毒的减少效应占主导作用,双歧杆菌引起的排毒减少效应非常小,几乎观察不到。
一些在动物模型上的研究帮助我们初步认识了肠道菌群影响疫苗免疫反应的机制。加氏乳酸杆菌能激活小鼠结肠固有层B 细胞群的分化[9]。另一些研究证明,连续用乳酸杆菌喂养小鼠能增强CD4+T细胞和B 细胞的增殖[11]。干酪乳杆菌与人外周血单核细胞共培养后,NK 和CD8+T 细胞上的活化标记CD69 和CD25 上调,这些均是在疫苗特异的免疫反应中十分重要的免疫细胞亚群[12]。本研究在对肠道淋巴结细胞分群分析后发现,双歧杆菌接种的小鼠在bOPV 免疫后能激活更多B 淋巴细胞分化,这可能是引起在接种过双歧杆菌的小鼠中接种bOPV能检测到更多的脊灰特异IgA 抗体的原因。
另外,本研究发现,试验组和对照组小鼠在接种bOPV 后细胞因子分泌上有差异,提示接种双歧杆菌可提高口服脊灰疫苗使用后的免疫效应,激活更多的Th1 细胞因子和免疫通路。
研究表明,益生菌在其他一些口服疫苗上同样表现出佐剂效应,如在婴幼儿口服轮状病毒疫苗之前服用鼠李糖乳杆菌,表现出轮状病毒特异的IgM抗体分泌细胞增加,且具有更高的病毒特异IgA 抗体滴度[7]。服用嗜酸乳杆菌La1 和短双歧杆菌Bb12的发酵乳后使用伤寒杆菌减毒活疫苗,能增加特异性的血清IgA 滴度[13]。这些现象表明,益生菌可能通过共同的调节机制和路径影响口服疫苗的免疫效应,其对增强口服疫苗的免疫效应可能具有广泛性。肠道共生菌能维持肠道体内平衡,调节免疫系统功能[14]。另一方面,肠道共生菌群可能修饰呈递给肠道相关淋巴组织的病原相关分子模式,或通过产生短链脂肪酸来直接或间接影响免疫功能[15-17]。
综上所述,双歧杆菌用于bOPV 接种前可提高脊灰特异的黏膜免疫IgA 分泌水平,且有一定的减缓排毒作用。研究者可使用益生菌或亚成分作为疫苗的佐剂,促进疫苗特异性免疫的发生。
