构树育苗影响因素研究进展
2021-04-23陈谭星高正龙曹力凡颜慧萍谢晓阳孟庆法王品胜
陈谭星,高正龙,曹力凡,颜慧萍,谢晓阳,孟庆法,王 洋,王品胜
(1.河南省高新技术实业有限公司,河南 郑州 450002;2.河南省生物技术开发中心/河南省科学院天然产物重点实验室,河南 郑州 450002;3.河南省科学院地理研究所,河南 郑州 450052)
构树(Broussonetia papyrifera)又名楮桃树,桑科(Moraceae)构树属(Broussonetia)多年生落叶乔木,为雌雄异株植物,广泛分布于我国各地区[1]。构树叶氨基酸含量丰富,营养价值高,适口性好,具有易丰产、耐砍伐、适应性强等特点,可以作为优质的蛋白饲料原料[1-2]。2015 年构树扶贫被国家扶贫办列为十大精准扶贫工程,该工程采用中科院植物所培育的杂交构树以及其配套的产业化技术,重点在全国贫困地区实施杂交构树“林-料-畜”一体化畜牧产业扶贫,让我国养殖业看到了摆脱蛋白饲料依赖进口的希望[3]。构树不仅饲用价值高,且在饲料、造纸、医药、食品、绿化及生态修复等方面具有巨大的应用前景,如构树枝叶繁茂、根系发达,对防风固沙、固土保水有显著作用;构树叶片对NO2、Cl2、SO2具有较强的吸收净化能力;构树果实是一种富含维生素及矿质营养的野生水果资源。总的来说,构树是集生态、经济及社会效益于一身的多功能树种[4-5]。
优质的构树种苗生产是推进构树产业化发展的重要因素之一。构树常见的繁殖方式有种子繁殖、无性扦插繁殖、组织培养繁殖等,种子繁殖拥有苗木抗逆能力强、生长发育健壮等特点,缺点是变异系数大,不能保持母本的优良特性;扦插繁殖的特点是方法简单、繁殖系数高、繁殖材料来源广等,缺点是扦插苗的根系分布不均匀,且不发达;组织培养繁殖的特点是繁殖率高、遗传性稳定,缺点是生产成本高,多次继代易退化等。构树种苗繁育过程中,温度、光照、植物生长调节剂的种类等均对构树的繁殖有显著影响,针对不同的繁殖方式开展各类影响育苗成活率的因素,已成为构树科学研究新的关注点之一[6-8]。
目前,构树育苗技术方面的研究已有一些报道,但比较零散,还不完善,对构树育苗生产缺乏系统性指导。基于此,本文收集、整理了近10 余年来构树育苗的现状与研究进展,从播种、扦插、组织培养3 种常见的育苗方法入手分析影响构树育苗的主要因素,对播种育苗中常见的种子处理方法进行汇总,对组织培养中使用的消毒方法、培养基类型及植物生长调节剂浓度进行归纳总结,并对未来构树育苗相关研究提出了建议与展望,以期为构树的种苗生产和良种选育工作提供参考,也为我国构树的大面积推广种植提供借鉴。
1 播种育苗影响因素
种子萌发是一个涉及形态变化、生理生化及基因调控等复杂的物质代谢过程,除种子内在结构发育完全外,适宜的温度、水分和光照等也是种子萌发的必要条件,不同植物的种子形态结构存在差异,影响其萌发的主导因素因而不同[9-11]。
1.1 种子采收
适时采收是保证种子发芽率与发芽势的关键因素。构树的种子成熟期主要在8 月份,此时采收的构树种子发芽率最高,发芽势最好,而9 月的构树种子发芽率比8 月份降低[12]。闫东方等[13]以构树青果、微红果、红果和过熟果的种子进行催芽试验,结果显示红果的种子萌发效果最好、发芽率和发芽势分别为62.50%和25.83%,微红果的种子萌发效果较差,发芽率和发芽势分别为10.00%和5.00%,青果种子不萌发。此外,构树种子含水量较低、为11.20%,采集后若不及时播种,应干燥保存[14]。
1.2 种子处理
构树种子较小,种皮较硬,种子吸水能力弱,自然条件下萌发需40 d 左右,不利于构树种苗生产。构树种子经低浓度NaCl 溶液处理后可以提高萌芽率,浓度过高则会抑制构树种子萌发,种子发芽率、发芽指数和活力指数均出现下降现象[15-16]。也有研究表明,浓硫酸可促进构树种子萌芽,构树种子经浓硫酸腐蚀处理9 min 后,平均发芽率、发芽势和发芽时间分别为91.11%、48.89%和8.41 d,发芽效果最好[17]。外源激素浸种对构树种子的萌芽效果影响不同,6-BA 与GA3能不同程度地促进构树种子萌发,其中GA3促进作用最大,使用1600 mg/L GA3浸种24 h,构树种子萌发率达72.4%[18]。常见的构树种子处理方法见表1。
1.3 环境条件
构树种子是光中性种子,光照不是构树种子萌发的限制因子,构树种子在暗条件下可以正常萌发,但萌发后会出现茎徒长、子叶长出时间延迟等现象[18]。温度对构树种子发芽非常关键,适合构树种子的催芽温度是30 ℃,构树种子催芽的上限致死温度是40 ℃[17]。杨平等[20]研究结果显示,构树种子在水势0~-0.6 MPa 之间时可以萌发,种子萌发率和萌发速度随着水势下降出现降低,其中在水势0~-0.2 MPa 时萌发速度下降最快,对种子萌发影响最大,水势在-0.86 MPa 时种子萌发完全被抑制。
2 扦插育苗影响因素
扦插育苗是选用离体的枝、叶、根等植物部分营养器官作为材料,插入土壤、泥炭、蛭石等基质中,使其生根、发芽,生长为完整植株的育苗方法,具有繁殖速度快、方法简单、成本低等特点[21]。根据繁殖材料的不同可将扦插分为叶插、根插、枝插、芽插等,在构树的相关研究及应用中,枝插最为普遍。影响构树扦插繁殖的因素较多,主要包括插穗规格、插穗的处理、基质配比等[6]。
2.1 插穗规格
插穗的木质化程度、粗度及长度均不同程度影响植物扦插效果[21-24]。不同木质化程度的构树穗条扦插生根率存在差异:未木质化的穗条比半木质化与完全木质化的穗条生根状况好,其总根长、最长根长均为最好[25]。陈谭星等[6]的研究表明,插穗直径0.5~1.0 cm 半木质化穗条的构树扦插生根率及根系效果指数均显著大于1.0~1.5 cm(木质化穗条和0.3~0.5 cm 嫩枝穗条;王定胜[26]以4 种不同粗度规格的光叶楮插穗进行扦插繁殖,结果显示中等粗度的插穗平均不定根数量最多,插穗过粗或过细均会导致不定根数减少。总的来说,木质化高的插穗,由于其直径较粗,储存的营养物质较多,有利于插穗的生根,但木质化程度越高,分生能力越差,越难产生和形成不定根[27-28]。
2.2 处理方法
在育苗过程中,通常使用一些外源物质处理来调控插穗内含物的含量,进而减少抑制插穗生根物质的含量,达到提高扦插成活率的目的。大量研究表明,用不同浓度的植物生长调节剂处理穗条,可促进植物扦插生根,提高成活率[29-31]。陈谭星等[6]使用200 mg/L 的ABT 1 号生根剂处理杂交构树插穗30 min,插穗的生根率最高,生根效果最好;王定胜[26]以2 年生光叶楮插穗为试材,用600 mg/L 的IBA 处理插穗后,扦插生根效果最佳,生根率达92%,生根数量、平均根长及最长根长等生根指标均比其他浓度处理好;ABT 1 号生根剂在杂交构树扦插中的处理结果显示,扦插90 d 后,不同质量分数激素处理下插穗的生根率依次为0.02‰>0.5‰>0.4‰[25]。
2.3 基质选择
扦插基质是扦插苗水分的载体,也是营养和矿物质的来源,应根据树种选择相应的扦插基质[21]。构树无性系扦插试验结果显示,在纯黄心土(未耕种过)、黄土(耕种过)、水稻田土、火烧土4 种土壤中的穗条扦插生根结果存在显著差异,其中以火烧土作为扦插基质时生根率及生根数最高[32]。陈谭星等[6]使用扦插基质为33.33%珍珠岩+33.33%蛭石+33.33%草炭土时插穗生根率最高,最适合杂交构树扦插;王定胜[26]认为沙∶砻糠灰∶珍珠岩的体积比为1 ∶1 ∶1作为基质时,光叶楮扦插的生根率、平均根数、平均根长均为最优,扦插效果最好[26]。
3 组织培养育苗影响因素
植物组织培养是一种在无菌条件下,利用适宜的培养基对植物的器官、组织、细胞及原生质体等外植体进行离体培养,诱导其产生愈伤组织或潜伏芽等,以获得再生的完整植株的技术[33]。目前,研究人员已经利用构树不同部位的器官作为外植体建立了植株再生体系,在体细胞胚胎发生方面也进行了初步研究。利用组织培养繁殖法进行构树的种苗繁育,具有繁殖系数高、节省土地等优点,在组织培养育苗过程中,外植体消毒、培养基选择、植物生长调节剂应用、环境条件等均影响着种苗的成活率。
3.1 外植体消毒
无菌体系的建立是植物组织培养试验成功的关键[34]。构树全株密被绒毛,不利于外植体的消毒灭菌,消毒剂的选择及消毒时间是影响构树外植体灭菌效果的主要因素。从表2 可以看出,构树消毒剂主要为酒精+HgCl2,消毒时间5~15 min。前人研究表明,光叶楮的嫩茎基部采用70%酒精30 s+0.1%HgCl2(含吐温)8 min 消毒效果最佳[35];蒋泽平等[36]研究结果显示,光叶楮茎段(含叶柄)经75% 乙醇溶液浸泡杀菌30 s 后,再用0.1% HgCl2消毒15 min 效果最好,外植体成活率达53.6% ;田瑞等[37]以3 种消毒剂(2% NaClO、0.3% HgCl2和10% H2O2)及3 种灭菌时间(5、10、15 min)对带芽的杂交构树茎段进行处理,结果显示消毒效果最好的处理是75%乙醇溶液浸泡40 s 后再用0.3% HgCl2灭菌15 min,除菌率达68%。构树茎尖[38]、茎段[39]、下胚轴[40]及叶片[41]都可作为诱导增殖的外植体,不同的外植体来源,由于其自身因素(外植体生长程度、表面菌及内生菌)使其消毒时间、消毒剂的使用存在着差异,常见的外植体部位及消毒方法见表2。

表2 构树常用外植体及其消毒方法Table 2 Commonly used explants of paper mulberry and their disinfection methods
3.2 培养基及植物生长调节剂
器官发生途径和体细胞胚胎发生途径是两种常用的构树离体植株再生途径,两种途径均可通过直接和间接发生途径实现[46-47]。在器官发生与体细胞胚胎发生的直接与间接发生途径中,培养基和植物生长调节剂的选择是影响外植体再生的关键因素[48-49]。
3.2.1 体细胞胚发生途径 植物体细胞胚胎发生是指在特定条件下,植物体细胞未经性细胞融合而进行类似合子胚发育过程形成胚状体,最终发育成完整植株的过程,是一种可以快速有效、遗传相对稳定的植物扩繁方法。目前,已有学者对构树体细胞胚胎发生技术进行研究,集中在间接发生途径中,如周鹏等[39]在MS 基本培养基中分别添加TDZ、NAA 和2,4-D,从构树茎段诱导胚性愈伤组织及体胚,结果显示TDZ 是影响外植体胚性愈伤组织诱导的主要因素,NAA 是影响体胚诱导的主要因素,胚性愈伤组织、体细胞胚诱导的最佳激素组合分别为0.05 mg/L TDZ+1.0 mg/L NAA+0.1 mg/L 2,4-D 和0.1 mg/L NAA+1.0 mg/L 6-BA,体细胞胚诱导率达41.33%。构树嫩叶在含2,4-D 0.5 mg/L 的MS 培养基中7 d 左右出现愈伤且诱导率最高,达93%;愈伤组织继代在激素为2,4-D 0.2 mg/L 的MS 培养基(愈伤生长旺盛,松散,淡黄色)中进行;使用6-BA 2.0 mg/L+NAA 1.0 mg/L 的MS 培养基体胚诱导效率最高,胚胎发生率达17.9%[43]。培养基为MS+0.2 mg/L 6-BA+1.0 mg/L 2,4-D,pH 6.0,杂交构树叶片愈伤组织诱导率达94.6%,诱导效果最佳;最佳继代培养基为MS+0.2 mg/L 6-BA+0.1 mg/L KT,pH 6.2;选择表面颗粒多、质地松软、浅黄色或白色的愈伤组织进行体细胞胚诱导,最佳诱导培养基为MS+2.0 mg/L 6-BA+1.0 mg/L NAA,pH 6.4,体细胞胚的发生频率达到96.0%[50]。
3.2.2 器官发生途径 器官发生途径是利用植物器官脱分化产生愈伤组织再分化产生不定芽,或者直接从外植体上诱导不定芽培养成完整植株的过程[51]。这种途径具有周期短、易于操作、诱导率较高、能较好地保持母体遗传性等优点。
构树器官间接发生一般要经过愈伤组织诱导及不定芽分化、芽增殖及生根培养3 个步骤。从表3 可以看出,构树叶片及茎段均能作为外植体进行愈伤组织诱导进而完成间接器官发生。构树间接器官发生途径中,常用的细胞分裂素和生长素分别是6-BA 和NAA;愈伤组织的诱导、不定芽的分化及芽的增殖常用的基础培养基为MS,生根培养常用的基础培养基为1/2 MS。前人研究结果显示,光叶楮叶柄的再生能力明显强于叶片,生根培养时,1/2 MS 培养基的生根效果优于MS培养基[52]。
从已发表的研究结果来看,构树直接器官发生途径一般是用腋芽进行增殖进而实现快速繁殖,是优良无性系扩繁的有效途径(表3)。陶文丞等[53]以优良构树母株的幼茎为外植体,出芽率最高的培养基为MS+1.0 mg/L 6-BA+0.1 mg/L NAA,生根效果最好的培养基为1/2 MS+NAA 0.1 mg/L。万文等[8]研究结果显示,适宜杂交构树侧芽诱导的培养基为MS +6-BA 1.0 mg/L+NAA 0.1 mg/L,诱导分化率为94.4%;适宜试管苗增殖和生长的培养基为MS+6-BA 1.0 mg/L +GA0.2 mg/L,不定芽平均分化系数为3.3,平均苗高2.83 cm;在壮苗生根过程中培养基为1/2 MS+NAA 0.3 mg/L+IBA 0.5 mg/L+6-BA 0.01 mg/L 和1/2 MS+NAA 0.5 mg/L+IBA 0.1 mg/L+6-BA 0.01 mg/L时最适合壮苗生根,生根率均达100%[8]。直接器官发生途径快速繁殖常用的培养基组合见表3。
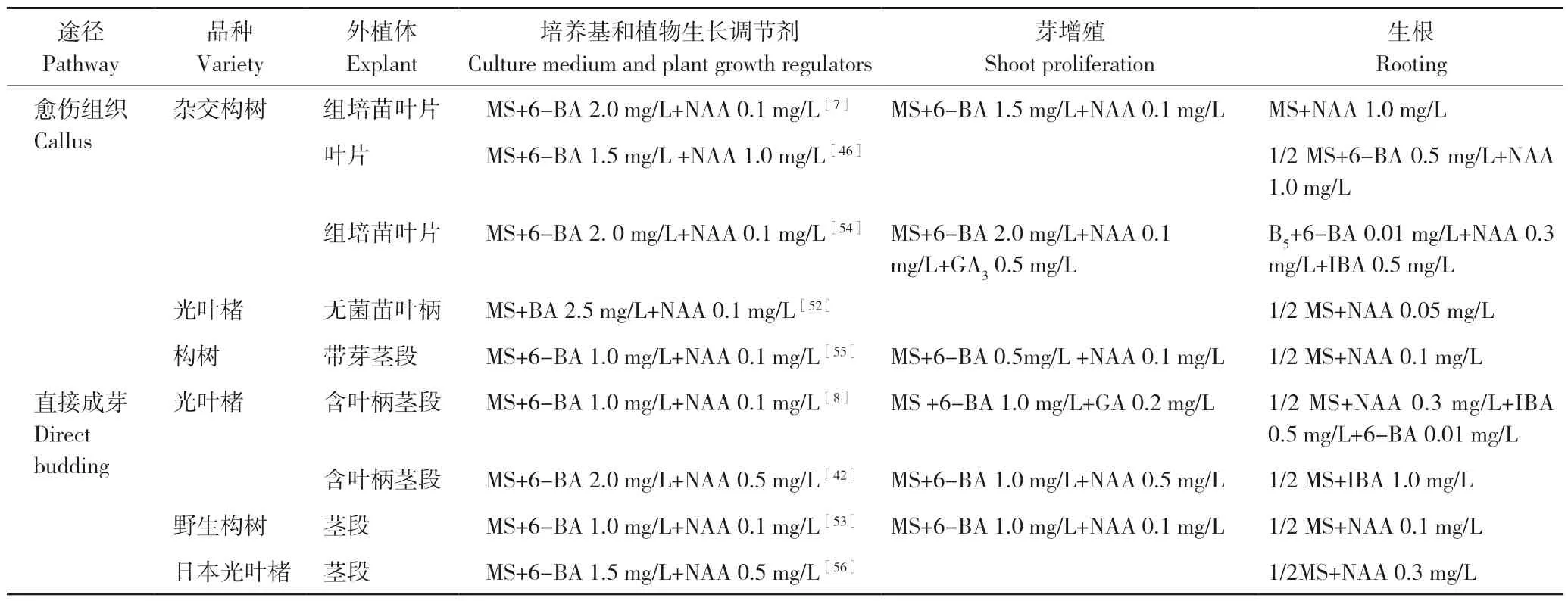
表3 不同品种构树芽增殖和生根培养基成分Table 3 Composition of culture medium for shoot proliferation and rooting of different varieties of paper mulberry
3.3 炼苗条件
炼苗时影响组培苗成活率的主要因素为温度和光照。当瓶苗生长至4~6 片叶、株高3~5 cm 时可出瓶移栽[53]。移栽前将瓶苗在自然光下炼苗2~3 d,随后将幼苗取出,置于清水中漂洗去除根部的培养基,栽植于体积比为珍珠岩∶蛭石∶草炭土=1 ∶1 ∶1 的基质中并覆盖塑料薄膜,幼苗移栽后要经常给叶片喷水。为保证植物恢复生长所需养分,可在有效移栽后用无机营养液喷施叶面,每隔3 d 喷1 次,15 d 后可移栽到苗圃,成活率达82.5%[39]。
4 展望
近年来,构树因其在饲用、造纸、食品及绿化等方面的价值而备受关注。种子繁殖常导致性状分离,增加遗传多样性,有利于构树品种选育工作。从现有文献来看,常规播种育苗技术日渐成熟,但有关构树育种的研究报道较为罕见,今后应加大构树育种的工作力度,建立构树种质资源圃,不断更新创造适合于各地区的优良构树品种。此外,国外已有学者初步建立了构树遗传转化体系[40],但有关此方面的研究依旧薄弱,应加强构树分子辅助育种研究,为构树的遗传改良提供依据。
目前,构树无性扦插繁殖技术已经在农业生产中大量使用,研究人员通过各类研究解决了构树扦插难生根的问题,大大提高了扦插生根率及成活率,但在扦插生根机理方面未能深入研究。构树组织培养虽建立了植株再生及茎段快繁体系,但生产实践上仍存在生产成本高、育苗周期长、多次继代易退化等一系列问题。因此,在今后研究中,一方面应大力度开展提高扦插生根率、减少成本及和缩短育苗周期等方面研究;另一方面,在构树组织培养技术各个环节进行深入研究,探索出一套优质、高效、经济的种苗繁育技术,为构树的大量繁殖和工厂化育苗提供支持。
