福建省3种养殖鱼食用健康风险评估
2021-04-23刘海新
刘海新
(福建省水产研究所,福建 厦门 361013)
福建省海岸线曲折,海水鱼养殖区大多分布于沿海港湾和河口附近水域。这些水域是沿海陆源污染物的主要堆积场所。工、农业污水和生活污水富含营养物质、有机农药、重金属等污染物随地表径流进入沿海,致使局部海域水质恶化。污染带来的重金属和持久性有机污染物(persistent organic pollutants,POPs)化学性质稳定、不易降解,长时间存在于水产养殖环境中。水生生物对这些污染物具有生物蓄积性的特点,鱼体内的污染物导致的食用安全风险,是水产品安全关注的重点。当前对水产品的风险评估多针对某项或某类污染物进行,仅反映水产品部分食用健康风险状况。本研究通过对福建省养殖的石斑鱼(Epinephelinae)、双斑东方鲀(Takifugubimaculatus)及大黄鱼(Larimichthyscrocea)中有相关标准限量要求及行业关注的持久性污染物含量进行分析比较,评估其总体风险状况,确定主要危害因子,对引导民众正确消费水产品、科学防范食用健康风险具有指导作用。
1 材料与方法
1.1 样品来源与测定
分别于2019年3月和10月,对福建省大黄鱼、石斑鱼和双斑东方鲀主产区大型养殖企业的养殖水体、饲料和成品鱼在同一地点重复采样。福建省石斑鱼养殖主要分布在闽南沿海,分别在漳州东山县和厦门小嶝岛大型工厂化石斑鱼养殖企业进行抽检,采样地点如图1所示S1和S2;福建省双斑东方鲀养殖主要集中在漳州市漳浦县,以池塘养殖为主,采样地点如图1所示H1和H2;福建省大黄鱼养殖主产区在宁德,以海水网箱养殖为主,在宁德三都澳周边海域对养殖大户进行抽检,采样地点如图2所示D1和D2。生物样品采集、制备按照GB/T 30891—2014《水产品抽样规范》[1]执行;水样采集按GB 17378.3—2007《海洋监测规范 第3部分:样品采集、贮存与运输》[2]执行;饲料样采集按照GB/T 14699.1—2005《饲料 采样》[3]执行。

图1 石斑鱼和双斑东方鲀采样地点示意图Fig.1 Map of sampling sites for Epinephelinae and Takifugu bimaculatus
图2 大黄鱼采样地点示意图Fig.2 Map of sampling sites for Larimichthys crocea
目前与海水鱼类中持久性污染物相关的质量标准主要有:(1)GB 2762—2017 《食品安全国家标准 食品中污染物限量》[4],限量污染物包括:无机砷、甲基汞、铅、镉、铜、石油烃和多氯联苯(polychlorodiphenyls,PCBs,以PCB28、PCB52、PCB101、PCB118、PCB138、PCB153和PCB180总和计);(2)GB 2763—2019 《食品安全国家标准 食品中农药最大残留限量》[5],限量农药包括:六六六(hexachlorocyclohexane,HCB,以α-六六六、β-六六六、γ-六六六和δ-六六六之和计)和滴滴涕(dichlorodiphenyltrichloroethane,DDT,以p,p′-滴滴涕、o,p′-滴滴涕、p,p′-滴滴伊和p,p′-滴滴滴之和计)。综合上述标准,确定本次监测生物体污染物为:无机砷、甲基汞、铅、镉、铜、石油烃、多氯联苯(以PCB28、PCB52、PCB101、PCB118、PCB138、PCB153和PCB180总和计)、六六六(α-六六六、β-六六六、γ-六六六和δ-六六六之和计)和滴滴涕(以p,p′-滴滴涕、o,p′-滴滴涕、p,p′-滴滴伊和p,p′-滴滴滴之和计),双斑东方鲀增加检测河豚毒素。
饲料和养殖水体作为养殖鱼污染物的主要来源,依据生物体风险评估得出主要风险因子,监测对应污染物在养殖水体和饲料中含量。国际上研究水产品中石油烃污染对人体健康影响,主要考察多环芳烃(polycyclic aromatic hydrocarbons,PAHs)各组分产生的风险[6],本研究对石油烃食用健康风险评估,也同样考察多环芳烃。相关污染物检测方法见表1。
1.2 食用健康风险评估方法
食品中化学污染物对人体健康风险评估主要包括:非致癌健康风险评估,评价指标为暴露边界值(margin of exposure,MOE),按(1)式进行计算;致癌健康风险评估,评价指标为致癌风险指数(carcinogenic risk index,CRI)[7],按(2)、(3)式进行计算。
M=Ci×CM/(Bw×RfD)
式(1)
式中:M为暴露边界值;RfD为污染物的参考剂量mg/(kg·day),见表2;CM为鱼日均消费量,采用水产品消费量大的厦门市[8],2018年人均年消费鱼类量为10.35 kg/year,折算每日人均消费量为28.36 g/day;Ci为鱼体内污染物含量(mg/kg);BW为平均人体体重,成年人取60 kg。
致癌风险指数先按(2)式计算每种致癌物的致癌风险指数,再按(3)式将所有致癌物的致癌风险指数加和得出总致癌风险指数。
Ri=Ci×CM×qi/BW
式(2)
式(3)
式中:Ri为各污染物的致癌风险指数;RTC为总致癌风险指数;qi为致癌斜率因子(kg·day/mg),各污染物致癌斜率因子见表2,其中多环芳烃各组分根据美国环境保护署(EPA)风险信息综合管理系统(integrated risk information system,IRIS)提供的数据,以苯并(a)芘的致癌斜率因子qi=7.30 kg·day/mg为基数,其他多环芳烃组分根据等效因子进行换算[9],结果见表2。
暴露边界值MOE≤1认为该污染物在食品中非致癌健康风险可接受;对于致癌风险指数美国环境保护署(EPA)提出了可接受风险的概念,根据不同地区的环境条件,科技和经济发展水平等,管理者和研究者提出不同的可接受风险,一般情况下总致癌风险指数RTC≤10-4认为致癌风险可接受[7,10]。
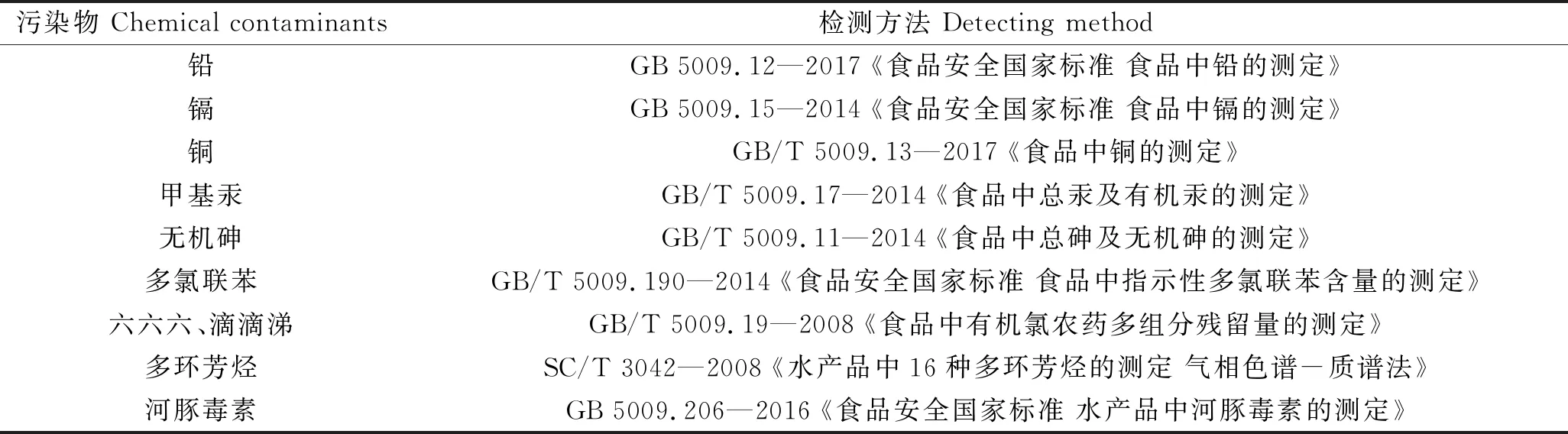
表1 鱼体内污染物检测方法Tab.1 The detecting methods of chemical contaminants in fish

表2 各污染物致癌斜率因子(qi)和参考剂量(RfD)Tab.2 Cancer slope factors(qi) and reference doses(RfD) of chemical contaminants
2 结果
2.1 持久性污染物在鱼体内浓度水平
3种养殖鱼体内铅、镉、铜、甲基汞、无机砷、多氯联苯、六六六和滴滴涕等8种污染物检测结果见表3,单个样品检测最大值分别为:2.80×10-2、6.20×10-3、0.54、0.15、未检出、9.08×10-3、2.12×10-3和9.07×10-4mg/kg,参照GB 2762—2017 《食品安全国家标准 食品中污染物限量》[4]、GB 2763—2019《食品安全国家标准 食品中农药最大残留限量》[5],均远小于限量值,双斑东方鲀均未检出河豚毒素。因此,所采集3种养殖鱼持久性污染物含量均符合标准要求。相关研究表明,鱼肉中汞绝大部分是以甲基汞形式存在[12],本研究以总汞检测结果作为甲基汞检测值。
各站点养殖鱼类多环芳烃各组分检测结果见表4。本研究多环芳烃检测采用SC/T 3042—2008《水产品中16种多环芳烃的测定 气相色谱-质谱法》,该方法于2008年发布,采用气相色谱质谱联用仪检测。近年来随着质谱技术的发展,仪器灵敏度有了较大提升。本研究采用2016年购置的美国Agilent 7890B-7010气质联用仪,仪器性能较2008年以前的气相色谱质谱联用仪有较大提升。本研究中多环芳烃检测结果,有些检测值虽然低于标准方法定量限,但在谱图上有较高响应值、峰形对称,结果可靠性高。同时,一般情况下低于定量限的检测结果在风险计算时以0值参与计算。本研究将低于标准方法定量限的结果参与计算风险值,采用0值的计算结果,一定程度上提高风险评估结果的安全系数。

表3 各站点鱼体内持久性污染物平均含量Tab.3 The average concentration of persistant chemical contaminants in fish from different sites mg·kg-1

表4 各站点鱼体内多环芳烃各组分含量平均值Tab.4 The average concentration of the PAHs components in fish from different sites mg·kg-1

续表4,Tab.4 Continued
2.2 持久性污染物非致癌健康风险评估
2.2.1 暴露边界值计算与评估
污染物非致癌健康风险评估主要依据污染物毒理实验得出参考剂量(RfD)。根据美国EPA的IRIS数据库查询,多环芳烃16种组分中仅有萘、苊、芴、蒽、荧蒽、芘和苯并(a)芘等7种组分提供了参考剂量值,其他组分由于尚无有效的数据支持,无法提供参考剂量值。因此对多环芳烃非致癌风险评估就针对这7种组分进行。
各站位所采集样品污染物平均检测结果见表3和表4。根据表2各污染物参考剂量,按(1)式计算暴露边界值(MOE),结果见表5。铅、镉、铜、无机砷、甲基汞、六六六、滴滴涕、多氯联苯和多环芳烃9种组分平均暴露边界值在2.53×10-6~0.136之间,均小于1,因此福建3种养殖鱼持久性污染物非致癌健康风险在可接受范围内。在所采集3种养殖鱼样品中,铅有88.9 %样品未检出、无机砷在所有样品中均未检出。根据世界卫生组织(WHO)推荐,在风险评估计算时对未检出样品应分别采用检测限和0值进行估算[13]。首先采用检测限进行计算,铅在石斑鱼、双斑东方鲀和大黄鱼体内MOE平均值分别为1.46×10-2、1.33×10-2和1.34×10-2;无机砷计算所得MOE平均值为0.126,均小于限量值1,因此不再讨论采用0值计算评估结果。
2.2.2 主要非致癌风险因子分析
铅和无机砷毒性较强,其RfD为7.1×10-4mg/(kg·day)和3.0×10-4mg/(kg·day),以检测限计算MOE为1.33×10-2和0.126,高于镉和铜MOE平均值,无机砷的MOE平均值甚至超过甲基汞。若以此分析主要风险因子将导致明显偏差。同时,由于采用无机砷标准方法检测限计算所得的MOE平均值较高,本研究对无机砷标准方法进行调整。取样量由1.00 g加大到5.00 g,最终定容体积由20 mL减少到10 mL。经本实验室验证,检测限可由0.08 mg/kg提升至0.01 mg/kg。以提升检测限后的方法检测,所有样品同样均未检出。以0.015 mg/kg的检测限计算MOE平均值为1.58×10-3,远小于1的限量值。因此在进行不同污染物MOE结果比较分析时,对铅和无机砷未检出样品采用0值进行计算。
通过对不同污染物MOE平均值比较见图3,3种鱼体内污染物MOE平均值较高的为多氯联苯和甲基汞,平均值在9.37×10-2~0.136之间。其他几个因子:镉、铜、六六六、滴滴涕和多环芳烃5种组分MOE平均值在2.53×10-6~1.38×10-3之间,远低于上述2个风险因子。因此,多氯联苯和甲基汞是这3种养殖鱼食用健康非致癌风险主要因子,应作为监控重点。
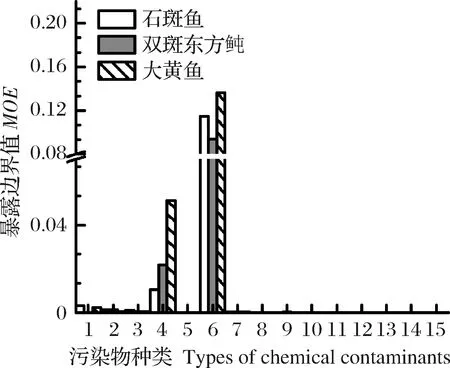
图3 鱼体内各污染物MOE平均值1.铅;2.镉;3.铜;4.甲基汞;5.无机砷;6.多氯联苯;7.六六六;8.滴滴涕;9.萘;10.苊;11.芴;12.蒽;13.荧蒽;14.芘;15.苯并(a)芘。Fig.3 The average MOE of chemical contaminants in fish1.Pb;2.Cd;3.Cu,4.Methyl mercury;5.Inorganic arsenic;6.PCBs;7.HCB;8.DDT;9.NA;10.AC;11.Fluorene;12.Anthracene;13.Fluoranthene;14.Pyrene;15.BaP.
2.3 持久性污染物致癌健康风险评估
2.3.1 致癌风险指数计算与评估
鱼体内具有致癌风险污染物包括:无机砷、多氯联苯、六六六、滴滴涕和多环芳烃等。无机砷在所有样品中均未检出,根据世界卫生组织(WHO)推荐,在风险评估计算时,对未检出样品应分别采用检测限和0值进行估算[13],先以检测限进行计算。采用(2)式和(3)式计算出各污染物致癌风险指数和总致癌风险指数,结果见表6。采用检测限计算致癌风险指数,各站位石斑鱼、双斑东方鲀及大黄鱼总致癌风险指数RTC在2.17×10-5~2.83×10-5之间,均未超过可接受风险水平10-4 [7,10],表明所抽检石斑鱼、双斑东方鲀和大黄鱼致癌健康风险均在可接受范围内。
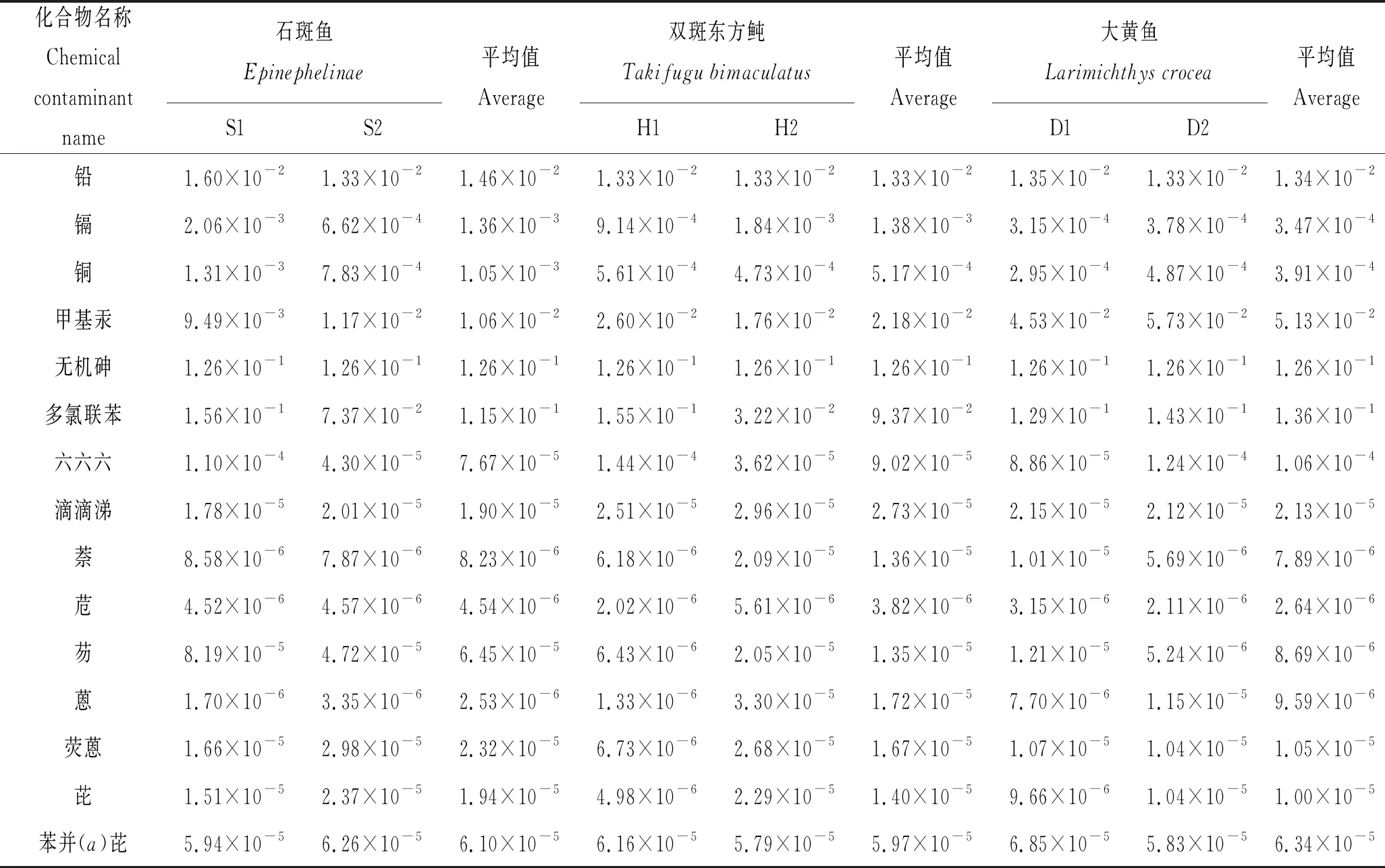
表5 各站点鱼体内持久性污染物平均暴露边界值(MOE)Tab.5 The average MOE of chemical contaminants in fish from different sites
2.3.2 主要致癌风险因子分析
无机砷在3种养殖鱼样品中均未检出,如果采用检测限计算其致癌风险指数为7.09×10-6,在石斑鱼、双斑东方鲀及大黄鱼总致癌风险指数RTC中占比为30.1%、31.5%和25.5%,超过多氯联苯、六六六和滴滴涕在总致癌风险指数RTC中占比。若以此分析主要风险因子将导致明显偏差。因此在进行不同污染物致癌风险指数比较分析时,对无机砷未检出的样品采用0值进行计算。
3种鱼体内各污染物致癌风险指数所占比例见图4,几种污染物对总致癌风险指数RTC贡献顺序为多环芳烃>多氯联苯>六六六>滴滴涕。多环芳烃对总致癌风险指数RTC贡献最大,分别为67.9%、70.3%和69.1%;多氯联苯对总致癌风险指数RTC贡献次之,分别为27.9%、24.3%和26.4%;六六六和滴滴涕对总致癌风险指数RTC贡献占较低,均不超过5%。因此多环芳烃和多氯联苯是石斑鱼、双斑东方鲀和大黄鱼食用致癌健康风险的主要因子,应作为监控重点。

图4 鱼体内各污染物致癌风险指数Ri值所占比例1.多氯联苯;2.六六六;3.滴滴涕;4.多环芳烃。Fig.4 The percentage of Ri of chemical contaminants in fish1.PCBs;2.HCB;3.DDT;4.PAHs.

表6 3种养殖鱼致癌风险指数Tab.6 Carcinogenic risk index for three kinds of farmed fish
3 讨论
3.1 3种养殖鱼体内各污染物累积
海洋生物对持久性污染物具有生物积蓄性的特点,3种养殖鱼体内重金属平均浓度在6.67×10-4~0.353 mg/kg之间;持久性有机污染物多氯联苯、六六六、滴滴涕和多环芳烃平均浓度在3.77×10-4~7.23×10-2mg/kg之间,鱼体内重金属累积浓度大于持久性有机污染物。从图5可见,鱼体内几种重金属平均累积量大小依次为:铜>汞>镉≈铅>无机砷;持久性有机污染物平均累积量顺序为:多环芳烃>多氯联苯>六六六>滴滴涕。污染物在鱼体内富集取决于所处海洋环境中污染物浓度、水体的含氧量、盐度、温度及pH值等理化因素和自身生理特性[14]。同时污染物间的协同、拮抗等复杂作用,也会影响污染物在水产品中富集程度[15]。因此造成不同鱼体内污染物浓度水平差异,是多因素综合作用的结果。
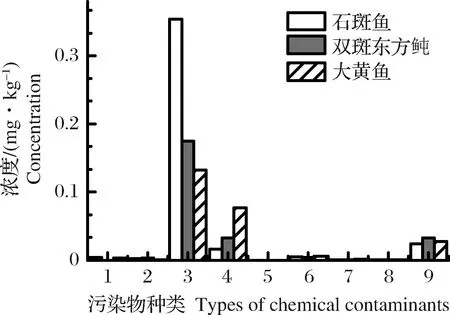
图5 鱼体内各污染物浓度平均值1.铅;2.镉;3.铜;4.甲基汞;5.无机砷;6.多氯联苯;7.六六六;8.滴滴涕;9.多环芳烃。Fig.5 The average concentration of chemical contaminants in fish1.Pb;2.Cd;3.Cu;4.Methyl mercury;5.Inorganic arsenic;6.PCBs;7.HCB;8.DDT;9.PAHs.
多氯联苯和多环芳烃为3种养殖鱼体中主要食用健康风险因子。这两种物质均为多种组分混合物,本研究对其各组分在鱼体所占比例做进一步探讨。多氯联苯为人工合成有机物,常作为热载体和绝缘液在工业中使用,环境中多氯联苯污染主要来源于使用多氯联苯工厂排出的废弃物。鱼体内多氯联苯各同系物组成分布情况如图6所示,其中六氯联苯占绝对优势,在石斑鱼、双斑东方鲀和大黄鱼中占总多氯联苯百分比分别为70.1%、63.3%和59.7%。其次为五氯联苯,占总多氯联苯百分比分别为15.6%、18.8%和27.9%。三氯、四氯、七氯和八氯联苯含量很低,合计占13.4%、17.9%和12.3%。鱼体内低氯取代物可代谢分解成二甲基砜等物质而快速分解[16]。相对于低氯取代物,五氯、六氯等中高氯原子个数的多氯联苯亲脂性高,更易富集于生物体内[17]。海洋环境中多氯联苯在细菌作用下还原脱氯,高氯联苯会降解成五氯或六氯原子的多氯联苯[18]。同时,高氯原子多氯联苯分子体积大,在透过生物细胞膜时受阻,以致生物体内积累少[19]。综上几个原因,五氯联苯和六氯联苯等多氯联苯在鱼体内富集程度高。本研究3种养殖鱼体内以中高氯原子数的多氯联苯蓄积为主的特点,与带鱼(Trichiuruslepturus)、马鲛鱼(Scomberomorusniphonius)[20]和太平洋牡蛎(Crassostreagigas)[21]体内多氯联苯蓄积特征类似。

图6 鱼体内PCBs同系物组分所占比例Fig.6 The percentage of PCBs components in fish
多环芳烃广泛存在于环境中,物理化学性质稳定、难降解,易在生物体内富集,是自然环境中持久性有机污染物的主要代表[22]。监测3种养殖鱼体内不同环数组分多环芳烃所占比例见图7,三环多环芳烃占绝大多数,在石斑鱼、双斑东方鲀和大黄鱼体内占总多环芳烃百分比分别为65.8%、76.3%和77.7%。3种养殖鱼体内低环数多环芳烃所占比例高的情况与金色小沙丁鱼(Sardinellaaurita)、斑鰶(Konosiruspunctatus)[23]、鲫(Cruciancarp)[24]和罗非鱼(Tilapias)[25]等鱼相类似。生物体中多环芳烃含量,受各组分生物利用性、体内代谢特征、生物摄食习性及栖息环境污染特征影响。通常辛醇-水分配系数(Kow)相对较小的低环多环芳烃容易溶于水中,而Kow相对较大的高环多环芳烃更倾向于吸附在悬浮颗粒物和沉积物中,一般与底泥直接接触的底栖动物体内高环多环芳烃比例高于与水体直接接触的水生生物[23]。鱼类主要通过鳃和表皮直接吸收以及消化系统摄入被污染的食物和悬浮颗粒物积累多环芳烃[24]。鱼类通过鳃和表皮对水中低Kow的多环芳烃组分摄取有利于低环多环芳烃富集;鱼体通过消化道同化作用和生物转化作用,对高Kow的多环芳烃组分富集相对较弱,使高环多环芳烃在鱼体内蓄积量明显减少[26-27]。本研究结果表明,在不同品种养殖鱼之间,高、中、低环多环芳烃组分占比差别不大。可能是由于所采集石斑鱼为水泥池养殖、大黄鱼为海水网箱养殖,这两种养殖模式使得鱼与沉积物接触少;双斑东方鲀虽然为土池养殖,但河豚主要在中上层水体中活动,与沉积物接触也较少。因此,这3种鱼由环境蓄积多环芳烃主要来源于水体,导致3种鱼在多环芳烃累积分布上趋同。
生物体中多环芳烃的来源分析可采用比值法,包括轻重组分比(LMW/HMW)、同分异构比值如PHE/AN、AN/(AN+PHE)、FA/(FA+PY)、BaA/(BaA+CHR)等[28]。由于AN与PHE相对容易分解,从而改变信息源[10],因此,本研究采用FA/(FA+PY)、BaA/(BaA+CHR)分析3种养殖鱼体内多环芳烃的来源。当FA/(FA+PY)小于0.4时,表示石油类排放来源,大于0.5表示木、煤等燃烧来源,位于0.4与0.5之间则表示石油及其精炼品燃烧来源;当BaA/(BaA+CHR)小于0.2时,表示石油排放来源,大于0.35表示高温燃烧来源,位于0.2与0.35之间则表示石油排放与高温燃烧混合来源[24]。由图8可见,木、煤燃烧是3种养殖鱼多环芳烃的主要来源,同时3种养殖鱼类也都受到石油排放、混合源、高温燃烧的污染。这与3种养殖鱼养殖地点均在沿海,生活污染源与工业污染混杂,机动车及船舶的尾气排放、油料泄漏及相关人类活动等均造成不同程度的多环芳烃污染。

图7 鱼体内PAHs各组分所占比例Fig.7 The percentage of PAHs components in fish
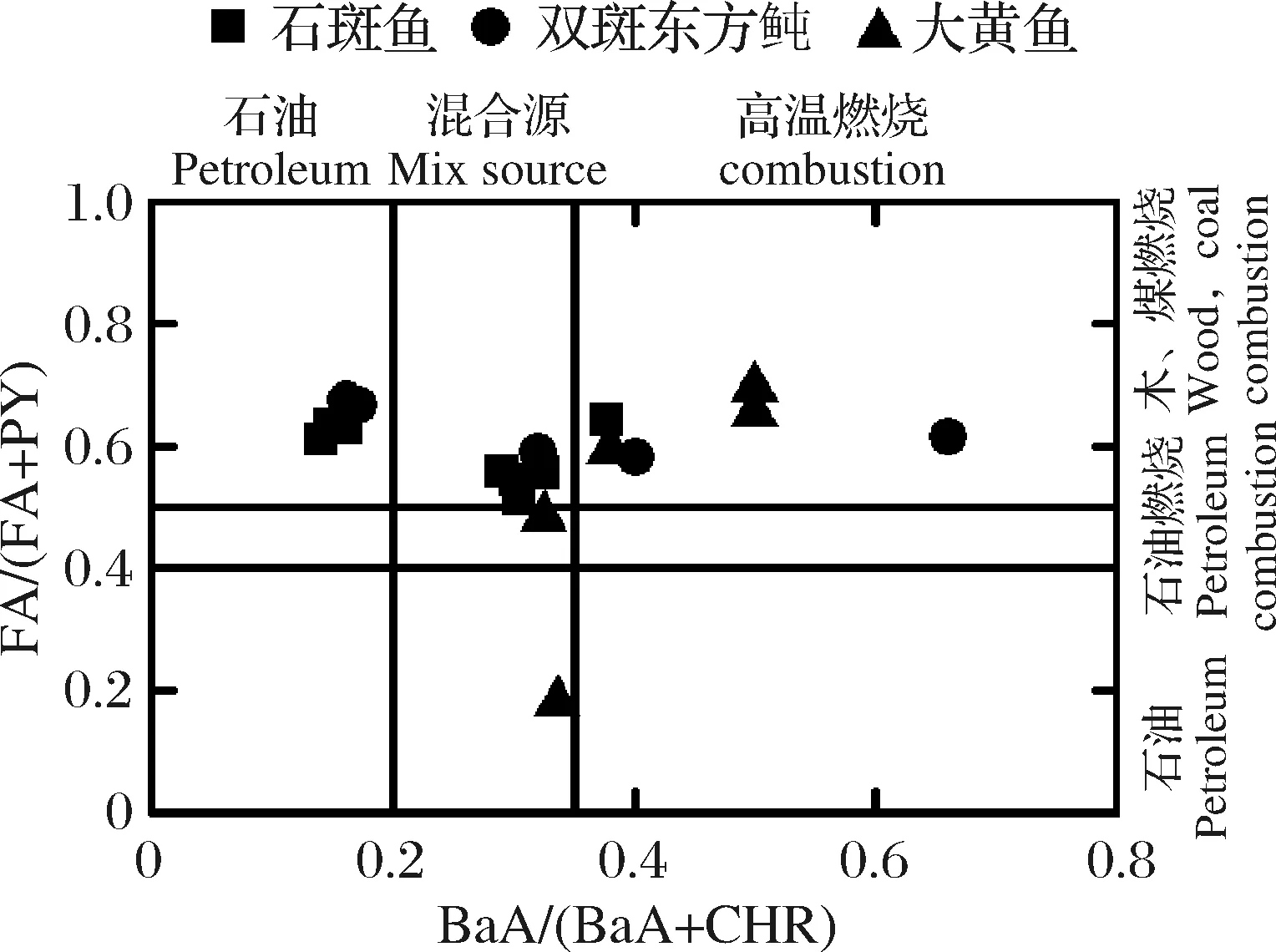
图8 3种养殖鱼体内多环芳烃来源解析Fig.8 Source identification of PAHs in three kinds of farmed fishes
3.2 3种养殖鱼体内各风险因子分布
3.2.1 非致癌健康风险因子分布
3种养殖鱼体内重金属MOE平均值顺序为甲基汞>镉>铜>铅>无机砷,与重金属在3种鱼体内蓄积浓度顺序不一致,主要是由于几种重金属的每日参考摄入量(RfD)差别较大所致。3种鱼体内重金属非致癌风险较高的因子为甲基汞,石斑鱼、双斑东方鲀和大黄鱼MOE平均值分别为1.18×10-2、2.05×10-2和5.13×10-2。鱼类对汞排出速度极为缓慢,半衰期长,容易在体内蓄积,并主要以甲基汞形式存在[12];镉在石斑鱼、双斑东方鲀和大黄鱼体内MOE平均值分别为9.21×10-4、1.21×10-3和3.47×10-4,比汞风险低1~2个数量级。水生生物对镉有富集能力,主要以镉金属硫蛋白(Cd-MT)形式存在,另外镉也可以与氨基酸、卟啉和核苷等小分子物质结合或以游离形式(Cd2+)存在[29];由于铜是生命必需元素,有较高的允许摄入量,MOE平均值分别为1.05×10-3、5.17×10-4和3.91×10-4。虽然铜在鱼体内浓度水平高,但其非致癌健康风险并不突出;铅在所采集双斑东方鲀体内均未检出,在石斑鱼和大黄鱼样品中也只有少部分样品检出,石斑鱼、双斑东方鲀的MOE平均值分别为2.99×10-3和2.33×10-3。鱼体内铅积累主要是与血红蛋白结合成血浆铅,铅能够透过细胞膜并进入中枢神经系统、肝、肾和其他器官中,同时铅也会沉积在骨骼、牙齿等硬组织中[30];鱼体内砷主要以无毒或低毒的有机砷形式存在,毒性大的无机砷含量较低[31]。本研究检测鱼体内均未检出无机砷,因此该因子不构成食用健康风险。
海洋生物对多氯联苯、六六六、滴滴涕和多环芳烃等持久性有机污染物的吸收和累积,一般认为是摄食了含有机污染物的食物,经酶转化、吸收,进一步在体内浓缩[32]。同时,有机污染物还可以通过海水进入生物体内,在血脂和其他类脂与海水之间建立某种化学平衡[33]。在所监测的几种持久性有机物中,非致癌风险顺序为:多氯联苯>六六六>滴滴涕>多环芳烃的7种组分(萘、苊、芴、蒽、荧蒽、芘和苯并(a)芘)。持久性有机污染物中多氯联苯非致癌风险远高于其他几种有机物,石斑鱼、双斑东方鲀、大黄鱼的多氯联苯MOE平均值分别为0.115、9.37×10-2和0.136,六六六、滴滴涕和多环芳烃3种组分的MOE平均值范围在2.53×10-6~1.06×10-4,远低于多氯联苯。
3.2.2 致癌健康风险因子分布
石斑鱼、双斑东方鲀和大黄鱼平均总致癌风险指数分别为:2.36×10-5、2.25×10-5和2.77×10-5,绝对值差别不大,因此这3种养殖鱼体内污染物致癌健康风险基本相同。多环芳烃和多氯联苯均对总致癌风险指数贡献较大,六六六、滴滴涕对总致癌风险指数贡献过低,比较讨论意义不大。
多氯联苯各组分的致癌斜率因子相同,各组分对总风险指数的贡献与浓度正相关。这与多环芳烃不同组分对致癌风险指数贡献有所差异。由图7和图9可知,3种鱼体内主要蓄积以三环多环芳烃为主,而对总致癌风险指数贡献大的主要为五环多环芳烃,虽然五环多芳烃其浓度仅占总多环芳烃的6.06%~9.05%,但其对多环芳烃所产生致癌风险指数贡献达90.9%~96.7%。这主要是由于多环芳烃各组分致癌斜率因子差别大,苯并(b)荧蒽、苯并(k)荧蒽、苯并(a)芘、二苯并[a,h]蒽等4个五环多环芳烃,其致癌斜率因子分别为0.73、0.73、7.30和36.50 kg·day/mg,而二环、三环、四环和六环多环芳烃中除四环的苯并(a)蒽和六环的茚并(1, 2, 3-cd)芘致癌斜率因子为0.73 kg·day/mg外,其他多环芳烃致癌斜率因子值分别为7.3×10-3kg·day/mg和7.3×10-2kg·day/mg,详见表2。五环多环芳烃致癌斜率因子远高于其他组分多环芳烃,导致其对总致癌风险的贡献度大。本研究中鱼体内五环多环芳烃大部分检测结果虽然低于标准方法定量限,但在采用这些数据进行风险计算时,已表现出对风险贡献大的特性。鉴于目前检测仪器性能有较大提升,为提高风险评估的准确度,建议修订现行的标准方法,提高标准检测方法的灵敏度。

图9 3种养殖鱼体内PAHs各组分致癌风险指数Ri值所占比例Fig.9 The percentage of Ri for PAHs components in three knids of farmed fishes
3.3 3种养殖鱼体内主要风险因子与环境和饲料的相关性
通过上述持久性污染物食用安全风险分析,可知3种养殖鱼体内主要食用安全风险因子为甲基汞、多氯联苯和多环芳烃。生物体内这些持久性污染物蓄积程度与环境、饲料污染状况和生物种类等多种因素有关。本研究对鱼体内污染物浓度与环境、饲料中污染物含量进行了相关性分析,计算结果见表7。这3个风险因子在养殖鱼体内浓度与养殖水体中含量的相关性不显著(P>0.05),因此这两者间不存在显著性相关;多氯联苯和多环芳烃在养殖鱼体内浓度与饲料中含量的相关性不显著(P>0.05),因此这两者间也不存在显著性相关。养殖鱼体内汞浓度和饲料中汞含量的相关性显著(P<0.05)、皮尔森相关系数(PearsonCorrelation)为0.952 9,从数据分析上存在相关性。由图10可见,大部分数据点在低浓度区域随机分布,2个高浓度点数据使得两者间表现出相关性。饲料中汞限量值为0.5 mg/kg[34],本研究饲料中汞最大检测值为0.043 mg/kg,符合标准限量要求,但饲料中汞含量与生物体内汞累积已表现出显著相关性。因此,选用汞含量较低的饲料,对控制养殖鱼类汞食用健康风险可能有一定的效果。
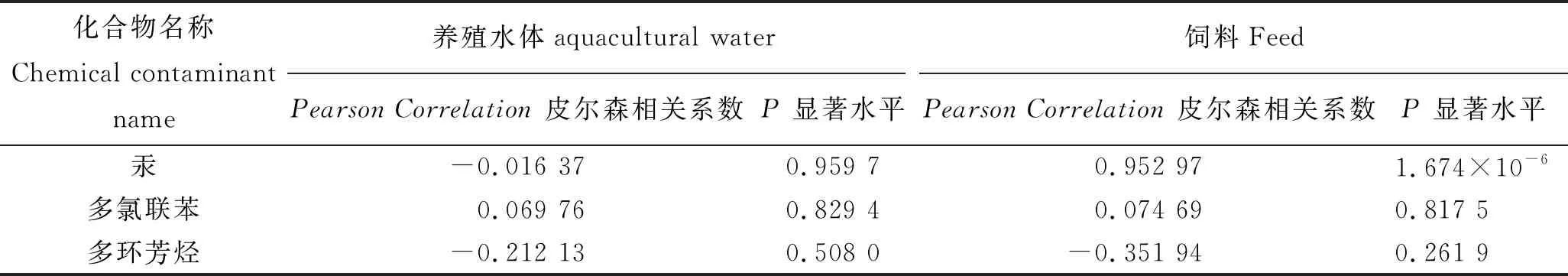
表7 95%置信水平下鱼体内主要风险因子与养殖水体和饲料相关系数Tab.7 The correlation coefficient of major risk factors in fish,aquacultural water, and feed at 95% confidence level
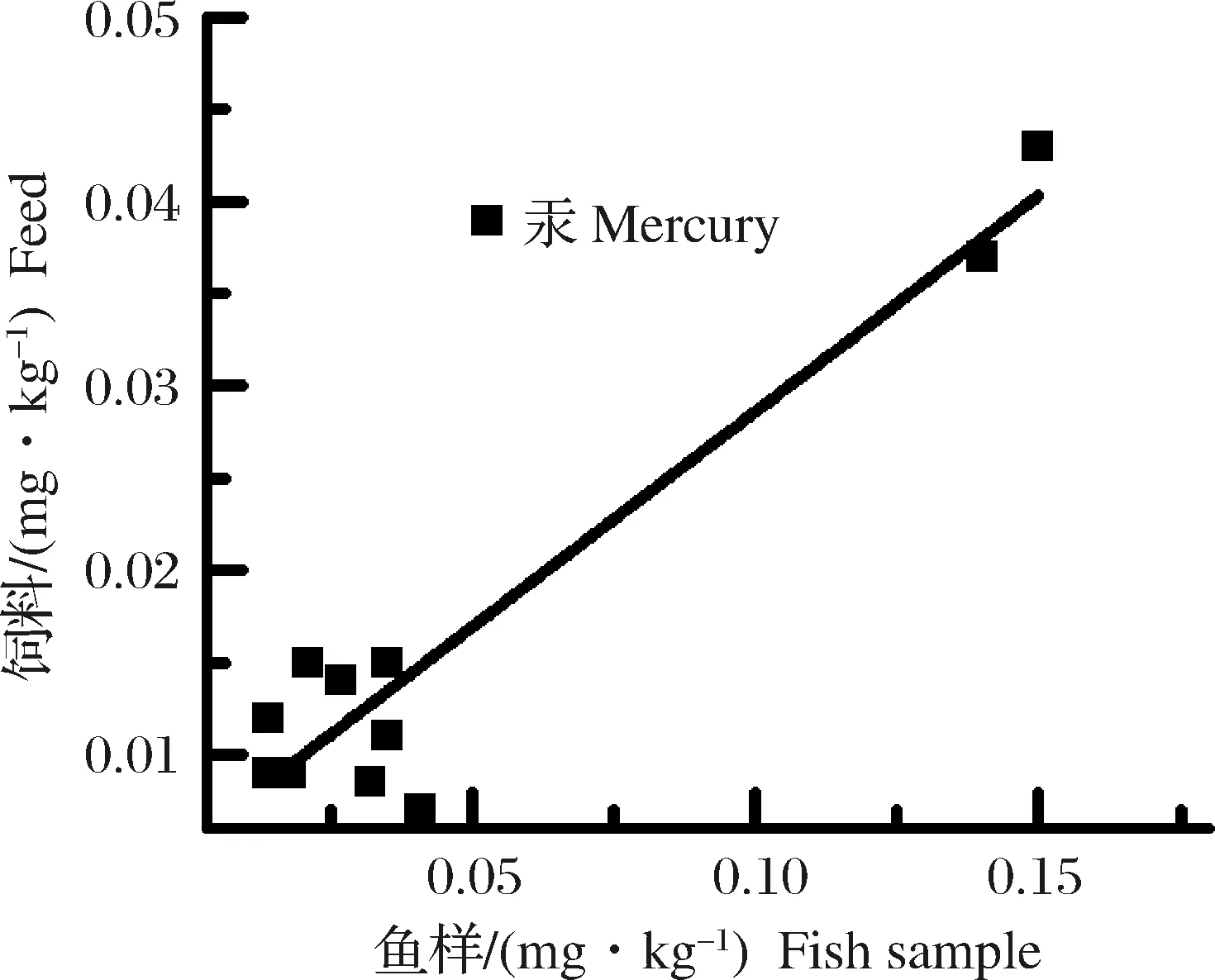
图10 鱼体内汞与饲料中汞相关性Fig.10 The correlation between mercury in fish and mercury in feed
4 结论
采用暴露边界值和致癌风险指数评估福建省养殖石斑鱼、双斑东方鲀和大黄鱼食用健康风险,按照中国现有环境条件、科技和经济发展水平,其食用健康风险在可接受范围内。通过对几种污染物食用安全风险值的比较,多氯联苯和甲基汞暴露边界值较高;多环芳烃和多氯联苯对总致癌风险指数贡献大,因此,甲基汞、多环芳烃和多氯联苯应是这3种养殖鱼食用健康风险监控重点。
相关研究表明外界污染物浓度水平通常会对鱼体内污染物累积产生影响[23,30,35]。本研究得出鱼体内主要风险因子在养殖水和饲料中含量与鱼体的累积无显著相关性的结果。除了生物自身的生理特征外,本研究认为可能与本研究的污染物在养殖环境和饲料中浓度较低有关。外界污染物低浓度水平还不足以对生物体累积产生显著性影响。因此,外界相关污染物浓度与养殖鱼体内的累积关系还需做进一步研究。
