多种因素对小鼠卵母细胞体外受精效果影响的分析
2021-04-23张景锋郝京京徐秋良朱宽佑张长兴
张景锋,郝京京,徐秋良,朱宽佑,牛 晖,张长兴
(1.河南牧业经济学院 动物科技学院,河南 郑州 450046;2.河南省畜禽遗传资源保护工程技术研究中心,河南 郑州 450046)
体外受精是指哺乳动物的精子和卵子在体外人为控制的环境中完成受精过程的技术。这项技术于20世纪50年代取得了成功,该技术在濒危动物和优良家畜品种的后代续繁、性别控制、品种资源保存等方面的应用具有重大意义,最大优点是能够打破时间和空间限制[1-3]。鉴于此,科研人员模拟卵母细胞在体内受精和胚胎发育的情况,研究获得高受精率和高胚胎发育率的方法,从而提高体外受精的效果[4-5]。在不同激素对卵母细胞体外受精的影响方面,有研究者提出促卵泡素(FSH)和胰岛素对小鼠卵母细胞体外成熟有提高作用,并且胰岛素的效果要比FSH的效果更加好,但是对于体外受精率,胰岛素添加组要比FSH组低4.6%[6-7]。李凯等[8]研究结果显示,小鼠卵母细胞经过1 000 ng/mL雌二醇处理后,卵裂率低于其它试验组,这种现象的出现可能是因为高浓度的雌激素对小鼠卵母细胞的受精能力有抑制作用。在不同添加剂对卵母细胞体外受精的影响方面,有学者提出牛血清白蛋白(BSA)具有降低小鼠体外受精率的作用,认为卵母细胞透明带在含有BSA的体系中发生硬化[9]。郭勇等[10]研究结果证明人的重组促黄体生成素(r-hLH)对小鼠卵母细胞的体外受精有明显的促进作用, 同时对相应胚胎进一步发育产生明显的抑制作用。朱佳伟等[11]研究结果显示半胱氨酸和胱氨酸通过促进小鼠体外成熟卵母细胞合成谷胱甘肽(Glutathione,GSH)的方法提高受精率,这种提高与浓度有很大的关系,并且只有在200 μM才能显著提高,更高浓度具有相反的效果。安铁洙等[12]研究结果表明在M16培养液中添加EDTA和L-谷氨酰胺后,小鼠卵母细胞体外受精率有了明显的提高,由原来的26%提高到51%,并且进一步指出这种现象可能是由于EDTA与某些金属离子发生螯合作用的结果,而谷氨酰胺一般被认为是胚胎发育48 h内的主要能源物质。沈维干等[13]提出氟化钠具有明显的生殖毒性,其对卵母细胞的成熟具有破坏作用,同时还会降低卵母细胞的受精能力。在不同操作方法对卵母细胞体外受精的影响方面,研究者将卵母细胞分为卵丘卵母细胞、裸卵和人为操作的裸卵(即机械裸卵),其中裸卵的体外受精率要比卵丘卵母细胞复合体的体外受精率高。同时,其它研究也证明卵丘和透明带对卵母细胞体外受精起重要的作用[14-15]。但在体外受精相关研究中,由于试验方法和培养液等条件的不同,试验过程中卵裂率也不尽相同,所以本试验研究不同精子获能时间,精卵孵育时间,精子密度以及颗粒细胞等条件对卵母细胞体外受精的影响,从而探索和优化小鼠卵母细胞体外受精及早期胚胎发育的最适环境。
1 材料与方法
1.1 试验动物
本试验所用试验动物为昆明系小白鼠,SPF等级,22~25 g雌鼠,共30只,8~10周龄雄鼠,共10只,购置于郑州大学试验动物中心。
1.2 主要试剂和仪器
1.2.1 主要试剂 矿物油(M8410,500 mL)、透明质酸酶购自Sigma;孕马血清促性腺激素PMSG购自宁波第二激素厂;卵母细胞体外成熟培养液(M2)、精子获能液(HTF)、体外受精液(TYH)、胚胎培养液(KSOM)购自南京爱贝生物科技有限公司;PBS、M199(含Hepes)购自GIBCO;四孔板购自NUNC;塑料细胞培养皿(35 mm)、塑料细胞培养皿(60 mm)购自NEST;一次性针头滤器(0.22 μM)购自Millipore。
1.3 小鼠卵母细胞的体外成熟
选取健康未孕的昆明系雌性小鼠,采用腹腔注射方法注入孕马血清促性腺激素(PMSG),每只小鼠注入10 IU,48 h后颈部脱臼法处死小鼠,剪开腹腔并摘取卵巢。卵巢首先放入PBS中洗去血液和脂滴,再放入提前准备好的体外操作液M199(含Hepes)中,整个操作在37 ℃恒温板上进行;用1 mL注射器针头刺破卵巢表面的卵泡,释放出卵母细胞。在体式显微镜下用吸卵针挑选出形状规则,胞质均匀的GV期卵母细胞,包括带有颗粒细胞的卵母细胞(COCs)和不带颗粒细胞的卵母细胞(NO),在卵母细胞体外成熟培养液M2中洗2~3次,放入提前做好的M2培养液液滴中洗2~3次,最后放入37 ℃、5% CO2培养箱中培养14 h后,排出第一极体的体外成熟卵母细胞进行后续的体外受精试验。
1.4 小鼠卵母细胞的体外受精
1.4.1 小鼠精子的采集和体外获能 选取健康的昆明系雄性小鼠,将小鼠颈部脱臼致死,将睾丸,附睾和输精管一起剪下,放入提前备好的PBS中清洗,洗去脂滴和血液,并使附睾和输精管与睾丸分离,附睾和输精管放入提前平衡好的300 μL HTF中,撕碎附睾和输精管,而后放入CO2培养箱孵育10 min,使精子游出。精子游出后,HTF中的碎组织剔除后离心,离心时间为3 min,2 000 r/min。离心完毕,弃去上清液,在离心管中加入已经平衡好的200 μL HTF,然后放入37 ℃,5% CO2细胞培养箱中进行精子的体外获能,根据不同的获能时间分为40 min、60 min和80 min三个试验组。上述过程均需要在37 ℃恒温板上进行。
1.4.2 小鼠卵母细胞和精子的孵育 将获能完成后的精子进行离心,时间为3 min,2 000 r/min。离心后弃去上清液,在沉淀物中加入提前平衡好的TYH,混合均匀后调整精子密度,根据不同的精子密度分为3×105个/mL、3×106个/mL和3×107个/mL三个试验组;将体外成熟的卵母细胞COCs和NO分别在TYH中洗2~3次,移入含有精子的TYH中,然后放入37 ℃,5% CO2的细胞培养箱进行体外受精,根据不同的受精时间分为2 h、4 h、6 h、8 h四个试验组。整个操作过程均需在37 ℃恒温板上进行。
1.4.3 小鼠早期胚胎的培养 卵母细胞和精子在TYH中分别培养2 h、4 h、6 h、8 h后,将受精后的卵母细胞从TYH中移出,用预热过的KSOM中洗2~3次,移入平衡好的KSOM中,培养24 h后观察受精卵卵裂情况,并计算卵裂率。
1.5 数据分析
试验数据用SPSS22.00软件进行分析,数据用“平均值±标准差”表示,采用F检验对试验结果进行差异显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 精子获能时间对小鼠卵母细胞体外受精的影响
由表1可以看出,在COCs体外受精试验中,精子获能时间40 min、60 min、80 min的试验组间受精卵卵裂率没有显著差异,精子获能时间80 min试验组受精卵卵裂率最高。在NO体外受精试验中,精子获能时间60 min试验组受精卵卵裂率最高,获能时间80 min试验组卵裂率最差。精子获能时间60 min试验组与精子获能时间40 min试验组间无显著差异,与精子获能时间80 min试验组间存在显著差异(P<0.05)。综上所述,精子获能时间对NO的卵裂率存在一定影响,精子获能时间为60 min试验组的卵裂率最高,精子获能时间对于COCs卵裂率不存在显著影响。
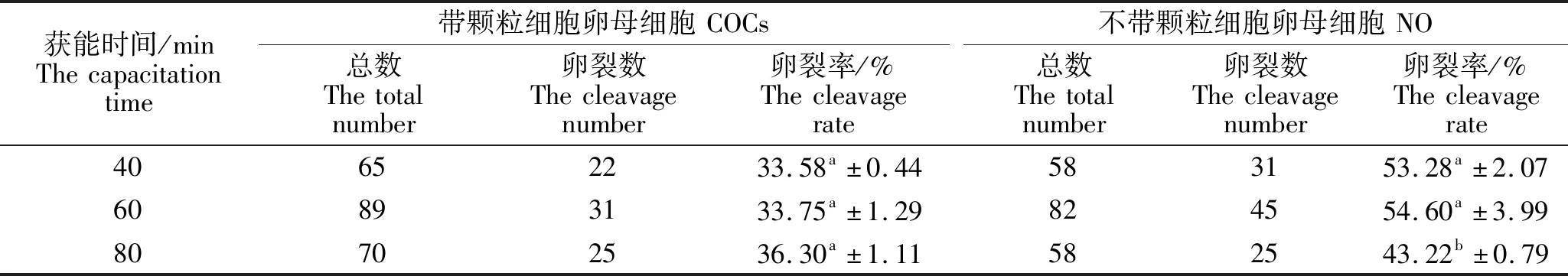
表1 精子获能时间对小鼠卵母细胞体外受精的影响Table 1 Effect of the sperm capacitation time on mouse oocyte fertilization in vitro
2.2 精卵孵育时间对小鼠卵母细胞体外受精的影响
由表2可以看出,在COCs体外受精试验中,精卵孵育时间为2 h的试验组,受精卵卵裂率最高,与精卵孵育时间4 h、6 h试验组间均没有显著差异。精卵孵育时间为8 h的试验组,受精卵卵裂率最低。精卵孵育时间2 h、4 h、6 h试验组与精卵孵育时间8 h试验组间存在显著差异,且受精卵卵裂率显著高于精卵孵育时间8 h试验组(P<0.05)。在NO体外受精试验中,精卵孵育时间为6 h试验组的卵裂率最高,与精卵孵育时间2 h试验组间没有显著差异,与精卵孵育时间4 h差异显著(P<0.05),与8 h试验组间存在极显著差异(P<0.01),而且精卵孵育时间8 h的试验组中受精卵卵裂率最低。综上所述,精卵孵育时间对小鼠卵母细胞体外受精结果存在影响,COCs体外受精结果显示精卵孵育时间2 h获得的效果最好,NO的精卵孵育时间为6 h时效果最好。
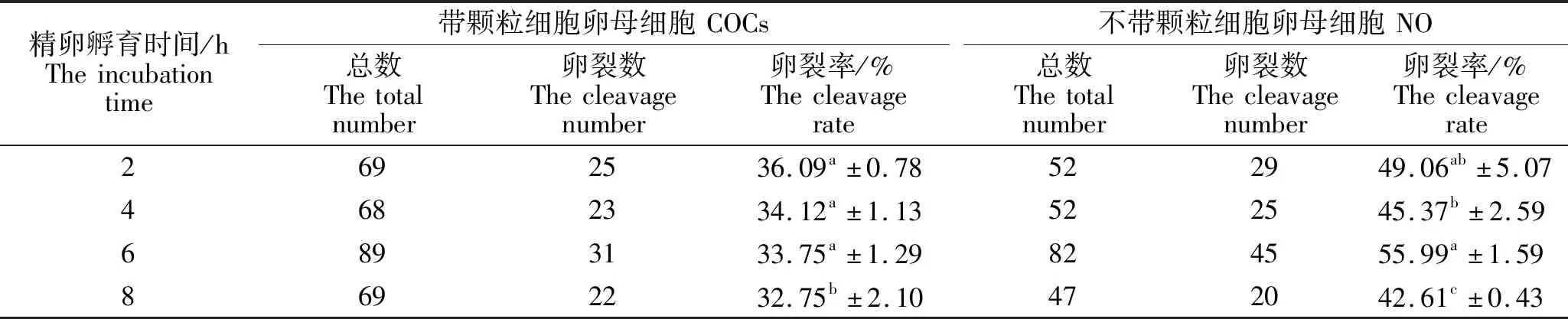
表2 精卵孵育时间对小鼠卵母细胞体外受精的影响Table 2 Effect of sperm-egg incubation time on mouse oocyte fertilization in vitro
2.3 精子密度对小鼠卵母细胞体外受精的影响
由表3可以看出,在COCs体外受精试验中,精子密度3×105/mL试验组的受精卵卵裂率最高,精子密度为3×105/mL试验组与精子密度为3×106/mL试验组之间没有显著差异,精子密度为3×107/mL试验组与精子密度3×106/mL试验组、精子密度3×105/mL试验组间存在显著差异(P<0.05),显著低于精子密度为3×106/mL和精子密度为3×105/mL试验组的受精卵卵裂率。在NO体外受精试验中,精子密度为3×106/mL试验组的卵裂率最高。精子密度3×106/mL试验组的卵裂率显著高于精子密度3×105/mL试验组(P<0.05),而且极显著高于精子密度3×107/mL试验组(P<0.01)。综上所述,精子密度对于卵母细胞卵裂率有影响,NO和COCs体外受精过程中,均是当精子密度为3×106/mL时,受精卵的卵裂效果最好。

表3 精子密度对小鼠卵母细胞体外受精的影响Table 3 Effect of sperm density on mouse oocyte fertilization in vitro
2.4 颗粒细胞对小鼠卵母细胞体外受精的影响
由表4可以看出,在小鼠卵母细胞体外受精过程中,NO的卵裂率与COCs的卵裂率之间存在显著差异(P<0.05),NO的卵裂率要显著高于COCs的卵裂率。

表4 颗粒细胞对小鼠卵母细胞体外受精的影响Table 4 Effect of granulose cells on mouse oocyte fertilization in vitro
3 讨 论
在卵母细胞体外受精过程中,将获能后的精子与体外培养成熟的卵母细胞进行精卵孵育时发现,在COCs体外受精过程中,精卵孵育2 h试验组的卵裂率最高,达到36.09%;在NO体外受精过程中,精卵孵育6 h试验组的卵裂率最高,达到55.99%。而江楠等[16]研究小鼠卵母细胞体外受精的结果显示精卵共孵育2 h时,受精率达到85.4%,囊胚形成率达到75.6%。与本研究结果相差20%,对比之后发现原因可能是由于精子体外获能液与受精液不同所造成的。本文所用的精子获能液为TYH获能液,体外受精液为HTF,而江楠等[16]在卵母细胞培养,精子获能,体外受精以及胚胎早期培养时所用培养液均为HTF,并且在培养液中添加了牛血清清蛋白,计量为4 g/L。在 HTF体外受精液含有高钙配方,这可能是造成出现上述结果的原因。
在研究颗粒细胞对小鼠卵母细胞体外受精的影响过程中,将培养成熟后的卵母细胞分为COCs以及NO两个试验组,试验结果显示NO卵裂率达到55.99%,COCs卵裂率仅为33.75%,两者之间存在显著差异,NO卵裂率要显著高于COCs卵裂率。这个试验结果与刘淑娟等[17]在昆白系小鼠体外受精一文中指出的结果不同,颗粒细胞对于小鼠的体外受精有一定的促进作用,并且指出,颗粒细胞可增加精子对透明带的敏感性,具有防止透明带变硬和延长卵母细胞寿命的作用。而有研究进一步指出,去除卵丘细胞的卵母细胞的受精率要低于没有去除卵丘细胞的卵母细胞受精率,并指出原因可能是由于经过透明质酸酶处理的卵母细胞的透明带结构发生了改变,导致受精率下降。试验结果存在差异的原因是多方面的,精子获能液,体外受精液,胚胎培养液的不同,均有可能出现与其他科研人员结果不一致的情况。其中,在胚胎培养阶段,很多研究者采用卵裂培养液G1,囊胚培养液G2,可以得到较高的卵裂率。段彪等[18]在精子获能时间及精卵共孵育时间对小鼠体外受精和胚胎发育的影响一文中采用G-IVF作为受精液,以G1/G2作为胚胎发育液,在获能时间60 min,受精时间为6 h的情况下受精率达到86.4%,卵裂率达到85.4%。这个结果比本文用HTF作为受精液,KSOM作为胚胎培养液的卵裂率高出近30%。出现这种情况的原因是由于G1/G2系统中存在不同成分的组合,这些成分之间有互补效应。G1/G2系统含有氨基酸,而KSOM培养液中没有。其中,G1培养液中含有一些非必需氨基酸以及谷氨酰胺,这些对于小鼠早期胚胎的卵裂率有一定的提高作用,而在G2培养液中,则包括有G1培养液中所含有的成分和一些必需氨基酸,对于不含有谷氨酰胺的必需氨基酸则有助于提高8细胞以后的胚胎发育[19]。
