虾青素对大鼠脑出血后小胶质细胞活化的影响
2021-04-22周子薇郑晓梅
周子薇,郑晓梅
西南医科大学附属医院 神经内科,神经系统疾病与脑功能实验室,四川泸州 646000
脑卒中已成为我国死亡率第一的疾病,而脑出血(intracerebral hemorrhage,ICH)的发病率在脑卒中各亚型中居第二,其发病1个月的病死率可达35%~52%,存活患者多数遗留有神经功能障碍,严重危害患者的生命健康[1]。小胶质细胞是脑出血后首先作出反应的细胞,调控着脑出血后炎症反应、氧化应激,在继发性脑损伤中扮演着重要角色。虾青素(astaxanthin,ASX)又称虾黄质,具有多种生物学作用:猝灭单线态氧、清除氧自由基,促使Nrf2与Keap1分解,激活Nrf2蛋白,也可通过直接抑制活性氧产生等参与调节氧化应激,还能抑制Caspase3活化和细胞色素C释放起到抗凋亡作用等;可透过血脑屏障对脑出血、脑梗死、阿尔茨海默病等疾病发挥神经保护作用[2-5]。但鲜有关于虾青素对脑出血小胶质细胞影响的研究,本实验拟建立脑出血大鼠模型,观察虾青素对脑出血大鼠模型小胶质细胞活化的影响,探讨其可能的神经保护机制。
材料与方法
1 实验材料 66只SPF级8周龄健康雄性SD大鼠,体质量180~220 g,许可证编号SYXK(川)2018-065,购于成都达硕实验动物有限公司;虾青素(A832359-25 mg)购于Macklin公司,ELISA试剂盒购于ELK Biotechnology公司;RIPA总蛋白裂解液(AS1004)、BCA蛋白浓度测定试剂盒(AS1086)、一抗Iba-1(ab178847)GAPDH(ab37168)购于Abcam公司、NF-κB(#8242)购于CST公司、二抗HRP-Goat anti Rabbit(AS1107)购于ASPEN公司、ECL化学发光检测试剂盒(AS1059)均购自ASPEN公司;立体定向仪(上海玉研科学仪器有限 公司),电泳仪(北京市六一仪器厂)等。
2 脑出血造模 大鼠适应性喂养1周,术前禁食8 h,常规称重、6%水合氯醛麻醉。将大鼠固定在脑立体定位仪,暴露颅骨前囟及冠状缝,以前囟为中心,向后0.2 mm,右侧旁开3 mm,定位右侧尾状核,向下钻孔6 mm,从鼠尾静脉取血50 µL缓慢注血,第1次匀速注血20 µL,第2次注血30 µL,后缓慢拔针、缝合切口,待大鼠苏醒后回笼继续饲养[6]。造模2 h后进行Longa评分,1~3分视为造模成功[7];假手术组同样禁食、麻醉、定位,步骤 同前,但注射等量0.9%氯化钠注射液,不注血。
3 分组及给药 以随机数字表法将大鼠分为假手术组、脑出血组、虾青素低剂量组、虾青素高剂量组,每组16只。虾青素低、高剂量组大鼠每天分别予以虾青素20 mg/kg、40 mg/kg灌胃[8];假手术组、脑出血组则给予等体积花生油溶剂灌胃;第3天根据Garcia法评判各组大鼠神经受损程度,最高分18分,评分越低表示神经功能障碍越 严重[9],评分后处死大鼠取脑组织行相关检查。
4 大鼠脑组织含水量测定 采用干湿重法计算脑组织含水量,随机选取每组4只大鼠,称重、麻醉后断头取脑组织,吸取脑组织表面血渍,称取湿重后放进100℃烘箱烘24 h后称干重[6]。含水量 =(湿重 − 干重)/ 湿重×100%。
5 大鼠脑组织HE染色 随机选取每组6只大鼠,常规称重、过量麻醉,充分暴露心脏、固定灌注针;右心耳处剪一个小口,快速灌注0.9%氯化钠注射液直至右心房流出清亮液体后,用4%多聚甲醛灌注直至大鼠上半身僵硬,迅速断头取脑,于视交叉后1 mm处冠状位向后取脑组织。甲醛固定、石蜡包埋、HE染色,普通光学显微镜(200×)下观察脑组织病理学改变,使用Olympus c ellSens Standard显微镜图像软件采集图像。
6 免疫荧光观察小胶质细胞形态 石蜡切片脱蜡、PBS反复漂洗、修复、PBS漂洗、孵育、漂洗、加封闭液、去除封闭液加一抗Iba-1,PBS洗3次后去除PBS加二抗孵育,PBS漂洗,在荧光显 微镜下(400×)观察小胶质细胞形态。
7 酶联免疫吸附测定肿瘤坏死因子-α、白细胞介素-1β表达水平 处死剩余大鼠,取部分脑组织,严格按照ELISA试剂盒说明书步骤操作测定脑组织肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白 细胞介素-1β(interleukin-1β,IL-1β)表达水平。
8 Western blot检测Iba-1、NF-κB 取剩余冻存的脑组织块,用预冷PBS缓冲液漂洗3次,加入蛋白提取试剂,冰浴制成匀浆,离心收集上清液,用BCA测定蛋白浓度,制胶、上样、转膜、封闭,除去封闭液,加入一抗Iba-1、NF-κB 4℃过夜,TBST漂洗3次,加二抗孵育,再用TBST漂洗,滴加增强型发光试剂(ECL)显色、曝光、显影、定影,保存胶片。使用AlphaEaseFC软件以目 的条带灰度值 /GAPDH灰度值分析蛋白。
9 统计学分析 应用SPSS22.0统计软件进行数据分析。观测资料主要为符合正态分布的计量资料,以 x¯±s 表示,多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD-t 检验 。P<0.05为差异有统计学意义。
结 果
1 造模后评分 本实验过程中1只大鼠在造模过程中因呼吸抑制死亡,1只大鼠在造模后第1天因脑疝死亡,按照动物纳入标准进行大鼠补充,共造 模66只,最终成功造模64只,评分1~3分。
2 给药后各组大鼠神经功能评分 各组大鼠在给药后第3天进行神经功能评分,与假手术组(17.44±0.89)比较,脑出血组大鼠(7.56±1.55)出现明显的神经功能缺损症状,评分明显低于假手术组(P<0.05);与脑出血组(7.56±1.55)比较,虾青素低剂量组(9.5±1.46)、高剂量组(10.75±1.69)神经功能缺损症状得到改善,神经功能评分均高于脑出血组(P<0 .05),且高剂量组改善更明显(P<0.05)。见图1。
3 各 组 大 鼠 脑 组 织 含 水 量 比 较 与 假 手 术组(77.72%±0.89%)比较,脑出血组(84.60%±0.90%)脑组织含水量增高(P<0.05);与脑出血组(84.60%±0.90%)比较,虾青素低剂量组(82.43%±0.52%)、高剂量组(81.04%±0.98%)脑组织含水量均降低(P<0.05),虾青素高剂量组降低更明显( P<0.05)。见图2。
4 各组大鼠脑组织病理学改变 假手术组脑组织无出血灶,细胞形态和结构正常;与假手术组相比,脑出血组可见大量红细胞、炎症细胞浸润,周围细胞核固缩、溶解、坏死,组织排列紊乱;与脑出血组相比,虾青素高剂量组大鼠脑组织结构致密,排列整齐,血肿面积变小,血肿周围可见少量红细胞、炎症细胞聚集,虾青素低剂量组介 于二者之间。见图3。

图 1 各组大鼠神经功能评分(n=16, x ¯±s )aP<0.001,vs假手术组;bP<0.001,vs脑出血组;cP=0.016,vs虾青素低剂量组;F=143.70Fig.1 Neurological severity scores of different groups (n=16, ±s )aP<0.001, vs sham-operation group; bP<0.001, vs ICH group;cP=0.016, vs ASX low dose group; F=143.70

图 2 各组大鼠脑组织含水量比较(n=4, x ¯±s )aP<0.001, vs假手术组;bP=0.003,vs脑出血组; cP=0.038,vs虾青素低剂量组;F=46.77Fig.2 Comparison of brain water content in each group (n=4, ±s )aP<0.001, vs sham-operation group; bP=0.003, vs ICH group; cP=0.038, vs ASX low dose group; F=46.77
5 免疫荧光观察各组大鼠脑组织小胶质细胞 假手术组的小胶质细胞数量少,胞体小,突起及分支细长,处于“静息状态”;与假手术组相比,脑出血组可见活化的小胶质细胞数量增加,并且形态学呈“阿米巴样改变”:胞体明显变大变圆,分支减少,突起变得短粗。与脑出血组相比,虾青素治疗组小胶质细胞形态学也趋向静息状态改变:胞体 明显变小,分支逐渐细长。见图4。
6 各组大鼠脑组织炎性因子TNF-α、IL-1β表达水平 与假手术组比较,脑出血组大鼠脑组织TNF-α、IL-1β表达水平明显上调(P<0.05);与脑出血组比较,虾青素低、高剂量组大鼠脑组织TNFα、IL-1β表达水平均下降(P<0.05),虾青素高剂量 组下降程度更明显(P<0.05)。见表1。
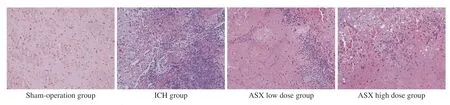
图 3 各组大鼠脑组织细胞形态(HE染色,200 × )F ig.3 Comparison of pathological. Results between different groups (HE staining, 200 × )

图 4 各组大鼠脑组织小胶质细胞表达(免疫荧光,400×)F ig.4 Expression of microglial cell in brain tissue of each group (IF, 400×)
7 Western blot法测各组大鼠脑组织Iba-1、NFκB蛋白表达 与假手术组(0.108±0.010,0.092±0.020)比较,脑出血组(0.463±0.044,0.595±0.028)脑组织中Iba-1、NF-κB蛋白表达增加(P<0.05);与脑出血组比较,虾青素低剂量组(0.321±0.025,0.479±0.03)、高 剂 量 组(0.242±0.016,0.387±0.031)大鼠脑组织中Iba-1、NF-κB蛋白表达均下调(P<0.05),虾青素高剂量组下调更明显(P <0 .05)。见图5。
表 1 各组大鼠脑组织炎性因子TNF-α、IL-1β表达水平比较(n=6, ±s )Tab. 1 Expression of TNF-α, IL-1β in brain tissue of each group (n=6, x ¯±s )

表 1 各组大鼠脑组织炎性因子TNF-α、IL-1β表达水平比较(n=6, ±s )Tab. 1 Expression of TNF-α, IL-1β in brain tissue of each group (n=6, x ¯±s )
aP<0.001, vs sham-operation group; bP<0.001, vs ICH group;cP<0.05, vs ASX low dose group.

图 5 各组大鼠脑组织Iba-1、NF-κ B蛋白表达(n=6, x ¯±s ) (aP<0.05, vs假手术组;bP<0.05,vs脑出血组; cP<0.05,vs虾青素低剂量组)Fig.5 Expression of Iba-1 and NF-κ B protein in brain tissue of each group (n=6, ±s ) (aP<0.05, vs sham-operation group; bP<0.05, vs ICH group; cP<0.05, vs ASX low dose group)
讨 论
脑出血是指原发于脑实质的非外伤性出血,具有较高的致残率和死亡率,给患者家庭及社会带来了巨大的挑战。当前治疗脑出血的有效药物较少,寻求一种可改善生存质量的新型药物是目前研究的难点。Balietti等[10]发现虾青素可抑制小鼠脑组织小胶质细胞活化,降低活性氧水平,抑制MMP和细胞毒性等[11],具有抗炎、抗氧化、抗凋亡等作用,越来越多研究发现虾青素对脑出血性疾病具有神经保护作用。何洋等[12]发现,虾青素可抑制小鼠脑出血后炎性因子的释放,近期研究发现在蛛网膜下腔出血模型中虾青素可抑制小胶质细胞活化,减轻炎症反应等从而保护脑组织[13-14]。本实验发现脑出血组大鼠出现明显的神经功能缺损症状,脑组织含水量显著增加,而虾青素低、高剂量组神经功能评分、脑组织含水量均得到改善,且呈剂量依赖性,同样证实了虾青素对脑出血具有神经保护作用。
继发性脑损伤的严重程度被认为是脑出血患者能否存活的关键,而炎症反应是造成脑出血后继发性脑损伤的重要环节。小胶质细胞是脑组织中主要的免疫细胞,具有吞噬、炎症调节、抗原递呈等作用,参与了继发性脑损伤病理生理过程。其正常情况下处于休眠状态,起到免疫监视的作用,脑出血后小胶质细胞迅速激活为M1型和M2型,M1型可以释放大量的自由基、炎性因子等;M2型可以分泌IL-4、TNF-β等抗炎因子发挥“清道夫”作用,吞噬细胞碎片,其活化状态与脑内环境变化的严重程度、作用时间长短等均相关,也可随着机体的应激状态而改变[15-16]。研究表明,在脑出血后早期小胶质细胞可加剧脑内的炎症反应、氧化应激等,而敲除小胶质细胞后脑水肿程度及神经缺损症状均可得到有效改善[17-18]。这说明小胶质细胞具有神经保护和神经毒性的双面作用,在脑出血急性期M2型作用微弱,更多是M1型起主导作用。离子钙接头蛋白1在脑内小胶质细胞中表达,是其特异性标志物,故本实验通过观察Iba-1免疫标记的小胶质细胞的改变,发现正常大鼠小胶质细胞数量少,脑出血大鼠小胶质细胞数量增加,细胞被激活,胞体呈“阿米巴样改变”,HE染色提示组织排列紊乱,大量炎症细胞浸润;且通过蛋白质印迹法检测亦发现脑出血大鼠较正常大鼠脑组织Iba-1蛋白表达增高,均提示脑出血后小胶质细胞活化在脑出血中扮演重要角色,而虾青素低、高剂量组大鼠小胶质细胞数量减少,形态向静息状态转变,Iba-1蛋白表达下降,HE染色提示炎症细胞浸润减少,说明虾青素可能通过抑制小胶质细胞活化减轻脑出血大鼠脑损伤程度,但其作用机制需进一步探讨。
有研究提示,LPS诱导极化小胶质细胞的机制可能是LPS促进BV2细胞内的NF-κB核转位,使其表达增加[19]。NF-κB存在于神经元、胶质细胞中,可调控基因转录,活化的NF-κB可促进下游TNF-α、IL-1β分泌,对炎症反应具有重要的调控作用[20]。TNF-α、IL-1β是造成脑细胞水肿的重要因子,也能诱导神经元死亡,还可触发黏附分子、趋化因子等释放,正反馈作用于NF-κB,形成恶性循环,加重炎症反应及细胞毒性脑损伤。本实验发现脑出血大鼠脑组织中炎性因子TNFα、IL-1β、NF-κB表达水平明显增加,脑组织含水量增加,而虾青素低、高剂量组均可下调TNFα、IL-1β、NF-κB的表达水平,高剂量组更明显。实验结果说明虾青素可能通过抑制NF-κB活性,减少其下游炎性因子TNF-α、IL-1β等释放,改善了脑出血后炎性反应。近期文献提示,虾青素可抑制NF-κB通路活性,减轻大脑炎症反应[21-22],在体外实验中亦可通过作用于NF-κB通路抑制脂多糖诱导的BV2小胶质细胞向M1极化[23],这与本实验结果一致,故我们推测虾青素可抑制脑出血后小胶质细胞活化,其机制可能与抑制其胞内NF-κB激活有关。
综上所述,我们发现小胶质细胞活化及炎症反应在脑出血的病理生理中起重要作用,而虾青素可能作用于NF-κB通路抑制小胶质细胞活化,减轻炎症反应,对脑出血大鼠具有神经保护作用,但其具体作用靶点仍有待研究。
