松材线虫谷胱甘肽S转移酶Sigma1基因(BxGSTs1)克隆及表达分析
2021-04-22王步勇问荣荣李秀伟
王步勇,问荣荣,李秀伟,马 玲
(1.菏泽学院,山东 菏泽 274015;2.东北林业大学,黑龙江 哈尔滨 150040)
松材线虫(Bursaphelechus xylophilus,Nikle)是目前世界上最具危险性的森林病原之一,引起的松材萎蔫病,导致松林毁灭性死亡,给亚洲、欧洲和美洲等国家和地区造成了巨大经济损失和生态破坏[1-4]。自1982年首次在南京发现以来[2],该病情在我国迅速蔓延至江苏、浙江、安徽、广东、山东、湖南、重庆、湖北和陕西等省市。目前,该病的防治仍以化学防治为主,包括溴甲烷熏蒸、克线磷埋土、甲维盐注干防治等[5]。但化学防治易引起严重的“3R”问题,误杀非靶标生物、增加线虫抗药性、污染土壤环境等,破坏了森林生态平衡,危害人类健康[6-7]。因此,寻求高效、安全、无污染的防治措施迫在眉睫。随着生物技术的不断发展,越来越多的基因工程技术被广泛应用到线虫防治研究中[8-9]。研究与线虫侵染寄生、耐药解毒、免疫防御等相关基因功能,利用分子生物技术安全有效地防治线虫成为线虫研究的热点。
谷胱甘肽S-转移酶(Glutathione S-transferases,GSTs,EC 2.5.1.18)是一类广泛存在于动植物、鸟类、昆虫、线虫及微生物体内的多功能同工催化酶,具有解毒和抗氧化功能[10-11]。它可以催化机体内还原型谷胱甘肽与内外源性有毒物质发生亲电子团偶联反应,增加有毒物质疏水性使其易于排出体外,降低机体遭受的损害,从而达到解毒作用[12]。GSTs 酶家族分为微粒体型、线粒体型和胞质型3 类,通常所指的谷胱甘肽S-转移酶为胞质型GSTs[13]。根据氨基酸同源性及底物特异性,胞质型GSTs 又分为Alpha(GSTA),KaPPa(GSTK),Mu(GSTM),Pi(GSTP),Sigma(GSTS),Theta(GSTT),Zeta(GSTZ)和Omega(GSTO)8 类[14]。作为生物体内一类重要的II 期二聚体酶,GSTs 家族中许多基因被证实参与了动植物、真菌、昆虫的机体解毒机制、抗氧化应激等[15-17]。随着研究的深入,对线虫谷胱甘肽S-转移酶的报道越来越多。Hasegawa 等[18]发现适量异硫氰酸烯丙酯诱导模式线虫GST 表达,可使线虫产生氧化应激抗性。李海燕等[19]发现大豆孢囊线虫过量表达GST 酶应激类黄酮胁迫。GSTs 在线虫的解毒耐药、氧化应激、免疫防御等过程发挥了重要作用。
基于课题组前期松材线虫的转录组分析,本论文利用Blast 比对松材线虫基因库,鉴定得到模式线虫GST的同源基因,鉴定属于GST Sigma类,故命名BxGSTs1。结合RT-PCR 技术克隆获得BxGSTs1基因CDS 全长序列。利用生物信息学进行基因特性分析,原位杂交试验进行基因组织表达定位分析,利用qPCR 试验定量分析BxGSTs1基因在药剂胁迫时的表达水平,利用RNAi 技术及后续药剂处理试验,深入分析BxGSTs1基因的具体功能。通过对BxGSTs1基因特性及功能的具体分析,为研究松材线虫GSTs 家族基因功能奠定基础,也为寻找潜在靶标基因,利用生物技术防治线虫病提供了理论支持。
1 材料与方法
1.1 供试线虫及药剂
试验所需松材线虫由中国林业科学院湿地研究所提供,灰葡萄孢菌(Botrytis cinerea)由东北林业大学森林病虫害生物学实验室提供。试验线虫经形态学鉴定后接种到灰葡萄孢菌PDA 上,于25℃黑暗培养扩繁7~9 d。贝曼漏斗法收集新鲜松材线虫(混合虫态100 μL),经M9 缓冲液清洗后,于液氮中速冻,-80℃冰箱储存备用。药剂鱼藤酮(rotenone,95%)及盐酸左旋咪唑(levamisole hydrochloride,98%)均购买于德国Sigma 公司,ddH2O 购买于大连TaKara 生物公司。
1.2 RNA 提取及cDNA 合成
将收集备用的松材线虫虫样,用研磨棒于液氮中研至粉末状。采用Invitrogen TRIzol Reagent试剂盒,根据试剂盒操作要求提取松材线虫混合虫龄的总RNA[20]。经DNase I 消化后,紫外分光光度计和1%琼脂糖凝胶电泳检测线虫总RNA 质量。取3 μL 的线虫总RNA 样为模板,用TaKara PrimeScript ™ II 1st Strand cDNA Synthesis Kit 反转录试剂盒,按照试剂盒操作要求进行第一链cDNA合成,合成的cDNA 稀释10 倍,-20℃冰箱储存备用。
1.3 基因克隆与序列分析
基于前期松材线虫转录组测序结果,以模式线虫GST基因序列(NM_062481.7)为检索序列,Blast 比对松材线虫全基因组数据库[21],鉴定得到模式线虫GST基因的同源序列,因属于GST Sigma 类基因,故命名为BxGSTs1。利用Primer 5.0 软件设计覆盖完整CDS 区的特异性引物BxGSTs1-F(5′-TCCTCATCGATGGAAAGCCG-3′)/BxGSTs1-R(5′-TGATCGTATCGGGTCGGTTC-3′)进行PCR 扩增,获得BxGSTs1基因CDS 序列全长。上述PCR 产物经胶回收试剂盒纯化后,1.2%琼脂糖凝胶电泳检测。再连接至pGEM-T Easy Vector载体,转化至DH5α 感受态细胞,IPTG-X-Gal 涂板培养,随机挑取阳性单菌落,送至上海生工测序。
利用NCBI ORF-Finder、ExPASy ProtParam、ProtScale、NetPhos 3.1 Server 等生物信息学分析网站,对编码蛋白的氨基酸序列、开放阅读框ORF、相对分子量、理论等电点、亲疏水性、磷酸化位点等基因特性进行预测分析[22]。利用NCBI Conserved Domains 对编码蛋白氨基酸序列的保守区域进行预测分析;利用NCBI BLASTP、DNAMAN、MEGA6.0 软件,筛选同源蛋白序列,进行多序列比对及系统发育树分析;用PredictProtein、SWISS-MODEL、Swiss-PdbViewer在线工具对编码蛋白结构进行预测分析。
1.4 原位杂交ISH
选用德国Roche 公司的地高辛原位杂交试剂盒进行原位杂交试验,定位分析BxGSTs1基因在松材线虫组织中的表达部位。基于基因序列设计探针引物BxGSTs1-insF(5′-TCCCGAAAATCATCGGCCTT-3′)、BxGSTs1-insR(5′-TTCCTGACGTCGGTGAGATG-3′),按照试剂盒要求进行不对称PCR,合成杂交探针。1.2%凝胶电泳检测探针产物,-80℃冰箱备用。
原位杂交试验的主要方法按照De Boer 等[23]描述,略加修改进行。具体杂交方法如下:贝曼漏斗法收集新鲜的混合虫龄的松材线虫20 μL,离心后收集于1.5 mL 的离心管中;待5%多聚甲醛溶液5℃固定处理16 h 后,室温预处理4 h;用裂解液、蛋白酶K、丙酮等溶液,液氮冷冻裂解30 s,对线虫进行通透化处理;用合成的杂交探针处理松材线虫悬浮液,55℃黑暗处理16 h;离心处理停止显色后,制作玻片标本,Olympus 拍照检测。
1.5 荧光定量qPCR
采用实时荧光定量qPCR,对松材线虫BxGSTs1基因在药剂鱼藤酮及盐酸左旋咪唑胁迫时的表达水平进行定量分析。根据前期生测结果,试验选取1.35、2.60 μg/mL 鱼藤酮药剂处理松材线虫12、24 h,ddH2O 处理作为对照组;选取2.50、3.50 μg/mL 盐酸左旋咪唑药剂处理松材线虫12、24 h,ddH2O 处理作为对照组。采用TRIzol Reagent 试剂盒,提取ddH2O 和药剂处理12、24 h后的松材线虫总RNA,经DNase I 消除DNA 后,PrimeScriptTMRT Kit 合成cDNA,-80℃冰箱储存,备用qPCR 模板。
实时荧光定量qPCR 使用TOYOBO KOD SUBR qPCR Mix 试剂盒进行。Primer 5.0 软件设计BxGSTs1定量引物BxGSTs1-qF(5′-AACCGATTCGTTGCCAGAGT-3′)、BxGSTs1-qR(5′-AATGCTTCTGAACTGCGGGA-3′),Actin基因为内参基因。qPCR 反应参照试剂盒使用说明书进行,反应程序为:94℃预变性2 min;94℃变性15 s,58℃退火15 s,72℃延伸45 s,40 个循环;95℃变性1 min,55℃延伸30 s,95℃变性30 s,进行溶解曲线反应。每个样重复3 次,用2-ΔΔCt法进行目的基因的相对表达分析[24]。
1.6 RNAi 沉默
RNAi 基因沉默技术研究BxGSTs1基因的具体功能。采用Promega 公司的T7 RiboMAXTM Express RNAi System 试剂盒进行dsRNA 合成。根据BxGSTs1基因序列信息,设计引物BxGSTs1-pF(5′-CCTTCTGAAGCCCAACGGAT-3′) 和BxGSTs1-T7R(5′-AGTAATACGACTCACTATAG GGATCTGACGTCGGTGAGATGCTT-3′),引 物BxGSTs1-pR(5′-CTGACGTCGGTGAGATGCTT-3′)和BxGSTs1-T7F(5′-GCTAATACGACTCACTAT AGGGATCCTTCTGAAGCCCAACGGAT-3′),分别进行正/反义链ssRNA 的PCR 合成。将上述ssRNA PCR 产物混合(1∶1),94℃解链处理10 min,冷却至25℃退火合成dsRNA。紫外分光光度计及凝胶电泳检测合成的dsRNA 质量。
采用体外浸泡dsRNA 法[25],对BxGSTs1基因进行RNAi 沉默处理。将松材线虫幼虫用DEPCH2O 清洗3 次,待离心后吸取10 μL 线虫悬浮液浸泡至30 μL 的dsRNA 溶液(终浓度为2.0 μg/μL)中。移液枪轻轻混匀后,置于25℃摇床上200 r/min浸泡12 h,采用qPCR 试验检测松材线虫BxGSTs1基因的表达情况。同等数量的线虫浸泡至30 μL ddH2O 中做对照组。每组试验进行3 次重复。ddH2O 洗虫3 次,进行显微观察及后续药剂处理试验。
采用24 孔板浸泡法[26],对dsRNA 处理后的线虫进行药剂处理试验,具体处理如下:随机挑选50 条dsRNA 处理的松材线虫作为处理组线虫,挑选50 条ddH2O 处理的松材线虫作为对照组线虫。根据前期生测结果,选取2.60 μg/mL 鱼藤酮、3.50 μg/mL 盐酸左旋咪唑药剂处理线虫12 h。每组试验重复3 次。通过观察计数,统计线虫死亡率。
2 结果与分析
2.1 BxGSTs1 基因克隆及特性分析
采用TRIzol 提取松材线虫总RNA,经分光光度计及凝胶电泳检测,总RNA 质量均符合标准。凝胶电泳检测cDNA 样品呈弥散带,满足试验要求。通过松材线虫转录组数据分析及PCR 扩增试验获得1 条GST基因(图1)。该基因CDS区全长468 bp,Blast 比对分析其属于GST Sigma(GSTs)亚家族,故命名为BxGSTs1(NCBI 登录号:MK714354)。经ORF 分析BxGSTs1编码155 个氨基酸(图2)。
图1 凝胶电泳图像Fig.1 Agarose gel electrophoresis

图2 松材线虫BxGSTs1 基因CDS 全长及推导的氨基酸序列Fig.2 Nucleotide and deduced amino acid sequence of BxGSTs1 gene from B.xylophilus
ExPASy ProtParam 预测BxGSTs1 蛋白分子式为C813H1228N202O230S3,相对分子质量17.608 kD,理论等电点为5.89,不稳定系数为36.51,属于稳定性蛋白。ProtScale 预测BxGSTs1 蛋白平均疏水指数为-0.262,属于亲水性蛋白。SignalP 4.1 显示蛋白无信号肽存在。NetPhos 3.1 Server 磷酸化位点分析显示,BxGSTs1 蛋白含有3 个丝氨酸磷酸化位点、2 个苏氨酸磷酸化位点、6 个络氨酸磷酸化位点。NCBI CDD 进行蛋白保守区域预测分析(图3),该蛋白含有N 端保守结构域“GST_N”和C 端保守结构域“GST_C_Sigma_like”,属于类硫氧还原蛋白超家族(Thioredoxin_like Superfamily)及谷胱甘肽S-转移酶超家族(GST_C_family Superfamily)。
2.2 多序列比对及系统进化分析
NCBI BLASTP 比对分析松材线虫BxGSTs1蛋白,筛选出9 个GST 同源蛋白序列,利用DNAMAN 软件进行多序列比对。比对结果显示,松材线虫BxGSTs1 蛋白的氨基酸序列与其他9 个GST 同源蛋白序列的相似性性介于30%~37%。BxGSTs1 序列与同源蛋白序列在N 端保守区域“GST_N” 和C 端保守区域“GST_C_Sigma_like”上比较保守。为进一步研究线虫GSTs 蛋白的进化关系,利用MEGA 6.0 软件构建系统进化树(图4),发现松材线虫BxGSTs1 蛋白序列与钩口线虫GST 蛋白(EYC01086.1)遗传距离远,亲缘关系较远;与秀丽隐杆线虫GST 蛋白(NP_494882.2)遗传距离近,亲缘关系较近。BxGSTs1 蛋白与秀丽隐杆线虫GST 蛋白(EYC01086.1)具同源性(E=9e-22),表明两者功能相似。进化树分析结果与同源性分析结果相一致。
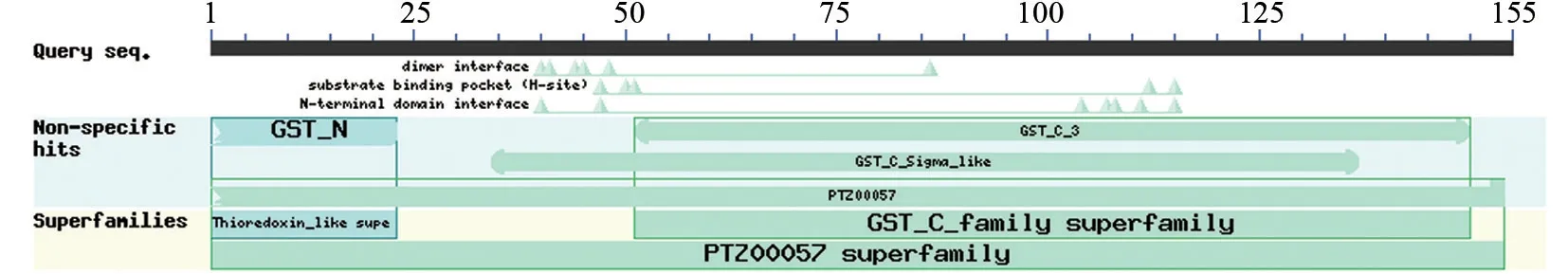
图3 松材线虫BxGSTs1 蛋白氨基酸序列保守结构域预测Fig.3 The conserved domains of BxGSTs1

图4 松材线虫BxGSTs1 蛋白系统发育树Fig.4 Phylogenetic tree of BxGSTs1
2.3 蛋白高级结构预测分析
PredictProtein 在线工具对BxGSTs1 蛋白的二级结构进行预测,发现该蛋白中氨基酸残基组成以α-螺旋、无规则卷曲为主,分别占比53.55%,38.06%。应用SWISS-MODEL 软件于PBD 库中寻找BxGSTs1 的同源蛋白,构建三维模型,Swiss-PdbViewer 进行建模分析(图5)。结果显示,松材线虫BxGSTs1 蛋白包含1 个N 端谷胱甘肽的结合区域和1 个C 端识别结合底物区域。图5A 右边为N 端区域,含有7 个α-螺旋、2 个β-折叠及大量无规则卷曲;图5A 左边为C 端区域,含有个8个α-螺旋、2 个β-折叠及大量无规则卷曲。拉氏构象图显示(图5B),预测蛋白的残基二面角多位于黄色核心区域,说明预建模蛋白的空间结构较稳定,同源建模结果具有可信性。
2.4 BxGSTs1 基因的表达分析
原位杂交试验研究BxGSTs1基因在松材线虫组织中的表达部位,Olympus 显影检测。杂交显色结果显示:经反义链杂交探针处理,松材线虫的食道腺及生殖部位附近颜色变深,有杂交信号存在(图6A);正义链杂交探针(对照组)处理的线虫无杂交信号存在(图6B)。推测松材线虫BxGSTs1基因主要在松材线虫的食道腺及腹部近生殖处表达。

图5 BxGSTs1 蛋白三维结构预测Fig.5 Three-dimensional structure of BxGSTs1 protein

图6 松材线虫BxGSTs1 基因的原位杂交结果Fig.6 The ISH results of BxGSTs1 gene of B.xylophilus
采用实时荧光定量PCR 分析该基因在鱼藤酮及盐酸左旋咪唑处理下的胁迫表达(图7)。结果表明,松材线虫BxGSTs1基因在药剂鱼藤酮胁迫12、24 h 时,基因表达上调(图7A)。随着药剂浓度、胁迫时间的增加,BxGSTs1基因的相对表达量呈上升。该基因在2.60 μg/mL 鱼藤酮胁迫24 h时的相对表达量最高,约为对照的4 倍;BxGSTs1基因在药剂盐酸左旋咪唑胁迫12、24 h 时,基因表达上调(图7B)。随着药剂浓度、胁迫时间的增加,BxGSTs1上调趋势显著下降。该基因在3.50 μg/mL 盐酸左旋咪唑胁迫12 h 时的相对表达量最高,约为对照的10.5 倍。

图 7 松材线虫BxGSTs1 基因在药剂胁迫时的表达分析Fig.7 Expression analysis of BxGSTs1 gene under pesticide stress
2.5 BxGSTs1 基因沉默分析
利用T7 RiboMAXTM Express RNAi System 试剂盒,体外PCR 转录法合成BxGSTs1基因相应dsRNA。凝胶电泳检测显示正/反义链ssRNA 的条带大小一致,dsRNA 质量良好。紫外分光光度计显示合成的dsRNA 浓度较高(3.85 μg/μL),满足RNAi 试验要求。实时荧光定量qPCR 检测dsRNA 的沉默效率,结果显示,BxGSTs1基因在2.0 μg/μL dsRNA 浸泡12 h 时的表达量较对照组(ddH2O)下降了49%,基因被沉默。奥林巴斯显微观察显示,dsRNA 处理组线虫与对照组(ddH2O)线虫相比,虫态无明显变化。
选用2.60 μg/mL 鱼藤酮、3.50 μg/mL 盐酸左旋咪唑,研究dsRNA 处理组线虫及ddH2O 对照组线虫的药剂死亡率。24 孔板药剂浸泡试验显示:2.60 μg/mL 鱼藤酮处理12 h 时,dsRNA 处理组线虫的死亡率为67.33%,ddH2O 对照组线虫的死亡率为48.67%,死亡率显著提高了18.67%;3.50 μg/mL 鱼藤酮处理12 h 时,dsRNA 处理组线虫的死亡率为32.67%,ddH2O 对照组线虫的死亡率为26%,死亡率提高了6.67%。与ddH2O 对照组线虫相比,dsRNA 处理组线虫对鱼藤酮药剂的敏感性显著提高。

图8 基因沉默效率及线虫死亡率Fig.8 Gene silencing efficiency and mortality rate of dsRNA-treated nematodes
3 结论与讨论
所有的生物体都有一套精细的防御系统,细胞色素P450、酯酶和谷胱甘肽S-转移酶是构成该防御系统主要酶系[27]。作为解毒代谢酶类之一,谷胱甘肽-S 转移酶(GST)在该系统中发挥了重要作用。GST 蛋白是多基因编码、具有多功能的超家族同工酶,广泛存在于动物、植物、昆虫、真菌、线虫及微生物等多种生物组织中。该类蛋白于1961年首次在大鼠肝脏中被发现[28]。随后大量研究发现,作为二期解毒的主要参与者,GST家族酶主要用于催化谷胱甘肽与疏水的、亲电的化合物发生亲电取代反应,转化降解多种天然和人工合成的化合物,在生物体抵抗内源性、外源性有毒物质的过程中发挥了抗氧化及解毒等作用,保护生物体。随着化学农药滥用、“3R”问题日益加剧,有害生物抗药性问题研究愈加重要[29]。通过对松材线虫GST基因深入研究,初步了解线虫对杀线虫剂的胁迫响应机制。利于我们寻找潜在药物靶标基因,利用分子生物技术防控线虫病。
本研究基于松材线虫转录组测序结果,利用Blast 比对松材线虫基因库,RT-PCR 技术克隆获得松材线虫1 条谷胱甘肽S 转移酶Sigma 类基因(BxGSTs1)CDS 全长序列。Conserved Domains结构域分析发现,BxGSTs1 蛋白包含2 个保守结构域—C 端结构域和N 端结构域。C 端结构域含有特异性底物结合H 位点,N 端含有与GSH 特异结合G 位点。推测该蛋白通过催化GSH 与底物发生特异性结合,减少底物对线虫机体的损伤。多序列比对及进化树分析显示,松材线虫BxGSTs1蛋白与秀丽隐杆线虫GST 蛋白(NP_494882.2)同源性较高,亲缘关系较近,推测两者的蛋白功能相似。蛋白高级结构预测分析显示,BxGSTs1 蛋白二级结构以α-螺旋、无规则卷曲。高占比的无规则卷曲,表明BxGSTs1 蛋白含有大量的功能区域、具功能多样性,与GSTs 蛋白属于多功能同工酶[11]相吻合。
原位杂交试验研究BxGSTs1基因在松材线虫组织中的表达位置,发现BxGSTs1基因主要在松材线虫的食道腺附近和腹部近生殖处表达。食道腺是线虫侵染寄生的重要部位,通过分泌效应蛋白等,降低寄主防御系统。腹部及生殖部位是线虫的代谢与生殖中心。推测上述两处在线虫代谢过程中会消耗大量能量产生很多内源性有毒物质,BxGSTs1基因的大量表达有利于松材线虫降低体内外有毒活性物质的危害。qPCR 试验定量分析发现,松材线虫BxGSTs1基因在药剂胁迫处理时的相对表达上调。推测松材线虫通过高表达BxGSTs1基因响应药剂胁迫,使线虫产生氧化应激抗性,发挥耐药解毒作用。
RNAi 技术可降低目的基因的表达,是研究线虫基因具体功能的有效工具[30]。本研究采用体外法合成dsRNA,利用浸泡法进行RNAi 试验。RNAi 试验结果发现,dsRNA 浸泡12 h 时,松材线虫BxGSTs1基因的相对表达量下降,基因沉默成功。后续药剂处理试验显示,在鱼藤酮及盐酸左旋咪唑药剂胁迫12 h 时,dsRNA 处理组线虫的死亡率较ddH2O 对照组线虫的死亡率增加,dsRNA 处理组线虫对鱼藤酮药剂的敏感性显著提高。BxGSTs1基因沉默时,松材线虫的抗药性下降。结合前人对GST 家族酶解毒功能的研究,笔者推测松材线虫BxGSTs1 在线虫的抗氧化应激及耐药解毒方面发挥了重要作用。
总之,本文通过对松材线虫BxGSTs1基因特性及具体功能的初步研究,了解其在线虫抗氧化应激、耐药解毒等方面的重要作用,为线虫GSTs家族基因功能的全面研究奠定了基础,也为寻找药物靶标基因、生物防治线虫病提供了理论支持。但BxGSTs1基因具体如何参与线虫解毒耐药机制,还需进一步深入研究。后续可通过灰葡萄孢菌接种试验,进一步研究松材线虫BxGSTs1基因沉默后是否对松材线虫的迁移、繁殖能力、生长发育有影响;通过松树接种试验,深入研究松材线虫BxGSTs1在线虫与松树植物互作中的具体机制;通过沉默线虫的转录组测序分析,系统探究BxGSTs1基因与其它两大解毒蛋白家族基因的关系。
