玉米ZmGS5基因克隆、分子特性分析及对拟南芥的遗传转化
2021-04-21刘晓丽韩利涛蔡一林
刘晓丽 韩利涛 魏 楠 申 飞 蔡一林
(1河南农业职业学院食品工程学院,451450,河南郑州;2西南大学玉米研究所,400715,重庆)
产量性状由多基因控制,表现为典型的数量性状遗传,对产量性状的研究可为育种工作提供重要的参考信息[1]。目前,国内外关于玉米产量性状的研究主要集中在控制产量性状基因的定位方面[2]。籽粒的发育是影响产量的一个重要因素,报道的玉米籽粒发生突变的基因有50多个[3],大部分突变基因主要作用于胚乳细胞[4]或糊粉层细胞[5],如ae1、su1、su2、wx、du、bt1和bt2等影响籽粒发育、淀粉形态、物理特性以及酶活性[5];少部分突变基因,如os[6]、dek1[7]和mee1[8]等影响胚和胚乳特性[3]。
OsGS5是水稻中控制水稻籽粒大小和粒重的主效基因,该基因编码丝氨酸羧肽酶,功能研究表明它是水稻中控制籽粒大小的正向调节因子。水稻基因组相对较小,OsGS5基因的克隆和功能研究已取得突破性的进展,较高的OsGS5表达水平可参与促进细胞周期循环,加快细胞循环进程,从而促进水稻颖壳细胞的横向分裂,增大颖壳的宽度,继而加快谷粒的充实和胚乳的生长速度,最终增大种子、增加谷粒重和单株产量。在除谷粒大小目标性状有差异而遗传背景完全相同的两个遗传材料中,谷粒大的材料比谷粒小的含有较高OsGS5基因表达,大粒比小粒宽8.7%,千粒重增加7.0%,单株产量提高7.4%[9]。
水稻和玉米都是禾本科植物,来自一个共同的祖先,它们大约在5 500万年前开始分化[10]。水稻和玉米基因组具有较高的线性,基因功能在这两个作物之间也高度保守[11]。因此,玉米ZmGS5可能与水稻OsGS5一样在玉米籽粒发育中发挥重要作用,从而影响玉米产量。从NCBI可下载到玉米同源旁系基因26个,但到目前为止,国内外未见玉米ZmGS5基因的相关报道。基于OsGS5的研究,采用同源克隆的方法克隆ZmGS5,对其蛋白质理化特性、空间结构及功能进行分析预测,并对其在各组织中的相对表达量进行分析,最后采用农杆菌介导法,对纯合转基因株系的千粒重进行研究,为研究ZmGS5的生物功能提供参考。
1 材料与方法
1.1 试验材料
主要试验材料为玉米自交系B73、Mo17、郑58、昌7-2、黄C和178等;转基因所需的模式植物为野生型拟南芥(Arabidopsis thaliana,Columbia生态型)。
1.2 菌种及主要试剂
转基因所需的菌株为农杆菌EHA105和大肠杆菌Trans 5α,植物表达载体为pCAMBIA3301。试剂及材料有克隆载体pGM-T vector、凝胶回收试剂盒、质粒抽提试剂盒、RACE PCR试剂盒(TIANGEN生物技术有限公司)、卡那霉素(kanamycin,Kan)、草铵膦(phosphinothricin,PPT)、高保真酶HiFi(北京全式金生物技术有限公司)和实时荧光定量试剂盒(QPS-201 THUNDERBIRD SYBR qPCR Mix,日本TOYOBO公司)。引物合成和产物测序均由上海生工生物科技有限公司完成。
1.3 总RNA的提取及质量检测
分别收集玉米自交系B73穗期的根、茎、叶、雌穗、雄穗及授粉后14d的(14 days after pollination,14DAP)胚和胚乳,自交系Mo17、郑58、昌7-2、黄C和178叶片于–80℃保存。采用Invitrogen公司的TRIzol裂解液提取总RNA,参照说明书的步骤进行。利用1%琼脂糖凝胶电泳结合超微量分光光度计测定OD260和OD280的吸光值来检测总RNA的质量。
1.4 cDNA第一条链的合成
RNA质量检测合格后,利用反转录试剂盒合成 cDNA 第一链。反转录体系为 40μL:20μL RNA、4μL dNTP mixture、8μL Rtbuffer、2μL RNase Inhibitor、2μL Reverse Transcriptase 和 4μL RNase free ddH2O。
1.5 基因克隆
通过NCBI网站下载OsGS5序列,利用Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)工具与玉米EST数据库比对,并用BioEdit软件将比对结果进行拼接,初步得到玉米的GS5基因序列,利用Primer 5.0软件设计特异性引物ZmGS5-F和ZmGS5-R(表 1)。

表1 所有PCR扩增引物Table 1 Sequences of all PCR primers used
以B73 14DAP胚乳cDNA为模板进行PCR扩增。20μL反应体系:2μL cDNA模板、2μL HiFi Buffer I、0.5μL dNTPs、1.5μL 特异性引物(上下游混合物)、0.3μL HiFi酶和13.7μL ddH2O。PCR反应程序:94℃预变性 5min;94℃ 45s,64℃ 45s,72℃2min,35个循环;72℃延伸10min,4℃保存。
PCR产物经1%琼脂糖凝胶电泳分离,回收DNA目的片段,进行克隆筛选后选取阳性克隆送上海生工生物科技有限公司进行测序。
利用DNAMAN软件和BLAST检索GenBank进行多重序列比对和同源性分析。根据克隆测序的ZmGS5序列,利用Primer 5.0设计特异性引物(表1)进行3′和5′端RACE PCR扩增。
以14DAP胚乳cDNA为模板,分别进行第一次PCR和巢式PCR。第一次PCR扩增反应体系为 20μL:1μL cDNA 模板、2μL HiFi Buffer I、0.5μL dNTPs、1μL 基因特异性引物 GSP1、1μL 通用引物UPM、0.3μL HiFi酶和14.2μL ddH2O,PCR扩增程序:94℃预变性 3min;94℃ 30s,70℃ 45s,72℃2min,10 个循环;94℃ 30s,66℃ 45s,72℃ 2min,30个循环;72℃延伸10min,4℃保存。将第一次PCR产物稀释20倍(取5μL产物用TE Buffer稀释至100μL)作为巢式PCR的模板。巢式PCR扩增的反应体系和扩增程序同上,产物回收进行克隆筛选后送测序。
1.6 实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)分析
以玉米β-actin基因作为内参基因,依据qRTPCR引物设计要求,使用Primer 5.0设计特异性引物ZmGS5-qF和ZmGS5-qR(表1)。玉米自交系B73根、茎、叶、雌穗、雄穗、14DAP胚和14DAP胚乳cDNA分别用ddH2O稀释80倍后,采用CFX96 TouchTM荧光定量PCR仪(BIO-RAD)进行 qRT-PCR 反应,反应体系 12μL:6μL SYBR Premix EX,正反向引物各0.5μL,模板cDNA 5μL。每个样品3次重复。反应程序:95℃预变性3min;95℃变性10s、64℃退火/延伸30s(每次循环后采集荧光),40个循环,以每5s增加0.5℃的速度从65℃增至95℃进行溶解曲线分析;试验数据运用Bio-Rad ManagerTM软件进行分析,采用2-ΔΔCT法获得ZmGS5基因的相对表达量[12]。
1.7 ZmGS5蛋白的理化性质分析
用 ProtParam(http://web.expasy.org/protparam/)分析目的蛋白的氨基酸组成、等电点、分子量和带正负电荷的残基数;用ProtScale(http://web.expasy.org/protscale/)分析目的蛋白的亲/疏水性。
1.8 ZmGS5蛋白的结构分析
运用SMART(http://smart.embl.de/)分析目的蛋白结构域;用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)分析目的蛋白的跨膜结构域;分别用SOPM(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage=npsa_sopm.html)和SWISS-MODEL Workspace(http://swissmodel.expasy.org/workspace/)分析ZmGS5蛋白的二级结构及三级结构。
1.9 ZmGS5蛋白的功能预测
利用BaCelLo(http://gpcr2.biocomp.unibo.it/bacello/)预测目的蛋白的亚细胞定位;利用SignalP(http://www.cbs.dtu.dk/services/SignalP/)进行目的蛋白信号肽的分析;用NetPro 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)分析目的蛋白的磷酸化位点;利用 ProtFun(http://www.cbs.dtu.dk/services/ProtFun/)预测蛋白质的功能;用DNAMAN软件进行多序列比对;用MEGA5软件构建系统发育进化树。
1.10 拟南芥的遗传转化[13]
1.10.1 超表达载体的构建 采用质粒提取试剂盒提取扩增和测序结果均正确无误的pGM-T-ZmGS5质粒,然后用内切酶Bgl II和Pml I分别对pGM-TZmGS5质粒和pCAMBIA3301载体进行双酶切。酶切产物进行琼脂糖凝胶电泳,且对ZmGS5目标片段及pCAMBIA3301骨架进行胶回收,然后通过连接酶对ZmGS5目标片段和pCAMBIA3301骨架进行连接,构建重组表达载体。
1.10.2 转化农杆菌EHA105感受态 首先制备农杆菌EHA105感受态,然后将阳性pCAMBIA3301-ZmGS5克隆质粒转化农杆菌EHA105感受态,阳性菌液于–80℃保存备用。
1.10.3 转化野生型拟南芥 采用组培法培养野生型拟南芥,长出四叶一心后移栽进行土培,有花苞后用农杆菌EHA105感受态侵染并转化拟南芥。利用pCAMBIA3301载体上Kan和PPT抗性位点,用适当浓度的Kan和PPT溶液进行筛选,为防止出现假阳性增加工作量,需要对T0疑似阳性植株叶片DNA进行序列检测,最终筛选至T3代纯合阳性转基因拟南芥株系。
1.10.4 转基因拟南芥千粒重的测定 随机选取若干拟南芥转基因植株,测定其T3代及同批次的对照野生型拟南芥种子的千粒重,利用统计学分析数据。将T3代转基因种子和对照野生型拟南芥种子用组培法(不含抗生素的固体培养基)在相同的条件下种植,同时移栽,进行观察鉴定。
2 结果与分析
2.1 ZmGS5基因的克隆及分析
采用RACE PCR方法从玉米自交系B73 14DAP胚乳中克隆ZmGS5的全长cDNA序列,结果(图1)显示,5′-RACE结果有500bp左右,3′-RACE结果有750bp左右。序列拼接后ZmGS5全长 cDNA 1 695bp,5′-UTR(非编码区)长 52bp,3′-UTR长152bp,编码区长1 491bp,编码496个氨基酸。

图1 ZmGS5基因3′和5′端RACE扩增Fig.1 Rapid amplification of 3′ and 5′ ends of ZmGS5
2.2 ZmGS5蛋白的理化性质
根据ZmGS5推测其编码蛋白的氨基酸序列,利用ProtParam分析ZmGS5蛋白的理化性质。结果显示其分子量为55.45kDa,等电点为7.6。其一级结构(图2)丙氨酸(Ala,10.1%)、亮氨酸(Leu,8.90%)、丝氨酸(Ser,8.70%)、缬氨酸(Val,7.50%)和甘氨酸(Gly,7.10%)的含量较多,而蛋氨酸(Met,1.40%)、半胱氨酸(Cys,1.6%)和色氨酸(Trp,2.20%)的含量较少,带正电荷的氨基酸(Arg+Lys)有48个,带负电荷的氨基酸(Asp+Glu)有47个。ZmGS5蛋白的脂溶性指数为76.53,亲水性指数为–0.264。ZmGS5蛋白亲/疏水性结果(图3)显示,多肽链的第28位数值(2.778)最高,第335位数值(–3.211)最低,亲水性氨基酸略多于疏水性氨基酸,初步判定其为亲水蛋白[15]。

图2 ZmGS5蛋白的氨基酸组成Fig.2 Amino acid composition of ZmGS5

图3 ZmGS5蛋白的亲/疏水性分析Fig.3 ProtScale analysis of ZmGS5
2.3 ZmGS5蛋白的二、三级结构
ZmGS5蛋白的二级结构组成与其他植物中的同源蛋白类似,均是α螺旋、无规则卷曲、延伸链和β转角依次递减(图4)。

图4 不同植物ZmGS5同源蛋白的二级结构Fig.4 Secondary structure of different plants homologous proteins of ZmGS5
利用SWISS-MODEL进行进一步空间结构预测,结果(图5)表明ZmGS5含有丰富的α螺旋和无规则卷曲,与二级结构预测结果一致。

图5 ZmGS5蛋白的空间结构Fig.5 Spatial structure of ZmGS5 protein
2.4 ZmGS5蛋白的结构域、信号肽及跨膜区
采用SMART预测ZmGS5蛋白的结构域,从第64个氨基酸到第489个氨基酸之间有1个保守的Peptidase-S10结构域,2个蛋白的E值都非常低,表明这个结构域属于S10超家族[16],编码丝氨酸羧肽酶,是一类蛋白水解因子(表2)。

表2 ZmGS5和OsGS5蛋白的信号肽、重复组件和结构域特征值Table 2 Confidently predicted signal peptides, repeats,and domains of OsGS5 and ZmGS5
使用SignalP 4.1 Server软件预测ZmGS5蛋白的信号肽,结果显示在N端1-37氨基酸位置含有1个细胞内分泌和转运信号肽(表2,图6),这是SCP氨基酸序列相似的蛋白质(SCP-like proteins,SCPL),具有SCP的典型结构特征,因此推测ZmGS5蛋白为分泌蛋白,这与其作为酶类蛋白的生物学功能吻合。利用TMHMM Server v.2.0软件预测ZmGS5蛋白的跨膜结构域,结果显示其与水稻相同,不存在跨膜结构域,表明ZmGS5蛋白为非膜蛋白。

图6 ZmGS5蛋白信号肽的预测Fig.6 Prediction of signal peptides of ZmGS5
2.5 亚细胞定位及磷酸化位点
利用软件BaCelLo预测ZmGS5蛋白的亚细胞定位,结果显示其定位在叶绿体,定位过程为细胞内到细胞器,再到叶绿体。
利用软件NetPhos 2.0 Server预测ZmGS5蛋白的磷酸化位点,结果显示目的蛋白含有丝氨酸识别位点15个、苏氨酸识别位点5个和酪氨酸识别位点14个,其中6个丝氨酸、2个苏氨酸和9个酪氨酸识别位点与水稻相同(表3),表明玉米ZmGS5蛋白极有可能是被丝氨酸蛋白激酶、苏氨酸蛋白激酶和酪氨酸蛋白激酶进行了磷酸化修饰而激活的,从而调控了二级响应基因的表达。
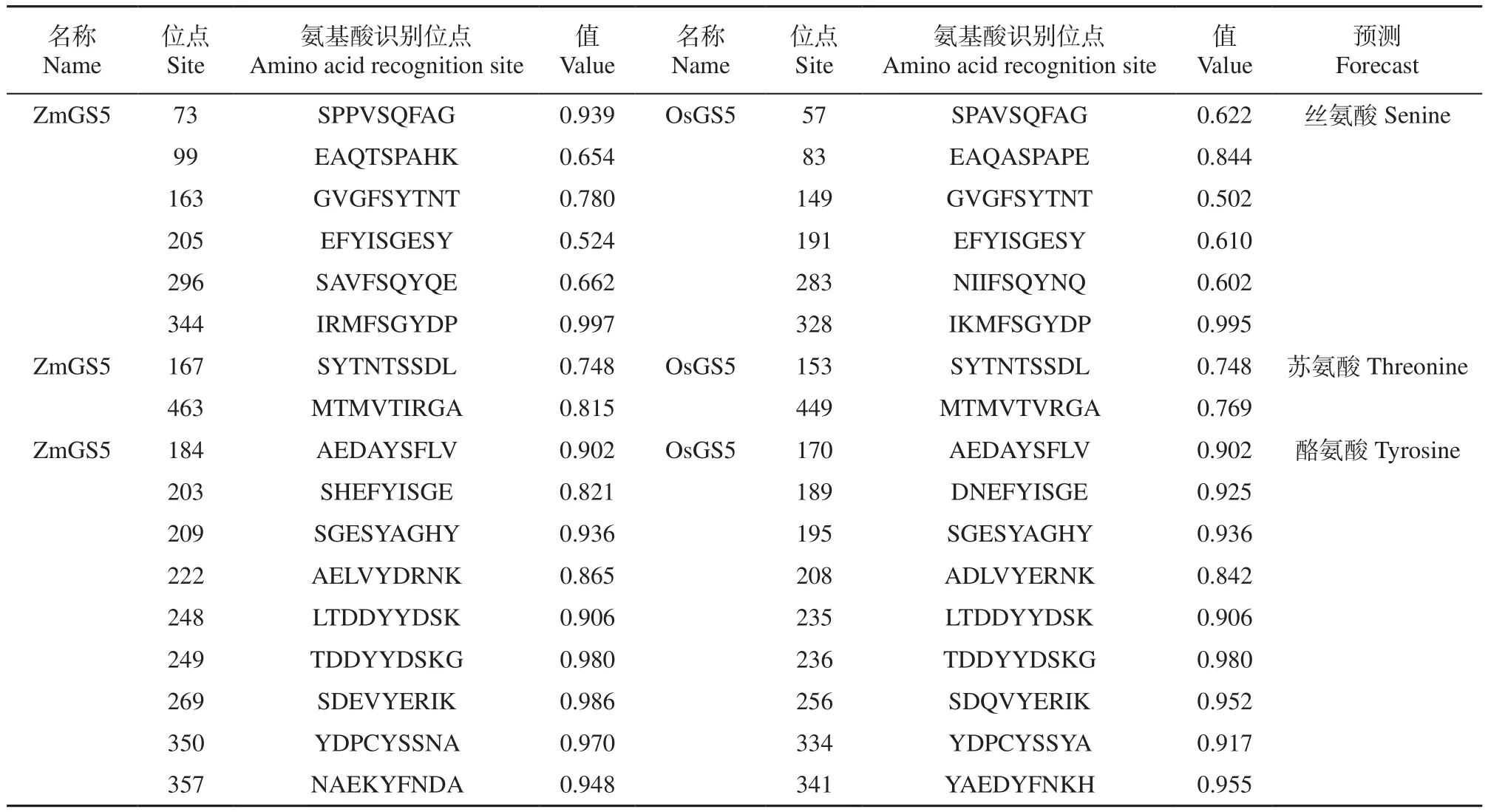
表3 ZmGS5和OsGS5蛋白磷酸化位点比较Table 3 Comparison of ZmGS5 and OsGS5 in phosphorylation sites
2.6 序列多态性分析
2.6.1ZmGS5基因同源性分析 同源性分析表明,ZmGS5基因与大刍草TeGS5基因、高粱SbGS5基因、水稻OsGS5基因及拟南芥AtGS5基因序列的同源性高达60%~98%,其中与水稻的同源性达77%,与大刍草的同源性达98%(图7)。

图7 ZmGS5与其他植物GS5基因序列同源性分析Fig.7 The homology analysis of ZmGS5 and GS5 in other plants
2.6.2 基因及蛋白质的多序列比对 以ZmGS5-F和ZmGS5-R为引物,以玉米自交系Mo17、昌7-2、郑58、黄C和178 cDNA为模板进行PCR扩增,测序结果与B73中ZmGS5序列比对,结果显示有3个碱基的插入或缺失,有17个SNP(single nucleotide polymorphism)位点(表4),说明ZmGS5cDNA序列在玉米各自交系中具有较高的保守性。
玉米各自交系ZmGS5蛋白与水稻品种H94和Zhenshan97、拟南芥、大刍草及高粱GS5蛋白氨基酸序列比对结果(图8)显示,所有氨基酸序列都在N端含有1个信号肽,都含有1个丝氨酸羧肽酶特有的Ser-Asp-His催化三联体活性位点(ISGESYAG),此结果与在水稻中的研究结果相同[9]。在11个玉米自交系中有7个氨基酸突变位点与cDNA序列突变位点相对应(表4),其中,1个氨基酸插入或缺失,1个氨基酸的突变位点位于N端信号肽上,另外5个位点(44、230、293、465和486)位于Peptidase-S10保守结构域上。

图8 蛋白质的多序列比对Fig.8 Alignment of the amino acid sequence

表4 ZmGS5基因cDNA序列和ZmGS5蛋白序列的等位基因的多态性Table 4 The change of allelic variation in cDNA sequences of ZmGS5 and amino acid sequence of ZmGS5
2.6.3 系统进化树的构建 从NCBI下载玉米SCPL家族基因序列26个,与B73、Mo17、郑58、昌 7-2、黄 C、178、H94、Zhenshan97、拟南芥(Arabidopsis thaliana)、大刍草和高粱中GS5蛋白序列比对,利用MEGA5.0软件,选择NJ法构建系统发育树,结果(图9)显示SCPL家族被分为4个群体,B73、Mo17、郑58、昌7-2、黄C、178、H94、Zhenshan97、拟南芥、大刍草和高粱都处于第Ⅱ群体,B73与大刍草进化关系最近。并且从图9可看出GS5基因在各植物间进化相对保守。

图9 SCPL蛋白家族系统进化树Fig.9 Neighbor-joining tree of SCPL family proteins
2.7 ZmGS5基因在玉米不同组织中的表达分析
以玉米β-actin为内参基因,通过qRT-PCR分析ZmGS5在不同组织中的表达。结果(图10)显示,ZmGS5在雄穗和叶中表达量高,在胚和胚乳中表达量低,其表达量趋势与GS5在水稻各组织中的表达量趋势相似。水稻qRT-PCR结果显示GS5在绿色组织叶中的表达量较高;非绿色组织中GS5的表达量在不同时期和不同长短穗中相对较高,而在胚及胚乳中的表达量相对较低[23],此结果为探索ZmGS5基因的功能奠定了理论基础。

图10 ZmGS5基因在玉米不同组织中的qRT-PCR分析Fig.10 The qRT-PCR analysis of ZmGS5 gene expression in different tissues of maize
2.8 ZmGS5基因多态性与玉米籽粒大小的关系
上述11个玉米自交系籽粒表型各不相同(图11)。Mo17籽粒最大,I15016籽粒最小,它们的cDNA序列和氨基酸序列有较大不同。11个自交系籽粒表型相关指标测定结果(表5)显示,Mo17百粒重28.28g为最大值,I15016百粒重18.04g为最小值。综合两品种的测定结果,Mo17仍为11个自交系中的最大籽粒,I15016为最小籽粒,此结果与多序列分析结果相对照,11个自交系的籽粒表型差异显著且序列有多个位点存在差异,推测存在差异的第15、23、44、230、293、465和486这7个氨基酸突变位点可能在籽粒发育过程中起重要作用,可为其进一步的功能验证提供参考信息。

图11 11个自交系的籽粒表型Fig.11 Kernel phenotypes of eleven inbred lines
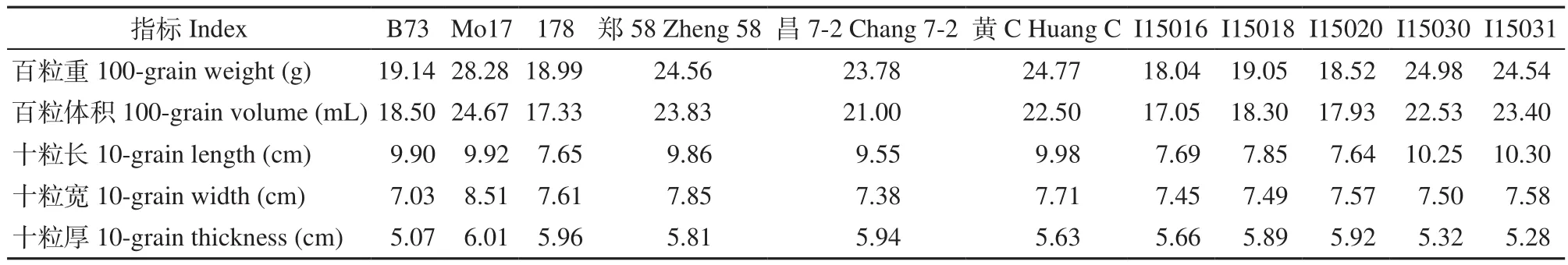
表5 11个自交系籽粒表型分析Table 5 Phenotypic analysis of eleven inbred lines kernels
2.9 ZmGS5基因转化拟南芥
待野生型拟南芥抽薹3~8cm且刚开始开花时,将从B73中克隆的ZmGS5的cDNA序列连接到表达载体pCAMBIA3301上,通过农杆菌浸染花絮法将ZmGS5转入拟南芥中,待到荚果自然成熟干燥后收取T0代种子。
2.10 阳性ZmGS5转基因种子的筛选
经过抗生素筛选及基因序列检测选出了T0代(图12),继续经过抗生素筛选,根据孟德尔遗传定律T1代两个株系都出现约3∶1的分离比(图13);T2代种子一些株系按照3∶1的分离比分离(培养基上部),而不发生分离的株系即为纯合株系(培养基下部);收取T2代纯合株系的种子,得到T3代纯合阳性转基因株系。

图12 T0代拟南芥叶片检测ZmGS5基因Fig.12 The detection of ZmGS5 in the leaves of T0 generation

图13 T1代和T2代转基因拟南芥的筛选Fig.13 Screening of the T1 and T2 generations of transgenic Arabidopsis
2.11 ZmGS5基因对拟南芥籽粒重的影响
得到13个纯合转基因株系的255个拟南芥单株的T3代种子,以及5个单株同批次的野生型拟南芥种子。随机选取37份T3代纯合转基因株系和5份野生型种子分别测定千粒重(表6),T3代千粒重最大值与最小值分别为0.0192和0.0147g。

表6 野生型和T3代转基因拟南芥的千粒重Table 6 The 1000-seed weight of the wildtype plants and T3 plants of Arabidopsis
与野生型拟南芥相比,所有T3代的千粒重均有所增加。野生型千粒重的平均值为0.0139g,T3代千粒重的平均值为0.0169g,相比野生型增加22.29%。显著性测验(t0.01=2.704)结果显示T3代转基因拟南芥和野生型拟南芥千粒重之间达到极显著水平,表明ZmGS5基因可以增加拟南芥的千粒重。
3 讨论
经过对ZmGS5分析可知,ZmGS5编码的蛋白含有15个丝氨酸蛋白激酶磷酸化位点、5个苏氨酸蛋白激酶磷酸化位点和14个酪氨酸蛋白激酶磷酸化位点。蛋白质的磷酸化和去磷酸化在细胞信号转导中起重要作用,几乎涉及所有的生理过程,如糖代谢、细胞生长发育和基因表达等,是生物体中普遍存在的一种调节机制[14-15],因此,这些磷酸化位点的发现可为ZmGS5在玉米生长发育过程中的具体功能研究奠定基础。
本研究结果显示,ZmGS5编码的丝氨酸羧肽酶是一类真核生物蛋白水解酶,属于α/β水解酶类蛋白家族,丝氨酸羧肽酶属于SC族羧肽酶中的S10家族[16],SCPL基因在参与种子发育、种子萌发中贮藏蛋白的水解、细胞程序性死亡中细胞成分的自溶等过程中起作用。已有大量丝氨酸羧肽酶及其类蛋白编码基因从植物中分离出来,己从水稻、拟南芥、玉米、大麦、番茄和豌豆等高等植物中分离出SCP基因,且已从水稻、拟南芥和豌豆等植物中分离纯化到SCP蛋白,并对其特性及表达进行分析[17-20]。虽然丝氨酸羧肽酶及其类蛋白家族庞大,成员众多,但其确切的生物学功能尚不清楚[13]。
与OsGS5相比较可知,ZmGS5蛋白与OsGS5蛋白在结构上相似,在N端都含有1个信号肽,都含有SCPL蛋白所特有的催化活性中心,且在系统发育进化中具有较高的亲缘关系,在qRT-PCR分析中得到相同的结论。
采用农杆菌介导法进行ZmGS5基因的拟南芥遗传转化,通过筛选和鉴定后,得到阳性转基因植株,最终得到纯合T3代转基因株系,通过对纯合转基因株系和野生型拟南芥进行比较鉴定,推测ZmGS5基因在拟南芥中的功能。
4 结论
根据水稻中已经克隆的决定籽粒大小的关键基因OsGS5,利用同源克隆的方法,从玉米基因组中克隆出1条全长1 695bp的基因片段,开放阅读框1 491bp,编码496个氨基酸残基,蛋白序列与OsGS5基因编码的蛋白序列高度同源,一致性达77%。推测ZmGS5在籽粒发育过程中具有重要作用,从而影响玉米产量。ZmGS5可增加拟南芥千粒重。
