绵羊ATF3 基因的生物信息学分析及其在营养剥夺应激下的表达变化
2021-04-21李俊玲郭丽荣郭田燕
李俊玲,郭丽荣,郭田燕,秦 健,杜 荣*
(1.山西农业大学动物医学学院,山西太谷 030801;2.山西农业大学实验教学中心,山西太谷 030801;3.山西农业大学生命科学学院,山西太谷 030801)
应激最早由加拿大病理学家Hans Selye 提出,指动物机体在受到外界各种不良刺激时发生的非特异性应答反应[1]。营养应激是由于外界特殊的营养环境(营养过高或过低)导致细胞代谢失衡甚至紊乱而发生的应答反应[2]。营养应激中研究较多的是营养剥夺应激,禁食是一种慢性的营养不足,是指在8~12 h 或几天内不摄入或摄入很少的热量[3-4]。ATF3(Activating Transcription Factor 3)是cAMP-CREB 转录因子家族的一员,它可以被多种应激诱导表达[5]。ATF3 包含一个碱基区亮氨酸拉链(bZIP)结构,该结构与CREB或AP-1 顺式调节元件结合,可根据细胞环境抑制或激活靶基因的转录[6-7]。在多种应激条件下,ATF3 会通过表达改变而发挥其作用。有研究表明,运动后小鼠骨骼肌ATF3表达量明显升高[8]。ATF3 可防止应激诱导的小鼠造血干细胞衰竭[9]。ATF3 可参与斑马鱼视神经的再生,在斑马鱼脊髓损伤后12 h 和6 d 其mRNA 水平会明显升高[10-11]。多项研究表明,在营养应激条件下肝脏ATF3 的表达会发生显著改变。与未修改豆油组相比,给大鼠喂养含有10%的酯化豆油8 周后,其肝脏ATF3基因表达量升高[12]。通过比较新孵化小鸡禁食48 h 和禁食后再喂养48 h 的肝脏转录组发现,后者ATF3 表达量更高[13]。禁食48 h 后再喂养标准饲料后的前17 h,小鼠肝脏中ATF3基因表达升高;禁食46 h 后再喂养含有α-淀粉或葡萄糖的琼脂凝胶14 h,小鼠肝脏中ATF3基因表达量增加[14-15]。目前有关家畜ATF3 的研究相对较少。有研究表明,ATF3基因在延边黄牛心脏、肝脏、脾脏、肺脏、肾脏、后腿肌、眼肌、西冷、上脑和皮下脂肪10 个部位组织中均有表达,可能影响机体的脂肪沉积[16]。目前,针对绵羊ATF3 的研究还鲜见报道。因此,本实验旨在对绵羊ATF3 的结构和特性进行一系列生物信息学分析,并通过qRT-PCR 检测禁食条件下ATF3mRNA 的表达,利用Genomatix 软件预测ATF3启动子区调控元件,以了解绵羊ATF3 的分子特性并探讨ATF3基因在绵羊营养剥夺应激条件下的表达变化及可能的表达调控原因,为进一步深入研究绵羊ATF3基因的表达调控及作用机制并发掘其应用潜能提供依据。
1 材料与方法
1.1 实验动物及样品采集 本实验选用6 月龄、体重45 kg左右的6 只母羊,随机分为正常组和禁食组,正常组常规饲养,禁食组禁食3 d。3 d 后分别采集6 只绵羊大腿部位的半腱肌组织,并迅速放于液氮中储存。
1.2 主要仪器 电子分析天平产自奥豪斯国际贸易(上海)有限公司;超净工作台产自苏州安泰空气技术有限公司;核酸蛋白浓度测定仪产自美国Thermo 公司;电泳仪电源、电泳槽产自北京六一仪器厂;96 孔温度梯度PCR 仪、荧光定量PCR 仪、全自动凝胶成像系统均产自美国BIO-RAD 公司。
1.3 绵羊ATF3 蛋白的生物信息学分析 从NCBI 网站上下载绵羊ATF3 的蛋白序列,利用表1 中的生物信息学网站和软件对其进行分析。
1.4 总RNA 提取及cDNA 合成 将绵羊骨骼肌置于装有液氮的研钵中进行充分研磨,研磨后加入RNAiso Plus(TaKaRa)进行总RNA 提取。取少量RNA 进行核酸电泳检测,鉴定RNA 是否降解,用核酸浓度测定仪检测RNA 浓度。用PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)进行反转录。第一步需要先去除基因组DNA,反应体系和条件:5×gDNA Eraser Buffer 2 μL,gDNA Eraser 1 μL,Total RNA 4 μL,RNase Free dH2O 补至10 μL;42℃ 2 min,4℃ 2 min。第二步为反转录反应,反应体系和条件:步骤一反应液10 μL,PrimeScript RT Enzyme Mix I 1 μL,RT Primer Mix 1 μL,5×PrimeScript Buffer 4 μL,RNase Free dH2O 补至20 μL;37℃ 15 min,85℃ 5 s,4℃ 2 min。之后用核酸浓度测定仪检测反转录后的cDNA 浓度。
1.5 引物设计及合成 通过NCBI 上的Primer-BLAST设计引物(表2),送至北京华大科技有限公司合成。
1.6 qRT-PCR 将反转录后的cDNA 稀释为100 ng/μL,以稀释后的cDNA 为模板进行实时荧光定量PCR,反应体系和条件:TB Green Premix Ex Taq II(2×)5 μL、PCR Forward Primer(10 μmol/L)0.4 μL、PCR Reverse Primer(10 μmol/L)0.4 μL、DNA 模板 1 μL,灭菌水补足至10 μL;预变性95℃ 2 min,PCR 反应95℃ 30 s、65℃ 34 s 共40 个循环。每组3 个动物样本,每个样本重复3 次。
1.7 统计分析 利用2-ΔΔCT算法分析实时荧光定量PCR结果。运用SPSS 21.0 软件中独立样本T 检验进行方差分析。P<0.05 为差异显著,P<0.01 为差异极显著。运用GraphPad Prism 8 制作柱状图。
1.8 绵羊ATF3基因启动子区调控元件的分析 从NCBI上下载绵羊ATF3基因启动子区序列,运用Genomatix 软件中的Matlnspector 分析其调控元件及相应的转录因子。
表1 分析绵羊ATF3 蛋白结构特征的生物信息学网站和软件

表2 内参和目的基因引物序列
2 结果与分析
2.1 绵羊ATF3 的生物信息学分析结果
2.1.1 绵羊ATF3 蛋白理化性质分析结果 运用ProtParam在线网站对绵羊ATF3 蛋白理化性质进行分析,结果显示该蛋白氨基酸残基数为187,分子质量为21 303.58,分子式为C920H1521N273O282S12,原子总数为3 008,理论等电点为8.89。带负电荷氨基酸残基(Asp+Glu)总数为26,带正电荷氨基酸残基(Arg+Lys)总数为31。不稳定系数是71.73,把该蛋白归为不稳定蛋白。脂肪系数为78.77,总平均疏水性值为-0.630。
2.1.2 绵羊ATF3 蛋白亚细胞定位和结构预测结果 运用PredictProtein 在线网站分析绵羊ATF3 蛋白的亚细胞定位,可以看出绵羊ATF3 蛋白定位于细胞核,说明该蛋白主要在细胞核行使功能(图1A)。运用SOPMA 在线网站预测绵羊ATF3 蛋白二级结构,结果显示α螺旋有100 个,占53.48%;β折叠有15 个,占8.02%;β转角有11 个,占5.88%;无规则卷曲有61 个,占32.62%(图1B)。运用SWISS-MODEL 在线网站预测绵羊ATF3 蛋白的三级结构,结果显示该蛋白三级结构α螺旋和无规则卷曲居多(图1C),与二级结构预测结果相一致。

图1 绵羊ATF3 蛋白亚细胞定位和结构预测
2.1.3 绵羊ATF3 蛋白三级结构的评估结果 运用SAVES 在线网站评估绵羊ATF3 蛋白的三级结构,结果显示残基在[A,B,L]区域占比100%,在[a,b,l,p]区域、[~a,~b,~l,~p]区域和无标记区域(不允许圆点出现的区域)都为0(图2)。通常评估的判定标准是[A,B,L]区域达到90% 以上便认为三级结构的预测质量较高,可见本实验预测的绵羊ATF3 蛋白三级结构质量良好。

图2 绵羊ATF3 三级结构的拉式构象图
2.1.4 绵羊ATF3 蛋白疏水性和磷酸化位点分析结果运用ProtScale 在线网站分析绵羊ATF3 蛋白的疏水性(图3A),结果显示在第24 位氨基酸(Ala)处分值最大,为1.756,表明该区域为高疏水性区域;在第97和98 位氨基酸(Arg 和Arg)处分值最小,为-4.144,该区域为高亲水性区域。运用KinasePhos 在线网站分析绵羊ATF3 的磷酸化位点,结果显示该蛋白存在3 个丝氨酸位点和2 个苏氨酸位点(图3B)。

图3 绵羊ATF3 蛋白疏水性(A)和磷酸化位点(B)分析
2.1.5 绵羊ATF3 氨基酸序列同源性及系统进化树分析结果 运用DNAStar 软件分析绵羊ATF3 氨基酸序列的同源性及系统进化树,结果显示,绵羊ATF3 氨基酸序列与山羊(XP_017916237.1)、牛(XP_010811857.1)、猪(XP_020919512.1)、兔(XP_008266664.1)、猕猴(NP_001252939.1)、人(NP_001025458.1)、大鼠(NP_037044.1)、小鼠(NP_031524.2)、鸡(XP_015139364.1)、斑马鱼(NP_957258.1)相应序列之间的同源性分别为100%、98.4%、99.5%、97.8%、97.8%、97.3%、96.2%、96.2%、86.3%、72.9%(图4A)。进化树显示绵羊ATF3与牛、山羊、猪处于同一分支(图4B),表明其亲缘关系相近。
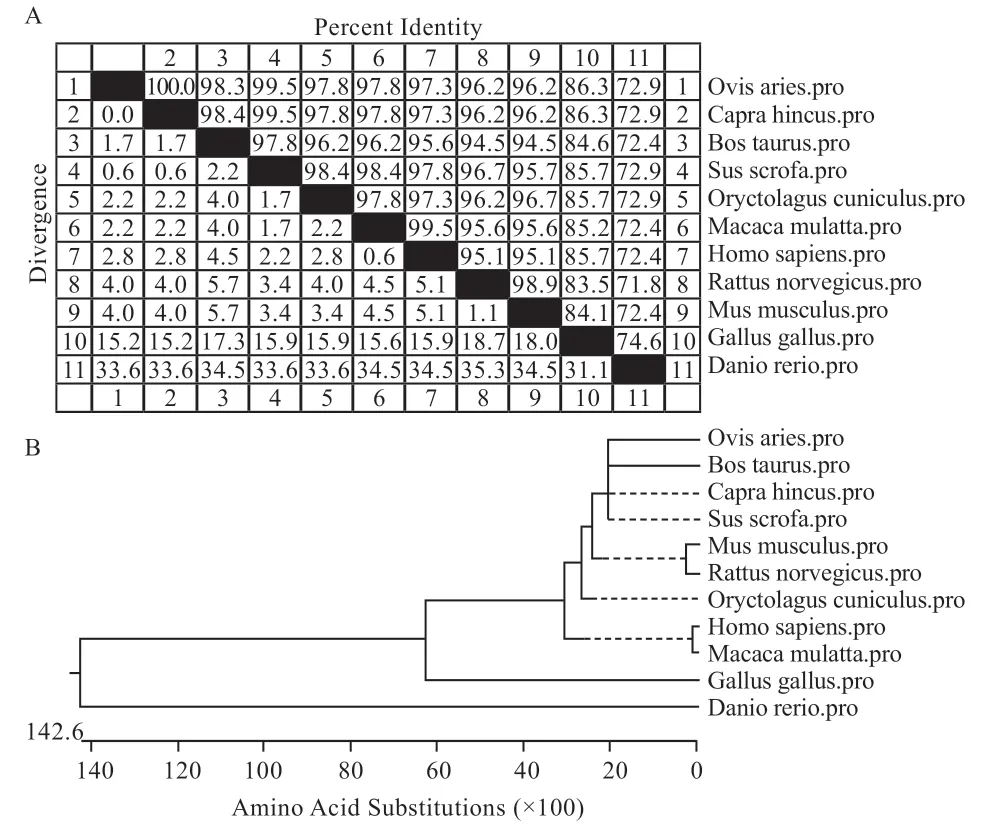
图4 绵羊ATF3 氨基酸序列同源性(A)及系统进化树(B)分析
2.2 荧光定量分析结果 对正常组和禁食组绵羊肌肉ATF3mRNA 的表达进行实时荧光定量检测,结果显示相对于正常组,禁食组ATF3mRNA 表达量极显著降低了92.33%(图5)。

图5 正常组和禁食组绵羊肌肉ATF3mRNA 表达水平
2.3 绵羊ATF3启动子区调控元件的分析 Matlnspector分析绵羊ATF3基因启动子区,结果显示绵羊ATF3基因2 kb 启动子区存在许多调控元件,其中包括与应激相关的多种元件,如CREB、NFKB、AP1 和GRE 等(表3)。
3 讨 论
本研究分析表明,绵羊ATF3 蛋白的不稳定系数是71.73,归为不稳定蛋白,这为进一步研究中构建重组载体时需要通过融合特定标签或替换特定氨基酸等措施来增加ATF3 的稳定性提供了启示。亚细胞定位结果显示绵羊ATF3 蛋白位于细胞核,符合ATF3 作为转录因子的功能特点。大部分核定位信号的共同特征是含有起关键作用的碱性氨基酸,例如Lys-和Arg-[17],而绵羊ATF3 氨基酸序列第94~99 位(RKKRRR)刚好富含Lys-(缩写K)和Arg-(缩写R),所以推测绵羊ATF3 蛋白定位于细胞核可能与其具有核定位信号有关。绵羊ATF3 氨基酸序列与山羊、牛、猪、兔、猕猴、人、大鼠和小鼠相应序列之间的同源性均超过95%,说明ATF3基因编码序列在不同物种间具有较高的保守性和一定的变异性,这为进一步通过比较不同物种间ATF3的功能和结构差异来鉴定发挥特异性作用的氨基酸位点提供了部分依据。
ATF3 在应激刺激下形成二聚体激活或抑制靶基因表达,可调节动脉粥样硬化形成、葡萄糖稳态和肿瘤发生等代谢或与代谢相关的过程[5,18]。高密度脂蛋白具有抗动脉粥样硬化的作用,可诱导ATF3 的表达[19]。ATF3在肝脏中的表达可以通过抑制糖异生导致葡萄糖稳态缺陷[20]。低葡萄糖可以诱导胰岛α细胞和β细胞ATF3基因的表达,而上调的ATF3能提高胰高血糖素的转录,但不能提高胰岛素的转录[21]。然而,本研究中,禁食组绵羊ATF3mRNA 表达量极显著降低,与上述ATF3调节糖代谢的作用模式似乎并不一致,这可能与反刍动物特有的糖代谢机制有关,确切原因需要进一步深入研究。

表3 绵羊ATF3 启动子区调控元件和位点分析
启动子区转录因子结合元件的分析可以为研究ATF3基因的转录调控机制提供依据。Liang 等[22]和Hai[23]对人ATF3 5'端启动子区域的序列分析显示有大量的转录因子结合位点,如AP-1、ATF/CRE、NF-KB。对绵羊ATF3基因启动子区的分析也发现了许多调控元件,其中部分元件如CREB、NFKB、AP1 和GRE 等及其相应的转录因子在其他物种的一些研究中被证明与应激有关。在应激条件下,大鼠海马神经元中CREB 的磷酸化水平发生变化[24]。在LPS、poly I:C、CpG-DNA、PGN 或不同浓度嗜水气单胞菌处理的各种刺激下,日本鳗鱼肝脏细胞IKKα表达显著增强,而IKKα表达又可显著诱导NF-KB 和AP-1 表达上调[25]。Xu 等[26]研究表明,PM2.5 暴露可诱导人血管内皮细胞中AP-1 及其组分c-Jun 和ATF2 的激活。糖皮质激素(GCs)参与调节许多生理过程,如炎症、代谢和应激反应,主要通过与其同源受体GR 结合,之后GC-GR 再结合于靶基因的GRE 或nGRE 元件,发挥正向或负向调节作用[27]。哺乳动物和斑马鱼等多种生物已被证实在应激条件下会分泌GCs,通过GC-GR-GRE 途径来调控靶基因转录[28-29]。由此可以推测,CREB、NFKB、AP1 和GRE 等元件与相应转录因子的结合可能是介导绵羊营养剥夺后骨骼肌ATF3表达下调的部分原因。这一复杂的调控机制亟待进一步深入系统地研究证实。
4 结 论
本研究通过生物信息学软件对绵羊ATF3基因的分子特性及启动子区转录调控元件进行了分析预测,且通过定量PCR 检测发现禁食条件下绵羊ATF3mRNA 的表达显著下降,为进一步深入研究ATF3基因的表达调控及作用机制奠定了基础。
