胸椎旁神经阻滞联合自控静脉镇痛对胸腔镜肺癌根治术后免疫功能及不良反应的影响
2021-04-21高云飞哈斯艳史少霞帕力哈提刘磊温宗梅宗华刘宏宇
高云飞,哈斯艳,史少霞,帕力哈提,刘磊,温宗梅,宗华,刘宏宇
(1.新疆医科大学第八附属医院麻醉科,新疆 乌鲁木齐 830009;2.同济大学附属上海市肺科医院麻醉科,上海 200000;3.新疆维吾尔自治区职业病医院麻醉科,新疆 乌鲁木齐 830000)
外科手术是治疗非小细胞肺癌(non small cell lung cancer,NSCLC)的首选方法[1],早期NSCLC可通过以手术为主的综合治疗达到临床治愈。近年来,随着临床诊断技术的提高和防癌筛查的普及,越来越多的早期NSCLC能够被及时确诊和治疗[2]。NSCLC的外科手术方式包括传统开胸手术和微创手术,临床医生需根据患者基础状态、肿瘤生物学特征及术者习惯选择合适的术式。相对于传统开胸手术,以胸腔镜为代表的微创胸外科技术能更大限度地保留肺组织,降低手术创伤,减少并发症,促进术后康复,提高生存质量。随着微创胸腔镜手术的手术适应证和手术方式进一步规范,其在NSCLC治疗中的临床应用也日益广泛[3]。术后免疫功能保护是NSCLC手术治疗的重要环节之一,肿瘤组织可对患者的免疫功能造成不同程度的损害,手术治疗虽然能够消除瘤体造成的免疫抑制,但手术引起的创伤应激反应、疼痛刺激及麻醉药物应用也会加重患者术后的免疫抑制[4]。目前,术后疼痛仍是困扰着NSCLC手术患者的棘手临床问题。据调查[5],开胸手术患者术后疼痛发生率可超过70%,重度和极重度疼痛患者可超过30%,有的疼痛可持续几个月甚至数年,对其心理状态、生活质量和肺功能恢复造成严重的不良影响,因此在NSCLC围术期对患者实施良好的镇痛管理至关重要。临床上,传统疼痛处理是患者告知医护人员疼痛感后给予间断静脉或肌肉注射镇痛药物,随着自控静脉镇痛(patient controlled intravenous analgesia,PCIA)等新型术后镇痛技术的出现,NSCLC患者的术后疼痛管理已取得了较大的进步,但单独应用PCIA仍然难以达到理想的镇痛效果,且患者可能因应用镇痛药物过量而出现较多的不良反应。因此,多模式镇痛(multimodal analgesia,MMA)成为了胸科术后镇痛的重要发展方向[6]。胸椎旁神经阻滞(thoracic paravertebral block,TPVB)是通过在胸椎旁间隙注射局部麻醉药阻滞同侧多个节段支配的躯体和交感神经的麻醉镇痛方法,在手术麻醉镇痛及快速康复外科中应用较多。将TPVB联合PCIA作为MMA方案已成为重要的手术镇痛方案,但其是否能够在胸腔镜NSCLC根治术后起免疫功能保护及减少麻醉镇痛不良反应方面作用,仍存在争议。本研究采用前瞻性随机对照方式对TPVB联合术后PICA对胸腔镜NSCLC根治术后免疫功能及不良反应的影响进行了研究和分析。
1 资料与方法
1.1 一般资料
选取2018年6月至2019年12月新疆医科大学第八附属医院收治的120例NSCLC患者作为研究对象,采用自愿接受镇痛的方式将其分为研究组和对照组,每组各60例。研究获得医学伦理委员会审核通过,患者或其家属知情同意。
纳入标准:所有患者均符合美国国家综合癌症网络(national comprehensive cancer network,NCCN)制订的《NSCLC临床实践指南(2017,V5)》中的NSCLC诊断标准[7],均经术前组织活检或切除组织术后病理检查证实,临床分期为Ⅰ~Ⅱ期,美国麻醉师协会(American society of anesthesiologists,ASA)分级为Ⅰ~Ⅱ级,具有行肺癌根治术指证并择期于胸腔镜下行肺癌根治术。排除标准:(1)合并肺外恶性肿瘤、肝肾功能不全、严重心肺疾病、凝血功能障碍的患者;(2)具有胸椎旁穿刺或PCIA应用禁忌的患者;(3)对本研究应用的麻醉药物有过敏史的患者;(4)合并慢性疼痛或酒精、药物依赖的患者;(5)入组前15 d内有应用阿片类镇痛药物、糖皮质激素、免疫调节剂的患者;(6)合并语言听力障碍、精神疾患、认知功能障碍或者意识障碍的患者。
1.2 麻醉镇痛方法
麻醉前30 min给予0.5 mg阿托品肌注,入室后常规建立静脉通路,给予监测血压、血氧饱和度、心电图等监测,同时于局麻下行桡动脉置管监测动脉压,采用咪达唑仑(0.1 mg/kg)、罗库溴铵维库溴铵(0.1 mg/kg)、舒芬太尼(0.3 μg/kg)、丙泊酚(1.5 mg/kg)进行麻醉诱导后行气管插管。研究组患者在麻醉诱导完成后取侧卧位,选取术侧T5棘突下缘旁开2~3 cm为穿刺点,采用EPOCH 650便携式超声仪(日本Olympus公司)进行引导,采用高频线阵探头,设置频率为7.5~10.0 MHz,扫描深度为4.5~5.5 cm。采用20 G穿刺针以平面内方式进针行椎管穿刺,回抽无血或脑脊液时注入0.5%罗哌卡因(2 mg/kg)。术中采用瑞芬太尼舒芬太尼(0.01~0.05 μg·kg-1·min-1)、丙泊酚(2 mg·kg-1·h-1)静脉泵注以进行麻醉维持,术中依据心率、血压等监测指标变化调整麻醉药用量,酌情间断给予0.015 mg/kg罗库溴铵维持肌松,根据脑电双频指数(bispectral index,BIS)监测情况适时调整麻醉深度,使BIS维持40~60。两组患者术后均采用舒芬太尼复合地佐辛进行PCIA,以0.9%氯化钠溶液将舒芬太尼(1.5 μg/kg)、地佐辛(0.2 mg/kg)、托烷司琼(0.15 mg/kg)稀释至100 mL注入镇痛泵,连接静脉通路后由患者根据疼痛情况进行自控给药。
1.3 观察指标
1.3.1 临床资料 通过查阅入院病历,对两组患者的年龄、性别构成、体质指数(body mass index,BMI)、合并基础疾病、临床分期、病理类型、ASA分级等一般资料进行调查和对比。
1.3.2 镇痛效果 对两组患者术后48 h内PICA按压次数进行记录和对比。于术后6 h、12 h、24 h、48 h对两组患者静息状态及咳嗽状态下视觉模拟量表(visual analogue scale,VAS)评分进行评价和对比。
1.3.3 术后免疫功能及应激水平 于术前1 d及术后48 h采用抗凝管采集两组患者的外周静脉血样本3 mL,采用Attune NxT 流式细胞仪(美国Thermo Fisher Scientific公司)对外周血CD4+T淋巴细胞比例、CD8+T淋巴细胞比例、CD4+/CD8+T淋巴细胞比值进行检测和对比,另用普通直空管采集2 mL血样,于室温下静置1 h后以3 000 rpm(离心半径10 cm)离心15 min,移取血清样本采用COBAS 501型全自动血液生化分析仪(瑞士Roche公司)对血清皮质醇(cortisol,Cor)、前列腺素E2(prostaglandin E2,PGE2)进行检测和对比。
1.3.4 术后镇痛不良反应 对两组患者术后呼吸抑制、恶性呕吐、低血压、嗜睡、皮肤瘙痒、尿潴留等不良反应发生率进行记录和对比。
1.4 统计学分析
2 结果
2.1 两组患者一般资料的比较
两组患者一般资料比较,差异无统计学意义(P>0.05)。见表1。
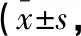
表1 两组患者一般资料的比较分)
2.2 两组患者镇痛效果的对比
两组患者均顺利完成手术,术中均未发生严重并发症、死亡,且无中转开胸手术病例。术后经住院治疗直至出院,无住院死亡病例。未见术后48 h内终止应用PICA的病例。在术后48 h内,研究组和对照组患者PICA按压次数分别为(14.15±4.16)次和(22.15±6.37)次,差异有统计学意义(t=-8.145,P<0.001)。可重复方差分析结果显示,在术后各时点,研究组患者静息及咳嗽状态下的VAS评分均低于对照组,两组患者术后各时点VAS评分的组间效应、组内效应、组间组内交互效应均有统计学意义(P<0.05)。见表2。
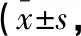
表2 两组患者术后各时点静息、咳嗽状态下VAS评分分)
2.3 两组患者手术前后免疫应激指标的对比
两组患者术前1 d时外周血T淋巴细胞亚群和血清应激激素水平比较,差异无统计学意义(P>0.05);在术后48 h时,两组患者的外周血CD4+T淋巴细胞比例、CD4+/CD8+T淋巴细胞比值均较术前下降,外周血CD8+T淋巴细胞比例及血清Cor、PGE2水平均较术前上升,差异均有统计学意义(P<0.05),但研究组患者的外周血CD4+T淋巴细胞比例、CD4+/CD8+T淋巴细胞比值高于对照组,外周血CD8+T淋巴细胞比例及血清Cor、PGE2水平低于对照组,差异有统计学意义(P<0.05)。见表3。
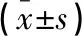
表3 两组患者手术前、后免疫应激指标的对比
2.4 两组患者术后镇痛不良反应比较
研究组和对照组患者的术后镇痛不良反应总发生率分别为11.67%和31.67%,差异有统计学意义(P<0.05);但两组患者各项不良反应发生率比较,差异无统计学意义(P>0.05)。见表4。

表4 两组患者术后镇痛不良反应的对比[n(%)]
3 讨论
本研究指出,相对单独采用PCIA,胸腔镜NSCLC根治术中采用TPVB联合PCIA方式进行镇痛,在术后早期可达到更好的镇痛效果,减少该阶段PCIA的使用频率。临床上的传统开胸手术具有切口长、神经和肌肉损伤大的不良体征,可引起剧烈的术后疼痛,主要归因于手术过程中的神经末梢机械损伤对组织细胞产生伤害性刺激,诱导受损组织释放大量炎性致痛物质,并导致组织水肿等炎性反应[8-9],这一病理过程提升了神经细胞的敏感性和对疼痛的反应强度,降低了疼痛阈值[10]。虽然胸腔镜手术的手术创伤和术后疼痛程度要低于开胸手术,但其病理生理机制与开胸术后疼痛一致,引发疼痛的主要原因均为手术切口、局部创伤、胸腔引流置管、肩膀疼痛综合征等[11],对患者机体的炎症损害和伤害性刺激不会因手术方式的不同而产生差异。术后疼痛仍然是影响患者康复的重要继发症,特别是在患者咳嗽、排痰、变换体位时,疼痛仍然较为剧烈。术后疼痛引起的交感神经兴奋可导致心肌梗死、中风等高危并发症的发生,疼痛导致的术后呼吸运动受限易引起肺炎、肺不张、低氧血症、呼吸衰竭等肺部并发症及血栓形成,术后急性疼痛大多发生在术后24~48 h,故通常需及时进行术后早期的有效镇痛以减少并发症、提高患者的生活质量[12]。目前,用于胸科手术的术后镇痛方法分为全身镇痛和局部镇痛两类,其中局部镇痛主要包括TPVB、肋间神经阻滞、肋间神经冷冻、胸膜间镇痛、硬膜外镇痛、持续滴灌肋间神经阻滞等,各有其适应证、禁忌证和优缺点。本研究结果肯定了TPVB局部镇痛联合PCIA全身镇痛的MMA方案的镇痛效果,这提示了在胸腔镜NSCLC根治术的镇痛管理中,可尝试应用该方案以提高镇痛效果。
本研究结果提示,与单独采用PCIA进行镇痛相比较,胸腔镜NSCLC根治术中采用TPVB联合PCIA方式进行镇痛能够在一定程度上降低患者术后免疫功能损害和应激水平,有利于减少术后并发症、促进患者康复。针对NSCLC的传统开胸手术可造成严重的术后免疫功能损害和炎症应激损害。相关研究[13]证实,胸腔镜手术对NSCLC患者的术后恢复更有利,能够降低患者的术后炎症反应水平并改善细胞免疫功能和体液免疫功能指标。还有研究[14-15]显示,NSCLC根治中采用舒芬太尼PCIA方案能够在稳定患者血流动力学指标、改善机体免疫功能、抑制机体应激反应等方面发挥积极的作用,而采用舒芬太尼联合地佐辛的复合用药方案的效果优于单用舒芬太尼;在胸腔镜NSCLC根治中采用TPVB对于缓解术后疼痛、改善肺功能及免疫功能指标也具有积极的作用[16],在联合PCIA的情况下,可减少术后阿片类药物用量,从而利于术后免疫功能的改善和恢复[17],与本研究结果基本一致。分析其原因可能是术中TPVB不仅能够进一步缓解手术早期的疼痛应激,而且还能减少围术期静脉麻醉镇痛药物的用量,减轻了因疼痛和麻醉药物应用而产生的免疫应激损害和血流动力学指标波动,进而达到了缓解术后免疫功能下降的目的。
本研究显示,在胸腔镜NSCLC根治术中采用TPVB联合PCIA方式能够在减少镇痛不良反应。近年来的相关研究[18]指出,在胸腔镜NSCLC手术中应用TPVB、硬膜外阻滞、肋间神经阻滞等局部镇痛方式,可减少肺部感染、肺不张、房颤、术后认知功能障碍等并发症或不良反应的发生率。当舒芬太尼与地佐辛复合应用时,可增强镇痛效果并对免疫功能发挥一定的保护作用,但同时也增加了头晕、恶心、呕吐、过度镇静、呼吸抑制等镇痛不良反应的发生风险,严重时可造成PCIA的不耐受甚至需要应用拮抗剂进行辅助治疗[19]。本研究采用TPVB联合PCIA的方式可减少镇痛等不良反应,可能是由于TPVB中罗哌卡因局部镇痛的应用减少了PCIA中舒芬太尼和地佐辛的静脉给药量。此外,近年来研究[20]通过复合药物TPVB、以自控椎旁神经阻滞替代PCIA、在PCIA中复合右美托咪定等多种方式进一步优化胸腔镜NSCLC手术镇痛方案,均取得了一定的进展,为进一步的临床研究提供了有益的思路,持续推进胸腔镜NSCLC手术镇痛管理效果的发展以达到提升手术治疗效果、促进术后康复应是广大临床麻醉医师的共同努力的方向。
综上,相对单独采用PCIA,在胸腔镜NSCLC根治术中采用TPVB联合PCIA的方式,能够在术后早期达到更好的镇痛效果,缓解术后免疫功能损害,降低应激水平,减少PCIA的使用频率,达到减少镇痛不良反应的效果。
