复发型吉兰—巴雷综合征临床特征及其复发预测因子分析
2021-04-21陈雪婷郑惠文张琪刘洁张作慧刘永海
陈雪婷,郑惠文,张琪,刘洁,张作慧,刘永海
吉兰—巴雷综合征(Guillain-Barré syndrome,GBS)是一种自身免疫介导的主要累及脊神经根、周围神经和脑神经的急性周围神经病,是目前全球迟缓性瘫痪最常见的病因[1]。GBS多呈急性单相病程,恢复过程中症状可有短暂波动,极少复发,既往文献报道显示1.0%~7.7%的GBS患者会复发,其变异型Miller Fisher综合征的复发率更高,可达12%[2-4]。 复发型吉兰—巴雷综合征(recurrent Guillain-Barré syndrome,rGBS)与吉兰—巴雷综合征治疗相关波动和慢性吉兰—巴雷综合征急性发作均表现为反复发作的弛缓性瘫痪,临床上难以区分,但三者的治疗方式却有所不同,相比于rGBS, 吉兰—巴雷综合征治疗相关波动的患者往往需要更长疗程的静脉注射免疫球蛋白治疗,慢性吉兰—巴雷综合征急性发作的患者一般首选激素类药物治疗[5-6],因此早期做出正确的诊断对治疗有重要的指导意义。此外,随着rGBS复发次数的增加,疾病严重程度和残疾程度都有增加趋势[7],许多患者因延误治疗遗留明显后遗症,给社会和家庭带来沉重的负担。因此,归纳rGBS患者的临床特征及分析其复发的预测因子有重大的临床意义。既往文献报道显示[1],炎性因子在GBS发病过程中起着重要作用,其是否促进GBS复发尚无系统研究,现归纳rGBS患者的临床特征,分析外周血和脑脊液中炎性因子与GBS复发的相关性,为疾病的诊疗和早期干预提供参考,报道如下。
1 资料与方法
1.1 病例来源 选取2015年1月—2020年6月徐州医科大学附属医院神经内科收治GBS患者183例,其中rGBS患者11例(复发组),单相病程GBS患者172例(未复发组)。
1.2 病例选择标准 (1)纳入标准: 符合GBS诊治指南的诊断标准[7-8]。rGBS定义为[2-4]:①至少2次发作的肢体对称性弛缓性瘫痪伴腱反射减弱或消失,每一次发作均符合GBS的诊断标准;②每次发作到症状达峰时间<4周,且在恢复过程中Hughes评分改善>2分或基本恢复正常;③每次发作间隔至少2个月。(2)排除标准:①吉兰—巴雷综合征治疗相关波动和慢性吉兰—巴雷综合征急性发作;②患者有其他引起周围神经病的相关病史;③发病前使用神经节苷脂;④存在神经肌肉接头病变,神经前角病变或肌肉病变。
1.3 观测指标与方法
1.3.1 临床资料收集:包括患者性别、年龄等一般资料;详细记录患者的临床特征,包括前驱事件类型、潜伏期、达峰时间、临床症状和体征(运动症状、感觉症状、颅神经麻痹、自主神经功能障碍、呼吸困难、机械通气等)。
1.3.2 血液学指标检测:患者均于入院后第1~3天留取外周血约10 ml,采用上海希森美康医用电子有限公司5分类全自动血球仪及配套试剂(EDTA-K2)测定血常规(包括白细胞、中性粒细胞和淋巴细胞);采用ELISA法检测血清T细胞因子水平(包括白介素-8、白介素-12、白介素-13和肿瘤坏死因子-α),仪器为美国伯乐公司Model型酶标仪,试剂盒由美国RD公司提供。
1.3.3 脑脊液检查:患者均于发病7~10 d行腰椎穿刺术,留取脑脊液约5 ml,采用奥林巴斯BX-51型显微镜及图文分析系统完成脑脊液白细胞检测,使用瑞士罗氏诊断公司Cobas 8000分析仪,采用免疫散射比浊法测定脑脊液蛋白含量。
1.3.4 肌电图检查:所有患者均于发病第7~10 d行肌电图检查,患者平卧于检查床上,保持皮肤温度>32℃,采用丹麦Medtronic公司Keypoint肌电图仪进行电生理检测。记录其常规测定的4条运动神经和3条感觉神经的神经电生理指标:MNCV、DL、CMAP、SNCV、SNAP等,并参考Hadden等的相关研究定义分为5型:脱髓鞘型(AIDP)、轴索型(AMAN+AMSAN)、分型不明、无反应型、正常[9]。其中,脱髓鞘型主要表现为MNCV减慢、DL延长,严重时出现传导阻滞,CMAP波幅相对正常;轴索型主要表现为CMAP、SNAP波幅下降,DL、MNCV、SNCV相对正常。
1.3.5 疾病严重程度评估:参考Hughes评分[10]对患者进行评估,该评分根据患者运动情况进行相关功能评估,是目前公认的评价病情严重程度及残疾程度的量表;0分:健康状态;1分:症状轻微,可以跑步;2分:不能跑步,在平地上无需帮助可行走10 m以上;3分:在帮助下,平地上可行走10 m;4分:被动卧床或需要做轮椅;5分:呼吸肌无力,需要机械通气;6分:死亡。

2 结 果
2.1 GBS复发率 183例GBS患者中,rGBS患者11例(6.0 %),单相病程的GBS患者172例。 GBS患者183例中,20例因症状轻微、神经电生理特征不典型未被分型,最终被确诊为Miller-Fisher综合征 (MFS)13例,复发2例(15.4%);轴索型97例,复发2例(2.1%);脱髓鞘型53例,复发7例(13.2%)。
2.2 2组临床特点比较 与未复发组GBS患者比较,复发组患者首发年龄较低,症状达峰时间较短,肢体无力和自主神经功能障碍比例、疾病高峰期Hughes评分较低,脱髓鞘型比例较高,轴索型比例较低(P<0.05);而2组在性别、感觉障碍、颅神经麻痹、机械通气比例比较差异均无统计学意义(P>0.05),见表1。

表1 2组患者临床特点比较 [例
2.3 2组血清和脑脊液炎性标志物比较 与未复发组患者比较,复发组患者首次发病时外周血中性粒细胞/淋巴细胞比值(NLR)、血清白介素-8(IL-8)升高,淋巴细胞计数(LY)和IL-13降低(P<0.05);而2组在白细胞(WBC)、中性粒细胞计数(NE)、IL-12、肿瘤坏死因子-α(TNF-α)及脑脊液WBC、蛋白水平比较差异均无统计学意义(P>0.05),见表2。
2.4 rGBS危险因素分析 将单因素分析中差异有统计学意义的指标纳入多因素 Logistic 回归分析,由于肢体无力、自主神经功能障碍、达峰时间与Hughes评分存在多重共线性问题,只选择Hughes评分纳入回归方程。由于NLR与淋巴细胞计数存在多重共线性问题,所以二者只选择NLR纳入回归方程。结果显示,高NLR为GBS复发的独立危险因素,高IL-13为其保护因素,见表3。
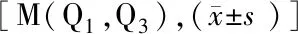
表2 2组外周血和脑脊液炎性标志物比较

表3 GBS复发的多因素 Logistic 回归分析
2.5 炎性标志物对rGBS的预测价值 ROC曲线结果显示,NLR预测GBS复发的截断值为4.09,对应的曲线下面积为0.705(95%CI0.587~0.821),敏感度为80.0%,特异度为62.7%;IL-13预测GBS复发的截断值为36.5 pg/ml,对应的曲线下面积为0.725(95%CI0.570~0.879),敏感度和特异度分别为72.4%和70.3%。NLR联合IL-13预测GBS复发对应的曲线下面积为0.818(95%CI0.684~0.942),敏感度为73.3%,特异度为82.5%,见表4、图1。
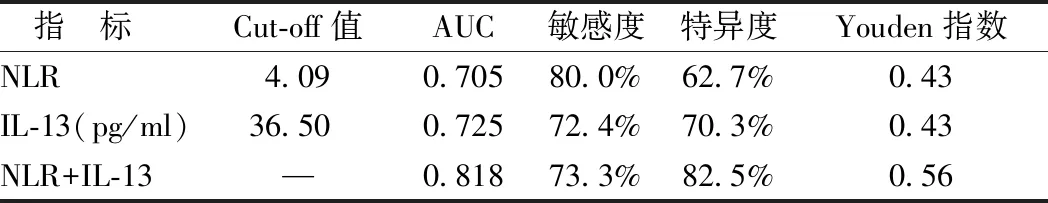
表4 NLR、IL-13及联合检测对GBS复发的预测价值

图1 NLR、IL-13及联合检测对GBS复发的预测价值ROC曲线
3 讨 论
GBS是一种体液免疫和细胞免疫共同介导的主要累及脊神经根、周围神经和脑神经的急性周围神经病,多为单项病程,极少复发,本研究中复发率为6.0%,与既往文献报道一致。其中脱髓鞘型和Miller-Fisher综合征的复发率相对较高,表明AIDP和MFS患者具有较高的复发易感性。脱髓鞘型复发率高可能与Fas受体功能缺陷有关,该受体由活化的T淋巴细胞表达,通过介导T淋巴细胞凋亡消除自身免疫性T细胞而抑制免疫应答[11]。Fas受体功能缺陷时T细胞调节障碍导致脱髓鞘的发生,而在轴索型GBS中,抗神经节苷酯抗体起主要作用[1,12]。Fas功能缺陷或T细胞调节过程中其他功能障碍有助于解释脱髓鞘型比轴索型更频繁地复发。而与Miller-Fisher综合征复发相关的促发因素尚不清楚,鲁立颖等[13]观察到HLA-DR2在复发型MFS患者血清中出现频率较高,提示HLA-DR2可能与复发型MFS有关。Ayas等[14]报道了1例8年内3次复发的MFS病例,该患者GQ1b抗体阳性,提示GQ1b抗体可能为MFS复发的危险因素。本研究受技术条件限制,未检测HLA-DR2和GQ1b抗体,二者是否与MFS的复发有关,尚需进一步基础实验证实。
通常认为GBS是由感染或其他免疫刺激引起的针对周围神经及脊神经根的异常免疫反应,微生物与神经抗原之间的分子模拟机制目前被认为是导致GBS发病的主要机制之一,随着空肠弯曲菌外膜上的脂寡糖与人体周围神经轴突的神经节苷脂存在着分子模拟的揭示[15-17],这一机制逐渐被接受。尽管许多个体暴露于GBS的致病因素(如空肠弯曲菌)下,但大多数个体都不会发生自身免疫反应而致病,提示GBS除与感染或其他免疫刺激诱发的免疫应答有关外,也可能与机体的免疫状态有关。若机体的免疫功能低下,免疫系统通常不足以清除致病因子,也不足以对神经系统产生严重影响。本研究中,复发组疾病严重程度较未复发组低,提示症状轻的GBS患者存在更高的复发倾向,也从侧面印证了机体免疫状态与GBS复发有关。
淋巴细胞是细胞免疫和体液免疫的关键参与者,对免疫系统起着至关重要的作用,淋巴细胞的丧失降低了机体的免疫功能,减少了致病因子的清除率,增加GBS复发几率[18],这与本研究复发组淋巴细胞低于未复发组的结论一致。但后续研究证明,外周血淋巴细胞计数虽然获得简单,但易受干扰,稳定性差,有时甚至得出相互矛盾的结论。NLR值则整合了特异性及非特异性免疫,是反映机体免疫炎性状态的综合性指标[19]。研究证实,GBS患者血清炎性标志物NLR明显升高,炎性反应贯穿于GBS发病和转归的所有阶段[20],但目前国内外尚无关于NLR预测GBS复发的相关报道,本研究创新性地将NLR纳入预测GBS复发的模型,发现GBS患者首次发病时NLR水平越高,复发风险越大,但鉴于本研究为单中心研究,所纳入病例有限,尚需扩大样本量进一步证实。
IL-13主要由活化的Th2细胞分泌,能抑制单核巨噬细胞产生多种趋化因子和致炎因子,从而具有抗炎作用[21]。GBS急性期IL-13水平迅速升高,可能与炎性因子大量释放,机体为拮抗炎性细胞浸润,IL-13反馈性表达有关。本研究发现,高水平IL-13可能为阻止GBS复发的保护性因子。分析原因可能是IL-13可减轻炎性反应损害、终止病理免疫反应,有利于周围神经髓鞘和轴索的修复。此外,本研究还发现,IL-8为GBS复发的危险因素,IL-8由单核细胞、T淋巴细胞释放,是对中性粒细胞有趋化作用的早期炎性因子[22]。Breville等[23]研究证明,在GBS急性期血清中可以检测到高水平的IL-8,但其在疾病的进展和转归中的作用,以及与GBS复发的相关性和参与复发的机制目前还未见报道,尚需进一步基础实验阐明。
目前国内外还没有关于预测GBS复发量表或模型的研究,本研究将NLR和IL-13相结合,预测GBS复发风险,具有较高的敏感度和特异度,当NLR>4.09或IL-13<36.5 pg/ml时,需考虑GBS复发的可能。鉴于临床检测NLR和IL-13简单、快速,有望成为rGBS潜在的生物标志物和干预靶点。
本研究尚存在一些不足,首先本研究只纳入近5年的病例,单相病程的GBS患者在今后几年仍有复发可能,对复发率的估计存在一些误差;其次,本研究为单中心研究,样本量较小,某些结论可能存在一定偏倚;因此,今后仍需扩大样本量和随访时间进一步补充和修正。
利益冲突:所有作者声明无利益冲突
作者贡献声明
陈雪婷:提出研究思路,设计研究方案,实施研究过程,分析临床数据,撰写论文,论文修改;郑惠文:搜集整理资料,查找参考文献;张琪:搜集整理资料;刘洁:数据统计处理;张作慧:审核论文;刘永海:修改总指导
