Fe2O3提高高浓造纸污水厌氧颗粒污泥产甲烷性能的机理研究
2021-04-20杨振虎吴开丽王凯晴侯庆喜
吴 明,杨振虎,吴开丽,江 闯,王凯晴,刘 苇,侯庆喜
(天津市制浆造纸重点实验室,天津科技大学轻工科学与工程学院,天津300457)
污水的厌氧生物处理可以有效地降低污染并回收能源。污水中可生物降解的有机物在多种厌氧微生物的协同作用下被分解成易于回收的甲烷、二氧化碳等稳定副产品,有利于降低污水的处理成本。废纸造纸污水中钙离子浓度为1250~2000 mg/L[1],在厌氧反应器长期运行过程中,污水中的钙离子容易形成碳酸钙或碳磷灰石等物质沉积到污泥表面或在污泥内部形成硬核,造成污泥的钙化。在钙化的过程中,无机成分积累造成污泥灰分升高,污泥中微生物含量的比例降低,产甲烷的能力大大降低,工厂需要定期更换反应器中的污泥,这就提高了运行成本,并且对污水处理效果造成严重影响;此外,如果颗粒污泥完全钙化,甚至会导致整个厌氧系统无法正常运行,重新恢复系统需花费数月时间,这已成为高钙污水厌氧处理过程中的顽疾。
胞外聚合物(extracellular polymeric substance,EPS)在生物颗粒和生物膜中的空间分布对其微孔结构的稳定和微孔强度的维持起着至关重要的作用[2]。近年来,许多研究指出在厌氧反应器中添加铁的氧化物可以作用于EPS,加强互营菌与产甲烷菌之间的直接电子转移(direct interspecies electron transfer,DIET),促进了甲烷的生成[3-5],与H2/甲酸转移相比,DIET具有更高的电子传递效率和能源利用率。铁还原微生物可以利用有机物作为电子供体,Fe(III)作为电子受体,使得Fe(III)被还原为Fe(II),这就是异化铁还原过程[6]。异化铁还原发生在厌氧环境,在这一过程中有效地降解多种有机污染物,因此对厌氧颗粒污泥EPS存在潜在的影响。由于污泥EPS的组成非常复杂,含有蛋白质、多糖、核酸、脂质等[7],已有研究主要集中于导电矿物材料对厌氧体系的影响,对厌氧消化过程中EPS分泌变化的研究不多。因此,本研究旨在探讨添加Fe2O3对厌氧颗粒污泥EPS的影响及颗粒污泥中微生物群落的变化,揭示EPS在厌氧消化中的作用,为应用Fe2O3提高厌氧消化产甲烷能力,缓解颗粒污泥钙化问题提供理论基础。
1 实验
1.1 原料与试剂
厌氧颗粒污泥取自南宁某造纸厂,新鲜的污泥在4°C条件下储存。使用筛网选取粒径为0.3~0.6 mm的种泥备用。分析纯Fe2O3粉末过100目筛待用。
本研究所采用的模拟污水(pH 7.20±0.20)以葡萄糖(25.50 g/L)为底物,NH4Cl和KH2PO4为氮源和磷源,模拟污水按照COD∶N∶P的质量比为200∶5∶1进行配制。FeSO4·4H2O(0.032 g/L)、CaCl2(0.038 g/L)和MgSO4·7H2O(0.042 mg/L)作为微量元素添加到营养液中。此外,添加CaCl2(2000 mg/L)以模拟高浓造纸污水。
1.2 实验装置
实验在三个容积为250 mL的封闭的厌氧反应瓶中进行。每个厌氧反应瓶中加入50 mL厌氧颗粒污泥和150 mL模拟污水。其中两个厌氧反应瓶分别添加0.2 g和3 g的Fe2O3,对照组不添加Fe2O3。在厌氧反应开始前,对每个瓶子通入氮气15 min,以排除氧气,厌氧反应全过程在37°C±1°C的温度下持续30 d。实验过程中产生的生物气先通入饱和氢氧化钠水溶液,再用排水法测量其体积。在第0、7、14、21、28天对样品EPS进行分析。实验结束后对样品进行高通量测序,分析颗粒污泥中微生物的变化情况。
1.3 分析方法
1.3.1 EPS分析
采用激光粒度仪分析厌氧颗粒污泥的粒度。污泥中的总悬浮物(TSS)和可挥发性悬浮物(VSS)浓度参照《水和废水监测分析方法》(第4版)[8]的方法进行测定。
EPS采用NaOH-甲醛法提取[9]。EPS中多糖含量采用蒽酮硫酸法测定[10],腐殖质和蛋白质含量采用修正的洛瑞法测定[11]。利用三维荧光光谱仪(three-dimensional excitation emission matrix fluorescence,3-DEEM)对EPS进行分析,激发波长为220~500nm,步长5nm;发射波长为250~500nm,步长5nm。
1.3.2 厌氧颗粒污泥菌群结构分析
分别收集培养30 d后来自实验组和对照组反应器的5 mL污泥样品,进行高通量16SrRNA焦磷酸测序,分析其微生物群落。
2 结果与讨论
2.1 Fe2O3对厌氧颗粒污泥产甲烷能力对影响
通过记录1个厌氧反应周期(28 d)内反应器中的甲烷积累量来表征反应器内厌氧颗粒污泥的产甲烷活性。由图1可知,添加Fe2O3后增强了厌氧颗粒污泥的产甲烷能力。在模拟的高浓造纸污水中,添加了Fe2O3的实验组仍能保持较高的甲烷产量,并且随着Fe2O3添加量的增加,甲烷积累量也随之增加。
经过28 d的培养后,在Fe2O3添加量为15 g/L的实验组中甲烷积累量达到4.19 L,相比对照组提高了67.6%;在Fe2O3添加量为1 g/L的实验组中甲烷积累量达到2.89 L,相比对照组提高了15.8%。在厌氧反应进行的前12天,随着有机底物的快速消耗,三组反应器中的甲烷积累量快速升高,尤其是添加Fe2O3的实验组,这说明Fe2O3可能通过提高污泥水解酸化效率,促进厌氧反应的进行。此外,厌氧反应前期对照组的甲烷积累量高于实验组(图1),这可能是由于Fe2O3的添加改变了厌氧微生物的生存环境,微生物需要一定时间去适应所导致的。
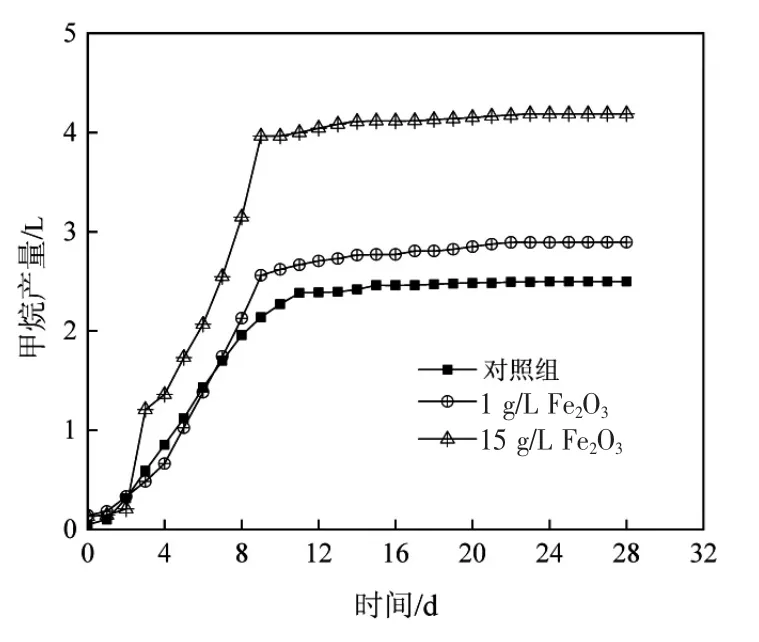
图1 在模拟高浓造纸污水中添加Fe2O3对甲烷产量的影响
2.2 Fe2O3对厌氧颗粒污泥微环境的影响
EPS为微生物的结合提供了广阔的物质交换场所,黏附在胞外多糖中的絮凝体可以为一些有机物和无机物提供吸引位点,帮助其进行物质交换,如传递细胞外蛋白质等[12]。EPS不但帮助形成微生物聚集体,使其共同作用抵御外界环境变化和有毒物质对细胞的危害,而且可将环境中的大分子营养成分富集,再通过胞外酶降解成小分子后吸收到细胞内,也方便微生物种间电子的传递。
图2表明,Fe2O3促进了厌氧颗粒污泥分泌EPS。由图2(a)可知:在培养前期,EPS总量随培养时间增长呈增长趋势,之后随着培养时间的增长,EPS含量逐渐下降。相比对照组,添加Fe2O3后EPS中的多糖、蛋白质和腐殖质含量均明显提高。当厌氧反应进行到第7天时,Fe2O3添加量为1 g/L和15 g/L的实验组中EPS总量比对照组分别提高16.56%和45.97%。
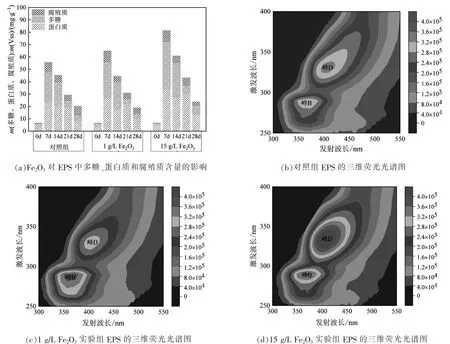
图2 Fe2O3对EPS中多糖、蛋白质和腐殖质含量的影响及不同实验组EPS的三维荧光光谱图
随着厌氧消化的进行,EPS浓度逐渐降低。这是因为EPS的主要成分(蛋白质和多糖)可以被生物降解,成为细胞生长的碳源,在营养缺乏的情况下被消耗以维持细胞生长[13];随着厌氧反应的进行,厌氧颗粒污泥的降解能力得到了极大的提高,培养液中营养缺乏造成了EPS组分中多糖和蛋白质降解。
根据文献[14],以激发波长 (λEx)和发射波长(λEm)为界将三维荧光光谱的激发-发射矩阵划分为5个区域:区域I,λEx/λEm=200~250 nm/280~330 nm;区域II,λEx/λEm=200~250 nm/330~380 nm;区域III,λEx/λEm=200~250 nm/380~550 nm; 区 域IV,λEx/λEm=250~450 nm/280~380 nm;区域V,λEx/λEm=250~450 nm/380~550 nm。
EPS的荧光光谱图如图2(b)—图2(d)所示。厌氧反应进行至第28天时,各反应器中厌氧颗粒污泥EPS的荧光光谱峰值主要出现在峰B和峰D,分别为可溶性微生物副产物[15]荧光峰和类胡敏酸类[16-18]荧光峰。
与对照组相比,实验组中峰B的出峰位置没有明显变化,出峰位置均在λEx/λEm=290 nm/370 nm。但与对照组相比,实验组中类胡敏酸类荧光峰(峰D)均发生红移,峰值位置均在λEx/λEm=330 nm/410 nm。据文献[19]可知,荧光峰(峰D)的红移可能是由于添加Fe2O3改变了厌氧颗粒污泥EPS中蛋白质的组成成分及含量,造成EPS中羰基、羟基、烷氧基、氨基和羧基等官能团的出现或增加。添加Fe2O3改变了实验组反应器中微生物的群落结构,从而导致EPS中蛋白质组分发生改变。综上,随着厌氧反应的进行,微生物不断生长代谢,添加Fe2O3使厌氧颗粒污泥分泌的EPS中蛋白质组分出现不同的变化,从而提高了厌氧消化产甲烷能力。
2.3 Fe2O3对微生物群落的影响
2.3.1 Alpha多样性分析
Alpha多样性是一类综合指标,反映一个特定区域或生态系统内物种的丰富度和均匀度[20-22]。细菌Alpha多样性分析结果如图3所示。
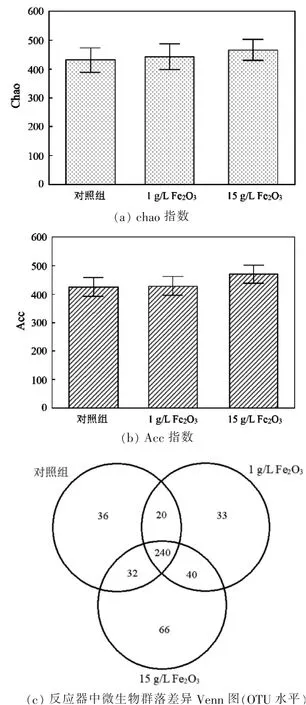
图3 细菌Alpha多样性分析
三组实验的Ace指数及Chao指数差异明显(见图3(a)、图3(b)),结合图3(c)的Venn图分析可知,在不改变环境条件的情况下,添加Fe2O3的反应器中微生物多样性明显高于对照组。在OTU分类水平上,添加1 g/L Fe2O3和15 g/L Fe2O3实验组的物种总数分别为333和378,相比对照组的物种总数328分别上升了1.5%和15.2%。因此,添加Fe2O3可以提高厌氧反应器中的微生物物种多样性。结合前人的研究[23]可以得出,添加Fe2O3后微生物物种多样性的增加可能是使厌氧消化系统产甲烷活性明显提高的主要原因。
2.3.2 微生物群落结构分析
为了进一步解微生物群落结构对厌氧反应活性的影响,分别对古菌和细菌在门水平和属水平上的微生物群落结构进行了分析,结果见表1—表4,表中相对丰度小于1%的古菌和细菌群落均被列入其他(门或属)。
根据表1对古菌的门水平的群落分析结果可知,在反应器中添加Fe2O3并未改变古菌群落的主要结构组成。在经历28 d培养后,三组反应器中的优势菌均属于Euryarchaeota(广古菌门),分别占对照组、1 g/L Fe2O3和15 g/L Fe2O3实验组古菌的56.60%、67.94%和68.61%;Crenarchaeota(泉古菌门)在三组中占比分别为43.02%、31.69%和31.19%。已有研究表明[24-26],Crenarchaeota可利用的碳源多为碳酸氢盐或CO2。
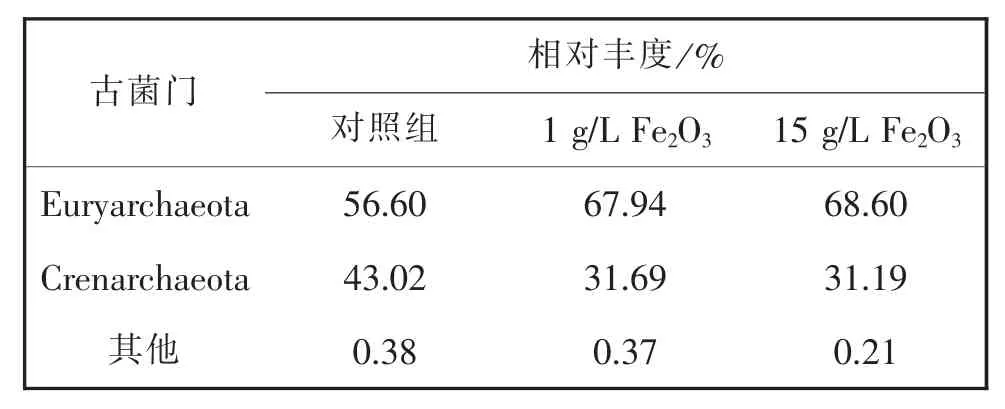
表1 古菌群落组成(门水平)
由表2对古菌的属水平的群落分析结果可知,添加Fe2O3的实验组中细菌群落以氢营养型产甲烷古菌为主,实验组的优势菌为Methanobacterium、norank_c_Bathyarchaeia、Methanomassiliicoccus。其中,Methanobacterium分别占对照组、1 g/LFe2O3和15 g/L Fe2O3实验组古菌群落的34.04%、37.22%和36.69%;norank_c_Bathyarchaeia分别占各组中古菌群落的42.92%、31.64%和31.16%;Methanomassiliicoccus分别占各组中古菌群落的9.54%、9.84%和13.12%。Fe2O3的加入引入了大量Fe(III),异化铁还原过程促进了复杂的有机物降解释放大量氢气,这也导致了氢营养型产甲烷古菌占据优势。在添加1 g/L和15 g/L Fe2O3的反应器中Methanosaeta占比分别提高了58.2%和90.0%,这可能是随着水解酸化的进行,乙酸不断积累导致,Methanosaeta可以与地杆菌属产生直接的电子传递,加速了甲烷的产生。同时,Methanolinea作为一种利用H2/CO2为营养源的产甲烷古菌[27]在添加了Fe2O3的两个实验组中占比上升,均比对照组提高了75.2%。综上可知,氢营养型产甲烷古菌(如Methanolinea、Methanobacterium、Methanosaeta等)在古菌群落中取得优势地位可能是造成实验组产甲烷效率显著高于对照组的原因之一。
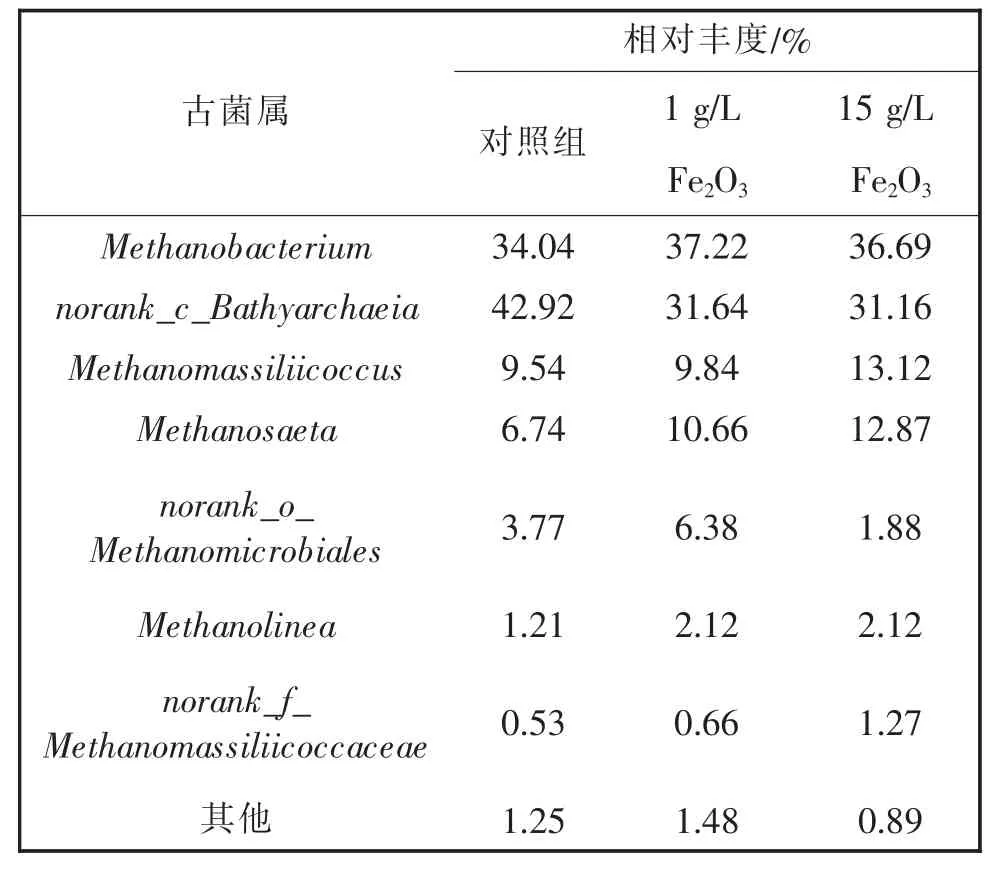
表2 古菌群落组成(属水平)
结合细菌与古菌之间的互营代谢理论来分析细菌群落结构可能会为解析Fe2O3提高厌氧发酵产甲烷能力提供一种新的思路。如表3所示,在添加Fe2O3的实验组中,细菌主要微生物群落在门水平上的变化非常明显,Firmicutes(厚壁菌门)占优。有研究表明[28],Firmicutes占比与VFA(挥发性脂肪酸)含量呈负相关,与CH4产量呈正相关,对照组厌氧消化效率低,甲烷产量少,可能造成VFA的积累,因此Firmicutes的相对丰度占总体微生物丰度的85.33%,高于实验组。此外,Firmicutes、Chloroflexi(緑弯菌门)和Actinobacteria(放线菌门)都已经被证明可以在污水中形成生物膜结构,并且生成大量的EPS[29],因此,添加Fe2O3的实验组中EPS含量远高于对照组。
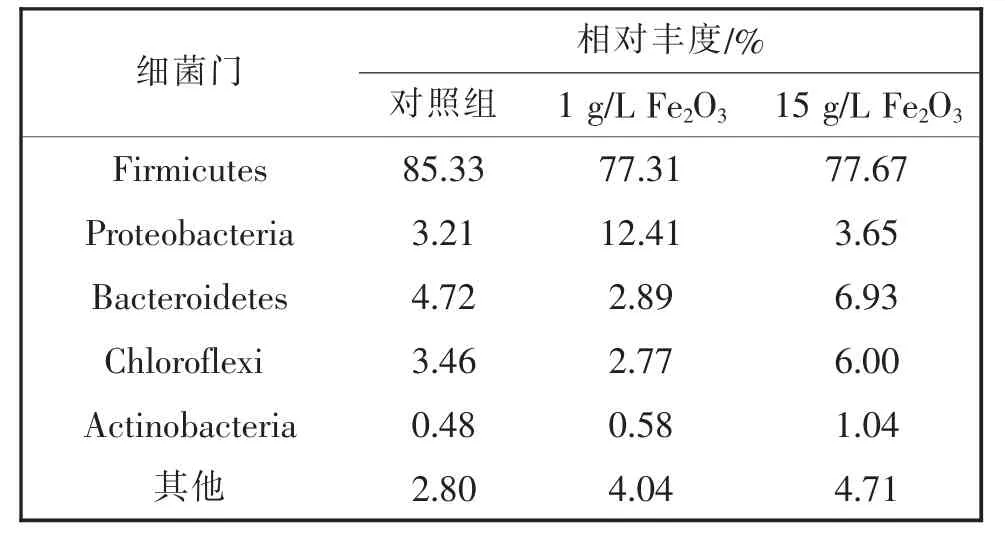
表3 细菌群落组成(门水平)
如表4所示,在属水平下,三组反应器中物种组成差异较大,但属于Syntrophobacter(互营杆菌属)的细菌占比增加,互营菌可能与产甲烷古菌形成互营共聚体,参与产酸菌与产甲烷古菌之间的种间氢转移[30],受氢分压的调控,也在转移代谢产物方面发挥着中要作用。在互营共聚体的参与下,氢转移速度提高在一定程度上加快了产甲烷速率,由此,添加Fe2O3的实验组中Syntrophobacter占比的增加很可能提高了厌氧发酵产甲烷能力。此外,Tepidimicrobium出现,作为一种发酵型铁还原菌,能以Fe(III)为电子受体,参与异化铁还原过程;Clostridia纲出现(包括unclassified_o_Clostridiales、Tepidimicrobium等),主要通过改善VFA的降解并促进甲烷生成来维持厌氧消化的稳定。
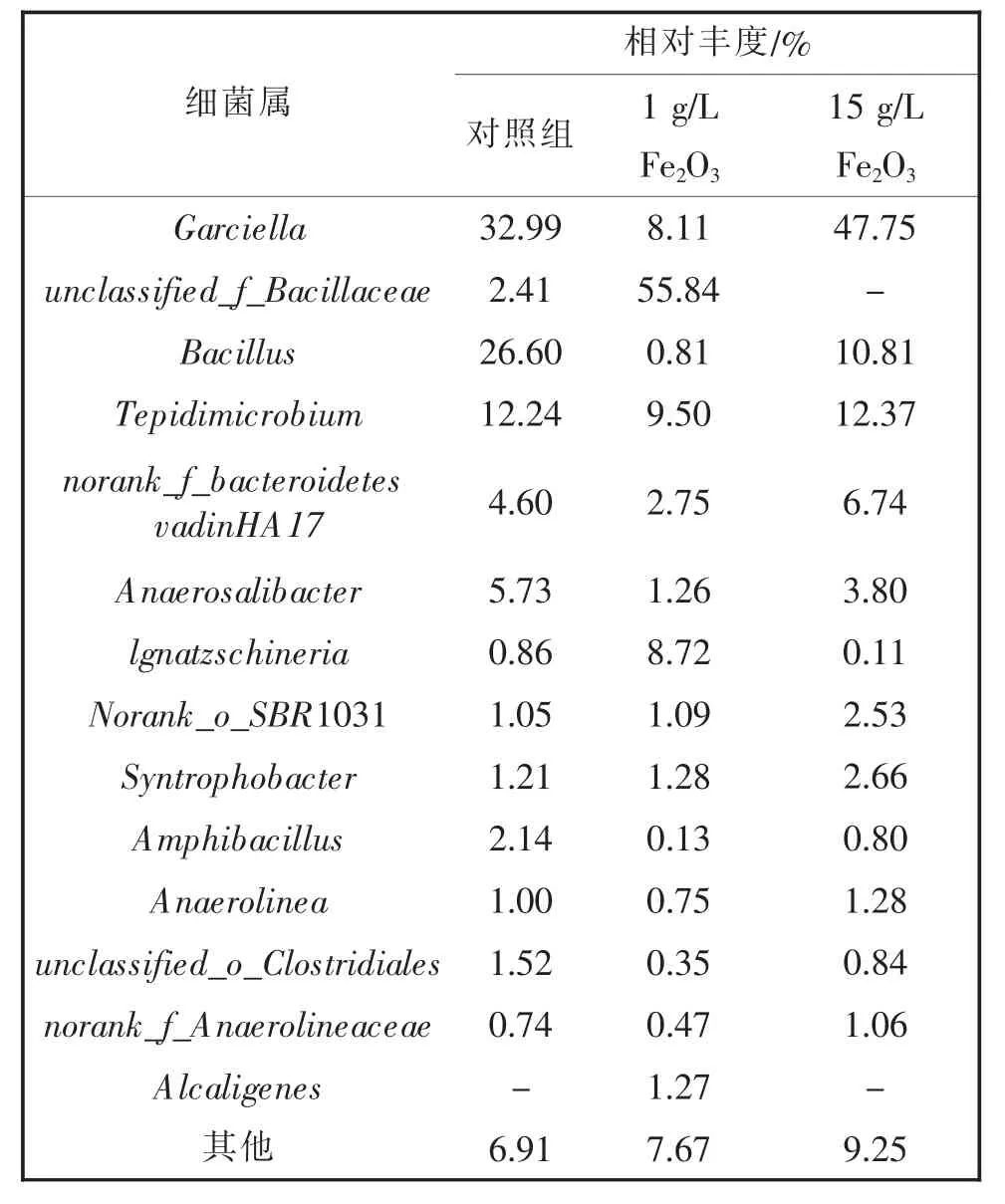
表4 细菌群落组成(属水平)
综上,由互营菌与产甲烷古菌形成的互营共聚体参与并调控了种间氢转移。在添加了Fe2O3的反应器中,互营菌属占比增加可能是提高产甲烷古菌产甲烷效率的主要原因,而EPS中各组分浓度的提高主要由Firmicutes、Chloroflexi、Actinobacteria等调控。结合甲烷产量、EPS组分及含量的分析结果,在高浓造纸污水环境下添加Fe2O3可以有效促进微生物厌氧产甲烷效果。
3 结论
本研究提出了一种通过添加Fe2O3有效提高厌氧颗粒污泥产甲烷能力的方法,并通过实验考察了添加Fe2O3对厌氧颗粒污泥胞外聚合物分泌的影响及颗粒污泥中微生物群落的变化。结果表明:与对照组相比,添加Fe2O3可使甲烷产量提高67.6%。此外,Fe2O3还具有刺激微生物分泌EPS的作用,添加Fe2O3使得细菌群落分布更均匀,厌氧消化系统能够维持稳定的状态;同时,富集了Fe(III)还原菌(如Tepidimicrobium等),微生物异化铁还原作用促进了有机污染物降解;还加强了互营菌与产甲烷菌之间的直接电子转移,提高了电子传递效率,从而加速了厌氧反应进程。以上结论充实了Fe(III)促进厌氧反应产甲烷能力的作用机制,并为解决造纸高浓有机污水难处理的问题提供了一种新思路。
