二甲双胍对非酒精性脂肪性肝病细胞模型内质网应激与自噬的影响
2021-04-20吴晓曼张敏田甜李明廖星晨谭诗云
吴晓曼,张敏,田甜,李明,廖星晨,谭诗云
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是全世界慢性肝病的最常见原因,据估计,世界上有24%的人口患有NAFLD,到2030年,美国将有大约1亿人患有NAFLD[1]。NAFLD的阶段范围从单纯性脂肪变性到非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH),进一步可能发展为肝硬化,导致肝功能衰竭需要肝移植,甚至最终发展为肝细胞癌[2]。NAFLD近年来大多共识为一种代谢性疾病,其发病机制多与脂肪代谢有关,肝细胞三酰甘油(TG)积累是NAFLD的标志,在肝细胞中由于过多的脂质蓄积可引发内质网应激(endoplasmic reticulum stress,ERS)与自噬的变化[3-4]。在NAFLD发病机制的研究中发现,代谢因素(如胰岛素抵抗、糖毒性和脂毒性等)、遗传因素和其他因素促成NAFLD与2型糖尿病(T2DM)的发病呈现相关性,患者存在T2DM增加了NAFLD进一步发展的风险[5]。而二甲双胍作为一种双胍类降糖药物,已被用于治疗2型糖尿病超过60年[6-7]。在近期的研究中[8],发现二甲双胍可抑制高脂饮食(HFD)诱导的肝脂肪变性。本研究利用游离脂肪酸(FFA)建造NAFLD细胞模型并用二甲双胍进行干预,进一步研讨ERS与自噬的调控机制,报道如下。
1 材料与方法
1.1 材料 (1)细胞株:人肝癌细胞株HepG2由中国科学院干细胞库提供。(2)试剂试药:二甲双胍购于美国MCE(HY-17471A),Gibco DMEM/H培养液购自美国赛默飞世尔公司,胎牛血清(FBS)购自杭州四季青公司。棕榈酸(palmitic acid, PA)(P0500)、油酸(oleic acid, OA)(O1383)购自美国Sigma公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)、胰酶细胞消化液购自biosharp公司,无脂肪酸牛血清白蛋白(bovine serum albumin, BSA)购自上海翊圣公司。兔抗RNA依赖的蛋白激酶样ER激酶 (RNA-dependent protein kinase-like ER eukaryotic initiation factor-2α kinase, PERK)抗体、兔抗激活作用转录因子4(activating transcription factor 4, ATF4)抗体、兔抗微管相关蛋白1 轻链3(microtubule-associated protein 1 light 3,LC3)抗体均购自美国Cell Signaling Technology公司,兔抗P62抗体、鼠抗GAPDH抗体购自美国proteintech公司,兔抗磷酸化PERK抗体购自北京博奥森公司,辣根过氧化物酶标记山羊抗兔IgG(ZB-2301)购自北京中杉金桥公司,辣根过氧化物酶标记山羊抗鼠IgG(BS12478)购自美国bioworld公司。(3)仪器设备:THERMOHeracellVIOS 160i/250i CO2培养箱(德国Thermo Scientific公司),Bio-Rad imark 全自动酶标仪、Bio-Rad凝胶成像系统ChemiDocTMXRS+、OLYMPUS IX71显微镜、垂直层流洁净工作台(青岛海尔公司),XB70-FZ制冰机(GRANT公司),XSR205微量称重台(METTLER TOLEDO公司)。
1.2 实验方法 2020年7—11月于武汉大学人民医院消化系统疾病湖北省重点实验室进行实验。
1.2.1 FFA配置:以配置FFA 6 ml(OA︰PA=2︰1)为例,先称量无脂肪酸BSA 1.2 g加入PBS 2.5 ml高速离心助溶后配至3 ml,配置成40%无脂BSA淡黄色澄清溶液。取NaOH 0.04 g,溶解于去离子水10 ml中,配成0.1 mol/L NaOH溶液10 ml,取NaOH溶液3 ml依次加入PA 10.24 mg、OA 25.38 μl配置40 mmol/L FFA,置于75℃水浴进行充分皂化约30 min得到澄清液体。将其与BSA 3 ml迅速混合,可在50 ℃以下助溶,得到20 mmol/L FFA溶液6 ml为母液,4 ℃保存。
1.2.2 HepG2细胞培养:将冻存的HepG2细胞置于37 ℃恒温水浴中约1 min内迅速解冻,离心5 min后去除冻存液,用含10%胎牛血清、1%青链霉素的DMEM完全培养基重悬之后移至25 cm2的培养瓶中,置于37℃、5%CO2、饱和湿度的培养箱中培养,隔天换液,每天观察细胞生长情况,3~4 d传代1次。传代操作如下:弃去培养基,PBS 3~4 ml清洗2次,加入胰酶1~2 ml,置于培养箱中消化1~2 min,倒置显微镜下观察,若细胞大部分变圆分散,则在培养瓶中加入与胰酶等量含10%胎牛血清的DMEM完全培养基终止消化,收集细胞后离心弃上清,以1∶3比例传代,取处于对数生长期的细胞进行实验。
1.2.3 NAFLD细胞造模及分组:取合适数量的对数生长期HepG2细胞接种于孔板中,分为4组:对照组(BSA组)、模型组(FFA组)、二甲双胍低浓度组(Met L组)、二甲双胍高浓度组(Met H组)。隔夜观察细胞生长状态良好,进行药物干预。二甲双胍先用去离子水配置500 mmol/L 母液,-20 ℃保存。Met L组和Met H组分别采用二甲双胍1、10 mmol/L终浓度进行预处理1 h,然后FFA、Met L、Met H组分别加入等量FFA进行干预,使FFA作用浓度为1 mmol/L,BSA组加入与FFA等量的BSA,作用24 h后结束NAFLD细胞造模及药物处理进行其他检测。
1.3 观察指标与方法
1.3.1 CCK8法检测细胞活性:收集对数生长期的HepG2细胞,以5 000/孔的密度接种于96孔板中,每孔含 10%FBS的DMEM培养基100 μl,在细胞培养箱中孵育24 h后,用PBS清洗1遍加入新的培养基100 μl,并分别以0、10、20、40、80 mmol/L浓度的Met处理细胞,空白对照组加入等体积的DMEM完全培养基,放回孵育箱中继续培养24 h。弃去原培养基,每孔加入100 μl无血清DMEM培养基和 CCK-8试剂10 μl,于37℃恒温箱中避光孵育1.5 h,酶标仪测定450 nm处的吸光度(OD)值,根据公式计算细胞活力。细胞活力=[(干预组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。
1.3.2 Western-blot法检测蛋白表达:取对数生长期细胞接种于6孔板中,每孔加入DMEM 2 ml完全培养基37℃恒温箱中培养。细胞分组加入药物干预24 h后, PBS洗涤3遍。按照RIPA∶磷酸酶抑制剂∶PMSF=100∶2∶1配置裂解液,每孔加入配置好的裂解液100 μl,冰上裂解10 min,用细胞刮刀收集细胞进行超声裂解,然后于4℃离心取上清加入loading buffer,100℃煮沸10 min。BCA蛋白浓度试剂盒测定蛋白浓度,根据测得浓度调整上样量。将蛋白样品加入十二烷基硫酸钠—聚丙烯酰胺凝胶电泳,后经电泳、转膜,将转膜结束后的PVDF膜取出,转入含5%脱脂奶粉的TBST中封闭60 min。分别孵一抗,稀释比1∶1 000,4℃过夜,回收一抗,加入TBST洗涤5次,每次10 min,二抗稀释比1∶2 500,室温孵育1 h,用TBST洗膜3次,每次10 min。用ECL 化学发光液浸润1 min,于凝胶成像系统中扫描成像。
1.3.3 qRT-PCR实验检测ATF4基因表达水平:细胞接种及分组同上,培养24 h后,收集细胞提取总RNA,计算出RNA浓度,按试剂盒操作说明合成cDNA,并进行聚合酶链反应(PCR)检测ATF4表达水平,以GAPDH为内参。qRT-PCR实验条件为95 ℃ 3 min预变性,95 ℃ 10 s、58 ℃ 30 s、72 ℃ 30 s重复40个循环。ATF4正向引物为5'-GTCCTGTCCTCCACTCCAGATC-3',反向引物为5'-TGGGCTCATACAGATGCCACT-3';GAPDH正向引物为5'-CATCATCCCTGCCTCTACTGG-3',反向引物为5'-GTGGGTGTCGCTGTTGAAGTC-3'。目的基因扩增用ΔΔCT法计算,A=CT(目的基因, 实验样本)-CT(内标基因, 实验样本),B=CT(目的基因, 对照样本)-CT(内标基因, 对照样本),K=A-B,表达倍数=2-K。

2 结 果
2.1 二甲双胍对HepG2细胞活力的影响 采用不同浓度(0、10、20、40、80 mmol/L)二甲双胍干预HepG2细胞24 h后,检测细胞活力,结果显示,相同时间范围内,不同浓度的二甲双胍对HepG2细胞活力的抑制随剂量升高而增强,差异均有统计学意义(F/P=1 759.000/0.000),见图1。
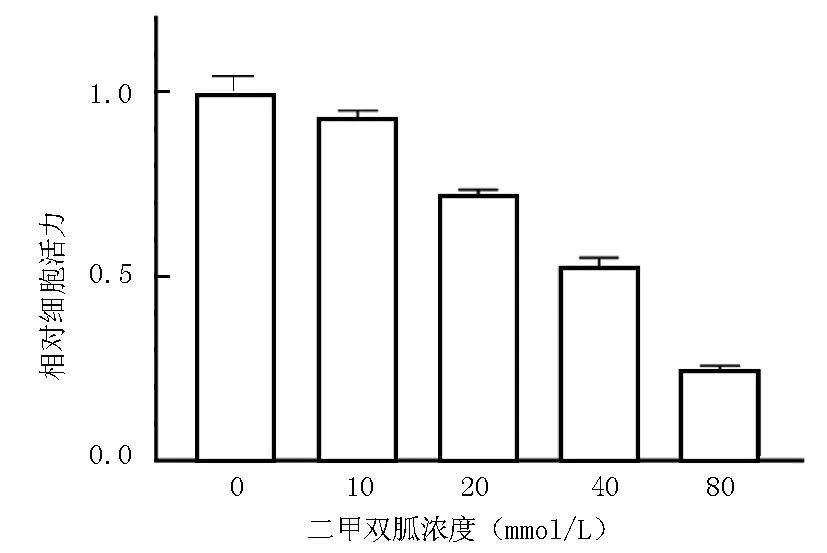
图1 不同浓度的二甲双胍对HepG2细胞活力的影响
2.2 各组HepG2细胞ERS相关蛋白表达比较 Western-blot结果显示,与BSA组比较,FFA组PERK磷酸化程度明显升高 (t/P=3.273/0.029);与FFA组比较, Met L组和Met H组PERK磷酸化程度降低 (F/P=70.310/0.000);与Met L组比较,Met H组PERK磷酸化程度降低更明显(t/P=6.402/0.000),见图2。
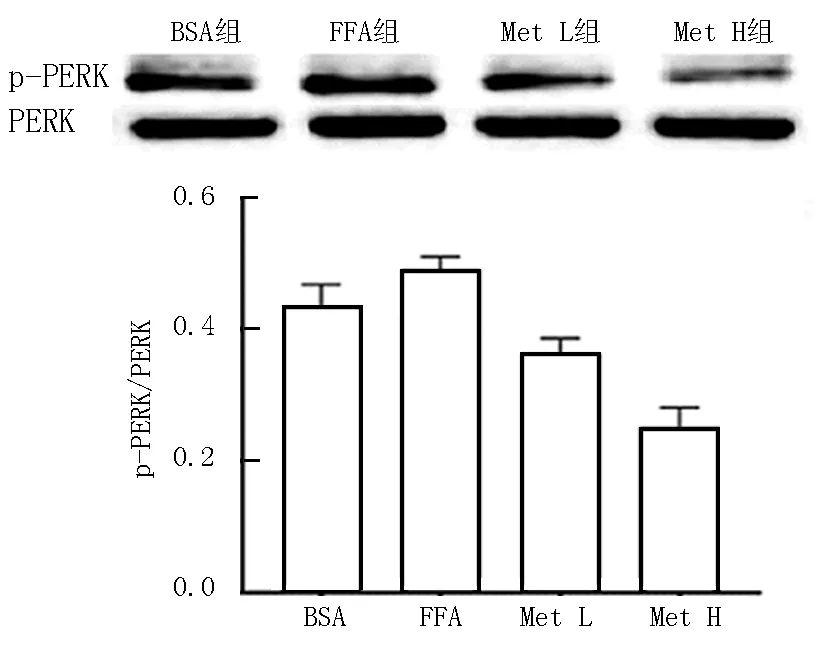
图2 各组PERK磷酸化程度比较
Western-blot结果显示,与BSA组比较,FFA组ATF4蛋白表达水平明显升高 (t/P=47.290/0.000);与FFA组比较,Met L组和Met H组ATF4表达水平降低 (F/P=995.600/0.000);与Met L组比较,Met H组ATF4表达水平降低更明显(t/P=25.590/0.000),见图3。

图3 各组ATF4蛋白表达比较
2.3 各组HepG2细胞ATF4 mRNA表达比较 通过qRT-PCR检测,与BSA组比较,FFA组ATF4 mRNA水平明显增高 (t/P=13.730/0.000);与FFA组比较,Met L组和Met H组ATF4 mRNA表达水平均降低(F/P=66.960/0.000);与Met L组比较,Met H组ATF4 mRNA表达水平降低(t/P=3.511/0.048),见图4。
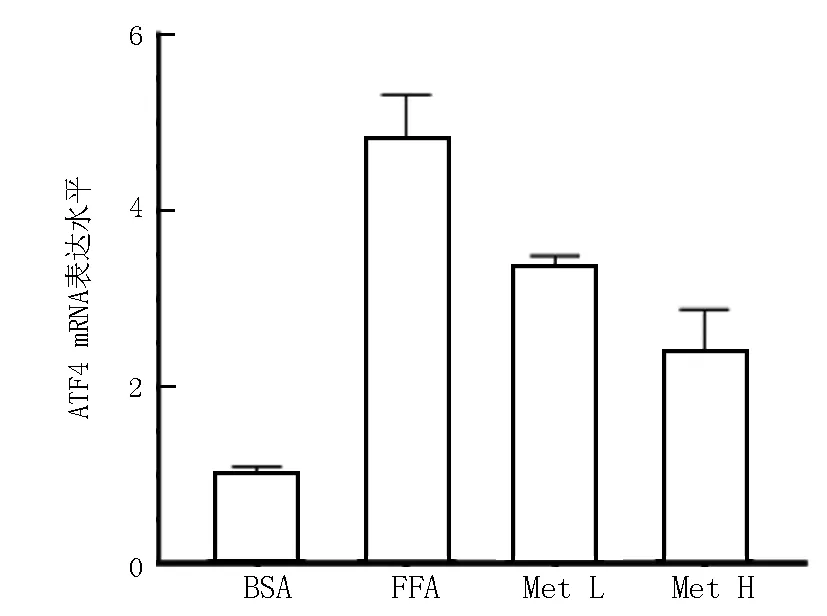
图4 各组HepG2细胞ATF4 mRNA表达比较
2.4 各组HepG2细胞内自噬水平比较 通过Western-blot法检测各组细胞中自噬相关蛋白p62和LC3-Ⅱ/Ⅰ的表达情况,与BSA组比较,FFA组p62蛋白表达升高(t/P=16.190/0.000),LC3-Ⅱ/Ⅰ表达降低(t/P=17.980/0.000),差异有统计学意义(P<0.05);与FFA组比较, Met L组和Met H组细胞p62蛋白显著降低(F/P=106.700/0.000),而细胞内LC3-Ⅱ/Ⅰ蛋白比例显著升高(F/P=166.400/0.000)。且与Met L组比较,Met H组LC3-Ⅱ/Ⅰ蛋白比例升高(t/P=3.474/0.028),见图5。

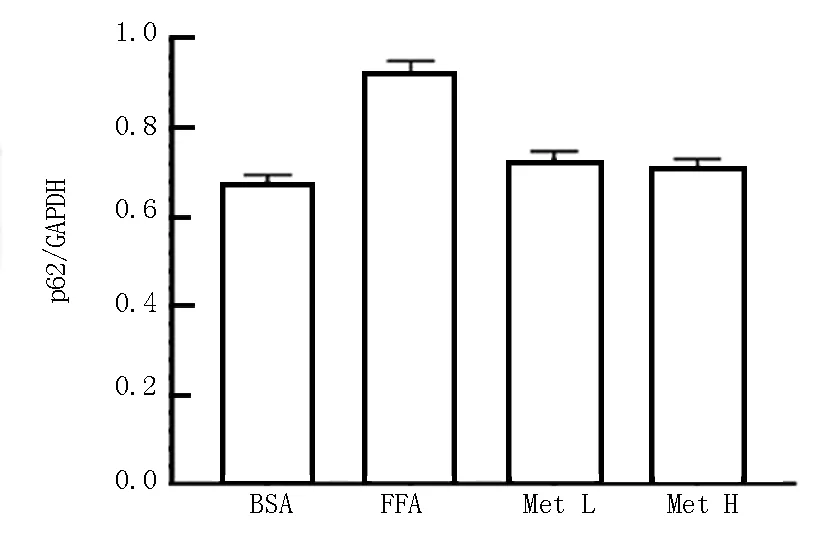

图5 二甲双胍对HepG2细胞内自噬水平的影响
3 讨 论
二甲双胍属于双胍类药物,是目前临床首选降糖药,主要通过减少肝脏葡萄糖的输出和改善外周胰岛素抵抗而降低血糖[9]。有研究表明[10],二甲双胍在高脂饮食诱导的小鼠中可明显降低凋亡水平,说明二甲双胍具有治疗非酒精性脂肪性肝病的潜力。为进一步探讨二甲双胍作用于非酒精性脂肪性肝病的体外作用机制, 应用CCK8法检测二甲双胍对人肝癌细胞HepG2细胞活力的影响。本结果筛选出对细胞影响最小的浓度范围,选择1、10 mmol/L的二甲双胍进行后续实验,结果显示,二甲双胍可剂量依赖性地降低HepG2细胞活力,与Guo等[11]研究结果一致。
研究表明,FFA可引起肝细胞内脂质蓄积,ERS水平升高[12-14]。ERS是指由于细胞受到外界刺激或自身某些变化因素导致内质网稳态失衡,进而未折叠或错误折叠的蛋白质累积在内质网内对细胞产生毒性,引发内质网发生非折叠蛋白质应答(unfolded protein response,UPR),进而消除和避免未折叠蛋白质的进一步积累,从而维持细胞稳态。ERS有3条经典的信号通路:PERK、IRE1α和ATF6,当ERS被激活时,这3种蛋白分别活化并进一步激活下游的信号分子传递信号[15-16]。其中PERK通路被证实参与NAFLD的发生发展机制[17],在本实验中,进一步证实其下游信号分子ATF4参与FFA建造的NAFLD细胞模型的疾病发展机制。PERK通过自身磷酸化被激活,进一步磷酸化eIF2α,然后ATF4水平上升进而调节细胞代谢。自噬存在3种不同类型,分别为巨自噬、微自噬及分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)。广义自噬多指巨自噬,指在细胞内形成包裹部分细胞老化细胞器或碎片的双膜囊泡,即自噬体,自噬体与溶酶体结合使其包裹内物质降解,是细胞自我消化的一种方式[18-19]。Song等[20]研究表明,ERS下游PERK信号通路参与诱导自噬,但本研究中FFA组诱导ERS PERK信号通路激活且下游ATF4同样被激活,与BSA组比较,LC3-Ⅱ/Ⅰ比值降低,自噬水平降低。LC3有LC3Ⅰ和LC3Ⅱ 2种分子形式,发生自噬时,溶质形式的LC3Ⅰ与磷脂酰乙醇胺缀合形成LC3Ⅱ,随后被募集到自噬体膜中,是自噬的特异性标志[21]。最近的研究表明[22],高脂饮食喂养建造的NAFLD小鼠模型中,自噬水平降低,在体外实验中也证明棕榈酸干预会使自噬通量受阻,与本研究结果一致。ERS与自噬之间的相互作用在不同的疾病或模型中有所不同,在NAFLD模型中,多出现ERS水平上升及自噬受阻。
本研究也进一步证实了二甲双胍在NAFLD模型中对ERS的影响,这与Chen等[23]研究一致,二甲双胍可降低癫痫持续状态(status epilepticus, SE)诱导的ERS水平,通过PERK-eIF2α-C/EBP同源蛋白(C/EBP-homologous protein, CHOP/GADD153)信号通路可直接减少SE模型中的凋亡水平。在NAFLD模型中二甲双胍也可影响ERS PERK信号通路,且在本实验中进一步说明其下游分子ATF4也受二甲双胍调控。无论在何种细胞内,二甲双胍均可激活腺苷酸活化蛋白激酶,AMPK作为一种已知的细胞代谢传感器,参与细胞内多种信号传导通路调节[24]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是自噬调节的重要信号分子,而AMPK的激活可抑制mTOR[25]。Hu等[24]研究表明,二甲双胍可调控mTOR信号通路,而mTOR信号通路也可进一步负调控自噬。本实验证实,二甲双胍组可明显增加因FFA降低的LC3-Ⅱ/Ⅰ比值,且自噬相关蛋白p62水平明显降低,说明二甲双胍可恢复因FFA脂毒性降低的自噬水平,可能有助于进一步减少细胞内脂质蓄积。
综上所述,二甲双胍可有效保护肝细胞免受FFA的脂毒性,缓解其ERS并增强自噬水平,对NAFLD有潜在的治疗作用。
利益冲突:所有作者声明无利益冲突
作者贡献声明
吴晓曼、张敏:设计研究方案,实施研究过程,论文撰写;田甜、李明:分析试验数据,论文审核;廖星晨:资料搜集整理;谭诗云:课题设计,论文终审
