基于升阶梯治疗原则分析重症急性胰腺炎患者行开腹坏死物清除术的危险因素
2021-04-19段玉灵冯赞杰范国鑫刘康伟彭慈军
段玉灵, 冯赞杰, 范国鑫, 王 磊, 刘康伟, 彭慈军
1 遵义医科大学附属医院 肝胆外科, 贵州 遵义 563000;2 遵义医科大学 生物化学与分子生物学教研室, 贵州 遵义 563000
重症急性胰腺炎(severe acute pancreatitis, SAP)是起病迅速,病情凶险,病死率高的常见临床急腹症[1]。对SAP患者胰腺周围的局部并发症进行及时诊断并采取恰当的外科干预手段是改善SAP患者临床预后的关键[2]。开放胰腺坏死组织清除术(open pancreatic necrosectomy, OPN)是对SAP患者局部并发症进行干预的经典手术治疗方式,然而患者术后仍然具有较高的病死率和并发症发生率[3-4],在过去的10年里,由首先经皮穿刺置管引流(percutaneous catheter drainage,PCD)干预胰腺及其周围的坏死物,在病情依旧不能得到控制时继续行OPN组成的升阶梯外科治疗方式(“step-up”治疗),逐步取代了直接OPN成为了较为公认的对SAP进行干预的外科治疗方式[5-6]。据研究报道基于“step-up”原则的治疗方式与直接行OPN相比具有更低的并发症发生率[5],且至少约有三分之一的患者在早期PCD干预后病情可以得到有效控制,不需要行额外的坏死物清除术[7]。在疾病早期及时筛选出倾向于外科清创的患者,适时调整导管引流的时间,及时行OPN治疗有助于提高患者的整体预后[8]。而导致一部分患者仍然需要OPN治疗的影响因素目前暂不明确[9-10],因此本研究旨在分析基于“step-up”治疗原则行外科干预的SAP患者后期需要继续行OPN的危险因素。
1 资料与方法
1.1 研究对象 收集2010年1月1日—2018年6月30日在遵义医科大学附属医院被诊断为SAP并行相应外科治疗患者的临床资料,其中行单纯PCD治疗的SAP患者126例,早期PCD治疗后必要时行OPN治疗的SAP患者30例,具体筛选过程见图1。根据后期是否行OPN分为单纯PCD组和PCD+OPN组。纳入标准:(1)参考中华医学会制定的《中国急性胰腺炎诊治指南(2019年沈阳)》[11]中SAP的诊断标准,即在具备急性胰腺炎临床症状及生化表现的基础上合并有持续(>48 h)的器官功能衰竭;(2)年龄18~80岁;(3)能较好地配合治疗。排除标准:(1)已在外院接受任何外科有创性干预的SAP患者;(2)排除恶性胆道梗阻及慢性胰腺炎急性发作所致SAP;(3)排除既往有腹部手术史的SAP患者;(4)排除资料不完整的患者。

图1 临床资料处理流程图
1.2 治疗方法
1.2.1 基于“step-up”治疗原则的外科干预 (1)早期保守治疗:所有患者在入院时都接受了早期标准化治疗,包括补液扩容、肠内及肠外营养、抗生素使用、各器官衰竭的对症支持治疗等。(2)PCD干预:当保守治疗无效时,在超声或CT的引导下行PCD,PCD置管成功后,常规每6 h用0.9%氯化钠溶液冲洗导管以避免导管堵塞,并在72 h内行CT检查确认胰周积液减少,临床症状改善则认为PCD成功。如果未见明显疗效,检查结果提示引流不充分则尽量更换较大的导管或者尽量进行多点穿刺置入多根引流管。(3)OPN干预:当临床症状仍然不缓解,甚至出现多器官功能衰竭(multiple organ failure,MOF)及胰周继发感染,并发胰瘘或者肠瘘等严重并发症则认为是PCD失败,保守治疗无效,应及时行OPN,开腹清除胰周坏死组织后关闭腹腔并常规留置引流管,为后期引流及行腹腔灌洗预备条件。
1.2.2 行PCD的指征 (1)早期保守治疗无效主要表现为:①持续发热;②白细胞计数升高;③恶化或新发的器官功能衰竭;④检查提示胰腺周围出现气体。(2)合并腹腔间隔室综合征或腹腔压力持续或者反复>12 mm Hg时。
1.2.3 行OPN的指征 (1)PCD术后出现持续的或加重的脓毒症(白细胞计数持续处于高水平或者有增高的趋势;持续/加重的器官功能衰竭,或是新出现的器官功能衰竭)。(2)进展中的脓毒症。(3)对胰周积液及坏死物引流不充分。(4)患者食欲减退,普通饮食或者肠内营养提供不了足够的营养,体质量不能增加,出现顽固性的低蛋白血症。(5)进展中的脓毒症伴随发生肠道坏死、肠瘘、肠梗阻等严重的并发症。
1.3 定义 参考中华医学会制定的《中国急性胰腺炎诊治指南(2019年,沈阳)》对急性胰腺炎的诊断、严重程度分级、全身并发症和局部并发症的定义。
SAP患者入院时合并感染:(1)感染的诊断建立在任何侵入性的操作取得标本的细菌学培养阳性证据;(2)在影像学上明确发现有气体出现在胰腺及/或周围的积液中;(3)临床上出现脓毒血症或有明确的临床感染症状。
进展中的脓毒症:患者有间歇性的发热,白细胞计数较正常值增多或者减少,影像学上显示胰周坏死物不完全溶解,可能伴随化脓的引流物经导管排出。
对胰周积液及坏死物引流不充分:更换较大的导管,尽量进行多点穿刺并加强了灌洗后胰腺周围仍然存在局部溶解不完全的死腔。
1.4 伦理学审查 本研究方案经由遵义医科大学附属医院伦理委员会审批,批号:KLL-2020-036,所纳入患者均已签署知情同意书。

2 结果
2.1 影响SAP行OPN的单因素分析 PCD组和PCD+OPN组患者在年龄、性别、病因、入院血钙、入院白细胞、CTSI评分≥7分、APACHE-Ⅱ评分、Ronson评分、胰周液体积聚、合并感染比较差异均无统计学意义(P值均>0.05)。PCD组与PCD+OPN组相比,入院合并MOF所占比例更少(27% vs 70%,P<0.01);干预时间<1周所占比例更高(61.9% vs 20.0%,P<0.01)(表1)。
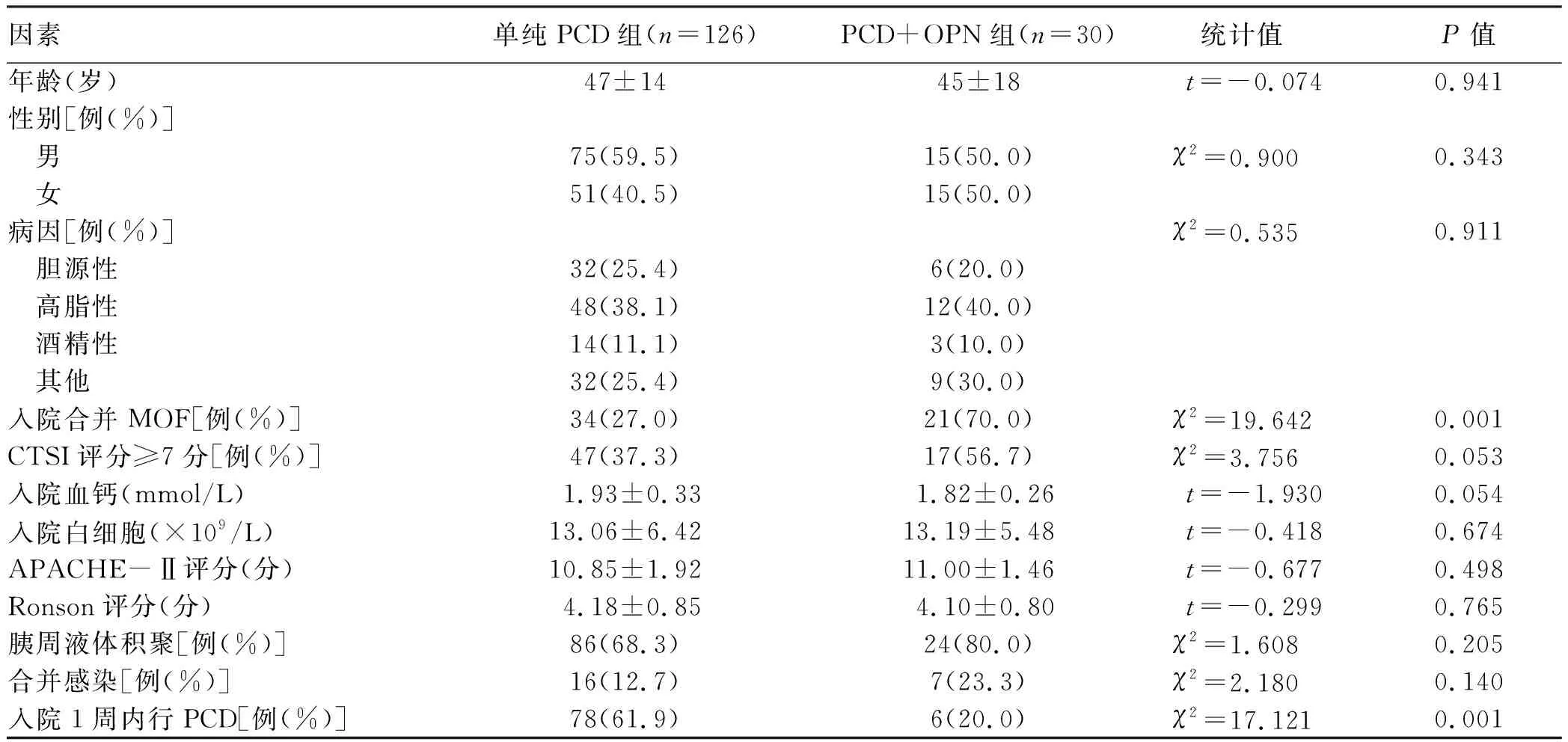
表1 SAP行OPN单因素分析
2.2 影响SAP行OPN的多因素分析 采用多因素logistic回归分析,纳入了在单变量分析中的6个参数,包括:CTSI评分、APACHE-Ⅱ评分、Ronson评分、初次PCD干预时间是否<1周、入院时是否合并MOF、入院时是否合并感染。经计算入院时合并MOF(P=0.002,OR=5.343),入院后>1周行PCD治疗(P=0.004,OR=5.518),入院时合并感染(P=0.018,OR=5.061)是基于“step-up”治疗原则的SAP患者后期继续行OPN清除坏死组织的独立风险因素(表2)。
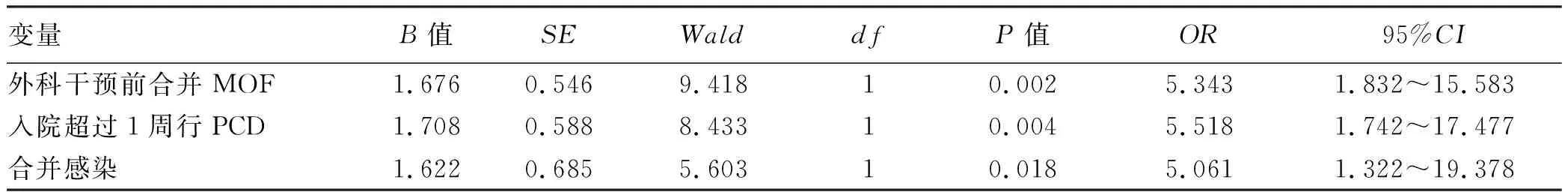
表2 SAP行OPN多因素logistic回归分析
3 讨论
PCD目前被认为是对SAP局部并发症进行早期适当干预的首选,PCD通过早期干预可以有效控制一部分SAP患者病程进展中的胰腺坏死和感染,当病情依然进展时又可以为进一步清创手术提供手术入路,并为后期清创手术争取了时间[12-14]。但是对PCD的过度热情可能会延误OPN的时机,影响患者的预后,因此尽早识别出相关危险因素及时行OPN治疗具有重要意义。
MOF是导致SAP患者死亡的关键因素,据报道无器官衰竭患者的死亡率为0,单器官功能衰竭患者的中位病死率为3%,MOF患者的中位病死率为47%[15-16],虽然PCD可以成功治疗35%~50%合并胰周坏死感染的SAP患者,但对于伴有MOF的SAP,PCD并不能降低死亡率[17-19]。Babu等[20]发现,发病1周内器官衰竭是SAP需要早期手术的预测因素。Ji等[21]也发现在行PCD干预前24 h内存在MOF以及PCD干预后存在超过3 d的持续性MOF是患者需要行OPN治疗的危险因素。本研究亦得出类似结论,入院时合并MOF是基于“step-up”治疗原则的SAP患者后期需要行OPN的危险因素。合并MOF患者单纯PCD治疗往往不能控制病情,需要进一步行坏死物清除术,在本研究中PCD组患者入院时合并有MOF占27.0%(34/126), 其中70.6%(24/34)合并有MOF的患者死亡;PCD+OPN组70.0%(21/30)患者入院时合并有MOF, 其中57.1%(12/21)合并有MOF患者死亡。合并MOF的患者的病死率在PCD+OPN治疗组显著低于PCD治疗组,说明OPN可以降低合并MOF的SAP病死率,这表明SAP在入院时合并有MOF可以作为后期需要进行OPN的有效预测因子。
本研究结果提示入院1周以后行首次PCD干预是患者病情不能得到有效控制需要进一步OPN的风险因素。目前关于SAP治疗的诊疗指南普遍建议,侵入性的介入操作应该推迟到胰周坏死物及积液形成局限性包裹后,相关指南认为对SAP周围的非包裹性坏死进行清创在技术上较困难,有损伤邻近空腔器官而造成出血和穿孔的风险[22-23]。而在形成局限性包裹前患者往往因为腹腔压力进一步增高,肠道细菌异位等原因使胰周积液合并感染,会使得病情加重,出现全身炎症反应综合征、胰周感染、MOF,需要进重症监护病房进行进一步生命支持,然而PCD具有的微创优势使得对这类患者进行早期干预在技术上是可行的[24]。在这种情况下,是否应该在胰周坏死物形成封闭性包裹阶段之前进行导管引流是目前仍然存在争议的问题。本院考虑PCD具有微创的特点可早期引流胰周炎性液体,PCD术后可以通过调整导管的位置、多次置管、延长引流时间来充分引流,降低腹内压,减少SAP患者早期合并症的发生率[25-27],因此作者认为推迟PCD干预时间是患者需要进一步行OPN干预的危险因素。
本研究也发现,SAP患者入院合并感染是后期需要行OPN治疗的独立危险因子。研究报道SAP患者合并胰周感染与死亡率密切相关[18,28],约25%的 SAP 患者因早期感染发生会导致合并MOF的风险增加,导致病死率高达30%~60%[29]。因此既往指南推荐SAP患者一旦发生感染,即为外科干预的绝对指征,但对于手术时机的选择建议是在胰周感染形成局限性包裹后[30]。临床上此类型的患者往往合并广泛的胰腺坏死, 早期PCD治疗同样存在操作困难问题,术后易出现引流不畅,并发肠瘘、肠穿孔、新发胰腺组织坏死等并发症,并且拔除置管后再置管成功率低[31-33],但是早期PCD治疗可以帮助患者度过急性炎症期,为后续的清创手术治疗争取时间,提供手术入路,因此考虑这可能是此类患者往往需要进一步行OPN治疗的原因。
综上,入院合并MOF、推迟1周后行PCD干预、入院时合并感染是基于“step-up”治疗原则的SAP患者后期需要进一步行OPN的独立风险因素,识别相关危险因素,有利于合理调整PCD导管引流的时间,把握开腹手术的时机,为SAP患者争取更好的临床预后。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:段玉灵、彭慈军负责课题设计,资料分析,撰写论文;刘康伟、王磊参与收集数据,修改论文;冯赞杰、范国鑫负责拟定写作思路,指导撰写文章并最后定稿。
