HD-ZIP 转录因子响应病菌与非生物胁迫研究进展
2021-04-19刘娇,帅鹏
刘 娇,帅 鹏
(福建农林大学林学院,福建 福州 350002)
0 前言
生物胁迫和非生物胁迫经常出现在植物生长周期中的不同阶段。生物胁迫包括病菌侵害、虫害、杂草危害等,非生物胁迫包括干旱、寒冷、高盐、光照、ABA、机械损伤等因素。植物接受和识别逆境信号后该信号就在细胞之间和整株植物中传递,进而导致植物细胞水平上的基因表达发生变化,影响到整株植物的代谢和发育。植物存在多种感知外部刺激的机制,并且形成了复杂的应激防御体系来应对生物胁迫和非生物胁迫[1]。
HD-ZIP 转录因子在调控这一系列应激反应中发挥了至关重要的作用,是植物王国中特有的一类转录因子,它参与调控了植物生长发育的各个阶段以及对逆境胁迫的应答机制。HD-ZIP 转录因子由60 个氨基酸组成的高度保守的结构域(HD)和紧接其羟基末端的亮氨酸拉链(LZ)元件组合而成[2]。该蛋白行使功能是通过两个结构域的紧密结合共同发挥作用,这是与DNA 结合的先决条件[3]。HD 作为与DNA的结合位点负责与靶DNA 特异结合,LZ 介导功能性蛋白二聚体的形成[3,4]。许多HD-ZIP 蛋白对DNA作为单体具有很弱的亲和力,因此需要二聚化以提高DNA 结合效率。HD-ZIP 基因家族关于胁迫响应机制在多种植物中已被广泛研究。近年来,双子叶和单子叶植物逆境胁迫研究成果越来越多,比如黄瓜(Cucumis sativusL.)[5]、茶树(Camellia sinensis)[6,7]、芝麻(Sesamum indicum L.)[8], 辣椒(Capsicum annuumL.)[9]、麻风树(Jatropha curcasL.)[10]、桉树(Eucalyptus robusta Smith)[11]、黑麦草(Lolium perenneL.)[12]、木薯(Manihot esculenta Crantz)[13]、鹰嘴豆(Cicer arietinum)[14]等植物。本文主要总结归纳了HD-ZIP 转录因子不同植物中应对生物和非生物胁迫,基因的表达模式差异以及复杂的逆境胁迫调控机制。
1 HD-ZIP 不同亚家族的蛋白结构差异
HD-ZIP 蛋白因为其特异结合的DNA 序列的差异、编码该蛋白的内含子与外显子的模式、其他保守基序的不同等将其分为4 个亚家族:HD-ZIP Ⅰ~Ⅳ,每个亚家族因为结构的差异在植物中发挥不同的调控功能和表达模式(图1)。
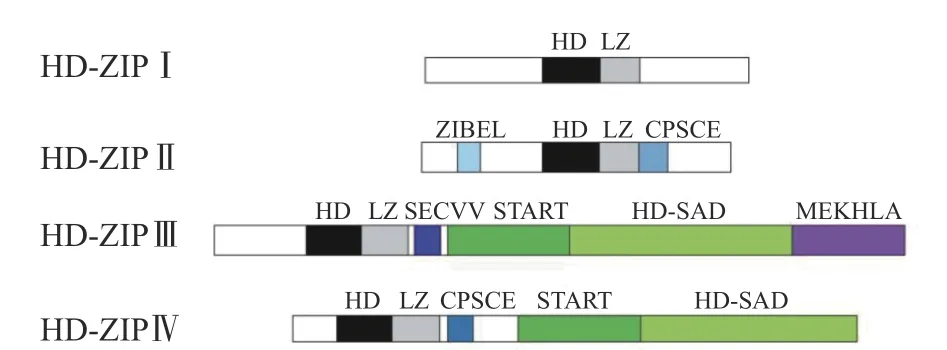
图 1 HD-ZIP 家族的分类结构示意图[15]Fig. 1 Schematic diagram of classified HD-ZIP family[15]
由图1 可知,HD-ZIP Ⅰ亚家族的蛋白结构最为简单。HD 与LZ 结构域位于蛋白的中央位置。在HD-ZIP Ⅰ的C 端发现了AHA 保守序列,该序列形成了两亲的、带负电荷的螺旋使C 端具有激活转录功能[15,16]。HD-ZIP Ⅱ和Ⅳ亚家族都具有负责蛋白质活性的氧化还原调节的CPSCE 基序。研究表明,植物的HD 结构域转录因子经历氧化还原修饰会改变其DNA 结合活性[17]。HD-ZIP Ⅲ与HD-ZIP IV 亚家族都有START 和HD-SAD 结构域[2,15]。植物中的START域可能通过结合和转运类固醇型植物激素或其他脂质分子来参与信号转导和直接调控转录[18]。HDSAD 结构域功能未知,但是在植物中其表现出高度的保守型,预示着该结构域在调控蛋白活性方面发挥重要作用[2]。四类亚家族结构的差异性表明了其具有不同的生物学功能以及在处理外源环境信号时做出不同的响应机制。HD-ZIP III 区别其他亚家族的是具有MEKHLA 结构域,有研究发现该结构域通过独立序列的空间掩蔽机制抑制蛋白二聚化,需要MEKHLA 结构域的C 末端感知到细胞信号,这种抑制作用得以缓解[19]。
2 HD-ZIP 转录因子生物胁迫调控机制
生物胁迫最常见的是细菌和病毒的侵染。植物病菌利用多种策略来对抗宿主防御,然后促进其在易感宿主中的复制,引发病变[20]。植物在应对生物胁迫时通常有基因沉默途径,激素介导的信号传导途径和代谢调控途径,这些响应机制由激素信号和其他小分子信号共同协调完成。四种激素主要调节植物-病毒相互作用中的基础防御反应:水杨酸(SA),茉莉酸(JA),乙烯(ET)和脱落酸(ABA)。这些途径可以是拮抗的,合作的或协同的。因此,植物可以微调串扰的水平,以维持有效的防御,同时将代谢余量降至最低[21,22]。HD-ZIP 在生物胁迫的调控机制的研究并不广泛,主要集中在双子叶植物中HDZIPⅠ、Ⅱ亚家族,且都为激素介导的调控机制。
实时定量PCR 表明辣椒CaHDZ27 是由外源JA,SA 或ET 的外源诱导,转录水平提高。功能丧失的VIGS 沉默实验证实了CaHDZ27 沉默增加了青枯菌(R.solanacearum)感染的敏感性并下调了防御相关基因的表达。CaHDZ27 的瞬时过表达则上调了相关免疫基因的表达,可以作为辣椒抗青枯菌的正调节剂[9]。在接种大黄萎病菌(V. dahliae)后,棉花根部会同时诱导JA 和SA 响应基因。HD-ZIPⅠ转录因子GhHB12 通过抑制JA 响应基因GhJAZ2 和GhPR3,负调控棉花对大黄萎病菌的抗性。但GhHB12 不参与SA 信号途径[23]。向日葵HaHB4 在JA 生物合成中为正调节剂,而在ET 敏感性和SA 积累中为负调节剂[23]。研究表明HaHB4、HaHB10 负调控病菌抗性[24,25]。在ATHB13 组成性过表达突变体中,SA 响应基因PR1 转录水平得到了增强,致使白粉病(Powdery mildew)和霜霉病(Hyaloperonospora arabidopsidis)敏感性降低。JA 响应的VSP 基因AtVSP1 和AtVSP2在突变体中被上调,从而激发WRKY75(防御反应的转录调节因子)表达量的提高,说明ATHB13 参与了SA 和JA 防御调控路径[26]。链格孢菌(A. alternata)为日本梨品种黑斑病的病原体,WANG 等[27]的研究显示,在梨中进行病菌接种,所选的20 个HD-ZIP基因均对病菌有响应。黄瓜HD-ZIP Ⅱ、Ⅲ、Ⅳ亚家族均被白粉病胁迫诱导表达,尤其是HD-ZIP Ⅲ亚家族中 CsHDZ30,在96 小时达到25 倍的峰值[5]。HD-ZIPⅡ亚家族HAT1 通过抑制拟南芥中防御相关基因的表达如PR1 和PR2,ROS 相关的耐药性蛋白质谷胱甘肽转移酶(GST)而抑制了对黄花叶病毒(CMV)的防御。在hat1hat2hat3 和hat1 或hat2hat3 功能丧失突变体对接种病毒实验中发现HAT1,HAT2和HAT3都作为病毒抗性的负向调节因子[20]。
3 非生物胁迫的调控机制
在响应非生物胁迫中,HD-ZIP Ⅰ、Ⅱ仍作为重要的调控因子,成员对多种逆境胁迫均有响应。HDZIP I 亚家族已被鉴定在干旱与盐胁迫中发挥重要作用。HD-ZIP Ⅱ主要参与避光反应响应光质变化。而HD-ZIP Ⅲ主要在植物维管组织发育以及叶片、生长素极性等方面发挥重要调控作用,参与非生物胁迫较少。HD-ZIP Ⅳ在干旱中的调控作用尤为显著。本文主要归纳总结了HD-ZIP 在干旱、盐、温度、弱光、金属、机械损伤非生物胁迫下的响应机制。
3.1 响应干旱胁迫机制
HD-ZIP 在干旱胁迫下显示出普遍的诱导水平。HD-ZIP 参与的干旱胁迫响应机制在双子叶植物和单子叶植物中被广泛研究,以Ⅰ、Ⅱ、Ⅳ三类亚家族诱导表达最为显著(表1、图2)。在缺水条件下,叶片气孔密度和保卫细胞大小将根据水分状况而变化,从而影响植物蒸腾作用。气孔密度的减小可降低蒸腾速率,防止水分散失[28,29]。桉树EcHB1 过表达品系由于叶面积减少而气孔密度没有变化导致蒸腾速率降低,减少了树木的水分流失,提高了植物耐旱性[11]。AtEDT1/HDG11 的过表达通过降低气孔密度,促进气孔闭合来增强转基因水稻、棉花和杨树、胡椒和芥蓝的干旱和渗透胁迫耐受性并增加谷物产量[30−33]。HDG11 通过与ERECTA 启动子中的同源域结合(HD)顺式元件结合,转录激活ERECTA。反过来,ERECTA 依靠E2Fa 来调节细胞周期相关基因的表达。HDG11-ERECTA-E2Fa 遗传途径可通过增加细胞大小来降低气孔密度,从而改善作物水分利用率来控制生长。ABA 的增加可以通过触发气孔闭合来控制蒸腾作用。拟南芥HD-ZIP IV 基因HDG11是提高耐旱性的重要转录因子。转基因水稻中,过表达的HDG11 通过诱导ABA 生物合成的关键基因OsNCED的表达,从而提高ABA 的含量,促使气孔闭合能力增强[30]。在转基因芥蓝中,HDG11 过表达导致ABA 超敏反应,诱导气孔关闭,而且靶向生长素生物合成基因YUCC6 和ABA 响应基因ABI3 和ABI5,说明HDG11 通过生长素和ABA 介导的芥蓝增强干旱和盐胁迫耐受能力[33]。AtHB12 和AtHB7 充当ABA 信号的负调节因子,在成熟植物中,AtHB7和AtHB12 的协调表达导致不同的气孔状态和蒸腾作用来响应ABA 介导的干旱调控[34]。然而,鹰嘴豆中的PP2C 在CaHDZ12 过表达植物中被下调,并且SnRK2激酶的表达得到增强,从而诱导气孔关闭。所以CaHDZ12 作为ABA 调控路径的正调节剂。过表达品系中显著上调了多种干旱胁迫响应基因,转基因品系的耐旱性增强[14]。盐芥中HD-ZIP IV 基因EsHdzip1在干旱胁迫下,转基因烟草中的ABA 含量明显高于野生植物。ABA 的高水平积累与其生理和生化反应一致。同时过表达的EsHdzip1 品系中抗坏血酸过氧化物酶(APX)和TSS 的含量升高,诱导了NtP5CS,NtERD10C和NtLEA5 的表达,使植物遭受干旱胁迫时控制较低的细胞水势,增强了保水能力[35]。OsHOX24 也参与了生长素和ABA 的交叉互作。OsHOX24 的过表达下调了IAA 的生物合成涉及的基因的表达。过表达与野生型相比对ABA 的敏感性更高,在干旱胁迫下气孔关闭能力受损。过表达品系中根系和芽的生长受到抑制,叶绿素含量显著低于野生型,以此作为干旱防御机制的负调控因子[36,37]。玉米ZmHDZ4,ZmHDZ10过表达在ABA 培养基中抑制了发芽率,苗高和根长高于野生型,说明都对ABA 显示出高敏感性,都有可能影响ABA 信号传导[38,39]。转基因植物具有比野生植物更高的相对含水量(RWC),存活率仍高于野生型。关于ZmHDZ10 应对胁迫条件的分子机制。干旱处理5 天后,WT 和转基因拟南芥均激活了胁迫和ABA 响应基因,包括P5CS1,RD22,RD29B和ABI1 这些植物在转基因植物中的表达水平显著高于野生型植物中的水平[39]。
根部的生长发育对干旱胁迫发挥关键作用。JA相关基因的转录水平通过HDG11 的过表达而上调,促进侧根形成使根吸收土壤水响应干旱胁迫[40]。HDG11 也可能调节影响根发育的其他下游信号通路。功能获得突变体 edt1D 的主根伸长和侧根增多表型可能是多种信号通路整合的结果。研究证明,HDG11 通过上调细胞壁松弛蛋白基因以促进拟南芥中的根的发育[41]。

表 1 HD-ZIP 在干旱胁迫下的不同表达模式Table 1 Differential expressions of HD-ZIP transcription factors under drought stress

图 2 HD-ZIP 干旱胁迫调控通路Fig. 2 Regulatory route of HD-ZIP in response to drought stress
木质素的积累也会影响干旱耐受性。比如卷曲的叶子和矮化(cld1)突变体在次生细胞壁中的木质素含量显著降低,从而导致cld1 叶片缺水并降低了抗旱性[42]。桉树EcHB1 过表达细胞株茎干中的维管解剖结构发生了变化,径向直径减小且细胞壁厚度增大。这些变化增强木质部细胞的刚度,但会降低茎中的水力传导度,因此,还将减少干旱期间树木的水分流失[11]。水稻OsTF1L的过表达诱导木质素合成基因的表达从而促进了木质素在芽中的积累,介导干旱防御机制。此外OsTF1L直接绑定到气孔运动基因的启动子,促使气孔关闭,并且OsTF1L可上调许多干旱诱导基因,比如PMEI,LEA,HSP等,当这些基因过表达时可提高植物耐旱性[43]。
HD-ZIP 还与其他干旱应答基因互作,响应干旱调控机制。通过酵母单杂交筛选,鉴定出HD-ZIPⅠ类TFAtHB13 是干旱防御因子JUB1 的上游调节基因。因此表明,AtHB13 和JUB1 建立了联合干旱胁迫控制模块[44]。TaCBF5L在严重干旱条件下被剧烈上调,将玉米TaHDZipI-4 启动子与TaCBF5L基因结合作用可显著提高转基因小麦在严重干旱胁迫下(>4 MPa)开花期间的籽粒产量。但当植物在良好的浇水条件和中度干旱条件下并没有观察到产量的提 高[45,46,47]。综上所述,HD-ZIP 在干旱胁迫下调控通路较为多元,HD-ZIPⅠ转录因子主要参与激素调控网络。越来越多报道显示HD-ZIPⅣ参与干旱诱导的氧化胁迫调控,在此基础上着重于干旱胁迫调控网络中HD-ZIP 的共调节因子,发现复杂通路中基因的关联性和互动性。

表 2 HD-ZIP 转录因子在盐胁迫下不同表达模式Table 2 Differential expressions of HD-ZIP transcription factors under salt stress
3.2 响应盐胁迫的分子机制
芝麻[8]、木薯[13]、茶树[6]、梨[26]、麻风树[10]的某些HD-ZIP 转录因子在干旱胁迫和盐胁迫下均被诱导。此外,多数黄瓜HD-ZIP 转录因子在盐胁迫下上调表达[5]。盐胁迫下Na+、CO32−、HCO−以及高pH值都会对植物的生长发育产生负面影响。其中Na 盐对植物的危害最为普遍。高盐环境会导致严重的渗透胁迫并破坏细胞的正常活动。比如使植物产生过量ROS,从而造成膜脂过氧化、酶失活以及DNA 破坏等伤害[48,49]。因此,盐胁迫可相继引发渗透胁迫和氧化胁迫。HD-ZIP 在盐胁迫下的调控机制也较为细致(表2,图3)。HD-ZIP 转录因子可通过激活抗氧化系统、调节渗透稳态、维持Na+/K+的稳态以及调控下游胁迫响应基因参与ABA调控通路参与盐胁迫应答。HD-ZIP 基因可以提高抗氧化酶的活性和一些可溶性有机物质的积累[50]。比如HDG11 转基因胡椒和棉花杨树中,在高浓度NaCl 胁迫处理期间具有较高水平的脯氨酸、可溶性糖,抗氧化酶(SOD)和CAT,使植物的氧化损伤降低并且有利于通过调节渗透稳态来耐受盐胁迫压力。HDG11 转基因植物呈现出低含量的MDA,其作为脂质过氧化作用的终产物,其含量越低,越有助于维持膜和蛋白质体内的稳态[30,31]。此外,AtHDG11过表达植物盐胁迫条件下具有更好的维持Na+/K+稳态的能力。先前的研究报道,经过盐处理后,AtHDG11转基因高羊茅可以在叶片和根部保持相对稳定的Na+/K+比值,从而提高了转基因植物的耐盐性[51]。PtrHox11 基因能够提高植物体内过氧化物酶的活性。过表达PtrHox11 中POD 活力迅速升高减少了过氧化氢等物质对植物体的危害,并且过表达PtrHox11 的植株相对电导率低于野生型植株和基因沉默型植株。这说明了PtrHox11 过表达能够减小细胞膜破坏程度,从而维持较低水平的膜透性[52]。过表达鹰嘴豆CaHDZ12 品系中,谷胱甘肽过氧化物酶(GPX)和谷胱甘肽还原酶(GR)内源性水平比野生型中增长使离子泄露减少,降低了膜损伤[14]。抗坏血酸(AsA)可清除活性氧,参与抗氧化防御系统。有研究揭示,番茄SlHZ24 通过上调SlGMP3、SlGME1 或SlGME2 等基因的表达来促进AsA 的生物合成。结果表明过表达SlHZ24 的植物对氧化应激的敏感性降低,提高了盐胁迫耐受能力[53,54]。与野生型植物相比,盐胁迫下ATHB17 过表达系具有更好的根系生长优势,并且ATHB17 通过直接激活ATSIG5,提高抗氧化能力,调节盐胁迫耐受性[55]。
HD-ZIP 转录因子还可通过直接调控下游胁迫响应基因参与盐胁迫。比如碳酸氢盐(NaHCO3)胁迫下,大豆Gshdz4 通过直接诱导碳酸氢盐防御基因(比如NADP-ME和H+-Ppase)的高表达来调节细胞内细胞质的潜在酸化,此外还诱导了ABA 响应基因(KIN1 和RD29B)协调盐胁迫下植物细胞的生理条件[56]。番茄SIHB2 沉默品系中抗氧化酶和脯氨酸的上调外,还诱导了ABA 反应元件结合因子AREBs,乙烯反应性元素结合因子ERF 的表达,说明番茄SIHB2 负调控盐胁迫通路[57]。玉米HD-ZIP 转录因子HD-ZIPⅠ亚家族也参与ABA 介导的盐胁迫响应途径。用200 mmol·L−1NaCl 处 理 对ABA 敏 感 性 高 的ZmHDZ10 15 天后,大多数转基因植物仍生长良好,绿叶数量多且重量高于野生型植物,存活率远远高于野生型[39]。盐胁迫下玉米ZmHDZ1 过表达使ABA响应基因OsABI5 的转录本比WT 中的更多。同时上调了盐胁迫负调节因子OsHox22,下调了胁迫应答关键基因OsLEA3 和OsRAB16A,所以ZmHDZ1是ABA调控盐胁迫通路的负调节因子[58]。麻风树耐盐性试验结果显示JcHDZ16 降低了转基因水稻的耐盐性,并提高了对ABA 的敏感性,是ABA介导的盐胁迫响应中的负调节因子[10]。以上可知,HD-ZIP 在盐胁迫下部分调控路径与干旱胁迫下相似。干旱与高盐环境下植物生理生化指标相似,都可通过调节渗透势缓解,HD-ZIP 转录因子可作为中间节点,将两种胁迫串联成相互制约影响的双向调控通路。

表 3 HD-ZIP 转录因子在高温与低温胁迫中的不同表达模式Table 3 Differential expressions of HD-ZIP transcription factors under high- and low-temp stresses
3.3 响应温度胁迫的机制
温度胁迫包括高温、低温和剧烈变温胁迫。HDZIP 研究较多的是高温和低温胁迫。这两种胁迫下都会使多数酶活性减弱,导致异常的生化反应和细胞的死亡。某些HD-ZIP 转录因子在两种胁迫下都可被诱导表达,比如黄瓜、土豆的某些基因均被上调[8,59](表3)。黑麦草中两种胁迫处理表现出极大的差异。在冷处理中(4 ℃)13 个LpHOX基因的表达水平在叶片中均显著上调。在热胁迫下(40 ℃),大多数基因在叶片和根部中均被下调[12]。
低温胁迫主要分为冷害和冻害,以高于或低于0 ℃为界限。番茄HD-ZIP I 基因结果表明,全部22 个基因均受冷胁迫诱导。其中有13 个(59%)显著上调,8 个(36%)下调[60]。DREB/CBF是低温诱导蛋白,在低温时激活一系列下游抗逆基因的表达。TaHDZipI-3和TaHDZipI-4 在转基因小麦和大麦中驱动诱导了两个DREB/CBF基因TaDREB3 和TaCBF5L的表达。两个基因的过表达提高了转基因大麦和小麦幼苗的夜晚霜冻耐受性[45,46]。Nataliya等[61]研究表明小麦受冷胁迫处理导致TaHDZipI-2 内源转录本水平降低,但通过过表达该基因却增强了植物抗冻性。这是因为一些DREB/CBF基因独立于TaHDZipI-2 而表达,并且HDZipI-2 在转基因中的组成型过表达显著上调了低温耐受基因VRN1、TMC-AP3 和BM3 的表达,从而提高低温胁迫抗逆性。TaHDZipI-5 被冻害强烈诱导,通过耐寒性试验表明TaHDZipI-5 在寒冷胁迫下(−7 ℃和−8 ℃)6.5小时的存活率明显高于野生型。TaHDZipI-5 在受精前和籽粒发育的早期在花中的表达,可能表明该基因参与了对夜霜最脆弱的小麦组织的保护[47]。
对于高温耐受性的研究较少。已知数据显示,通过检测多年生黑麦草HD-ZIP 基因在耐热品系与热敏性品系之间的表达水平,推断黑麦草基因的耐热基因。多年生黑麦草热敏系中LpHOX6,LpHOX8 和LpHOX24 的表达水平较高,因此对耐热性产生负调控因子,而LpHOX21 在耐热品系中表达较高,可能作为多年生黑麦草耐热性的正转录调节因子[12]。热休克蛋白(HSP)在植物应对高温胁迫时会大量合成,维持细胞蛋白内环境稳定性提高应激耐受性。在温暖(20-30 ℃)干燥的环境中,HaHB4 通过诱导氧化还原和热休克蛋白编码基因在转基因大豆中的表达,表明HaHB4在耐热机制的潜在功能[62]。HSP 是研究高温胁迫重要的调节因子,因此HDZIP 与HSP 之间调控通路研究可以作为发掘HDZIP 高温胁迫下生物功能的一个重要突破口。
3.4 响应弱光胁迫的机制
当植物受到周围植物冠层遮阴后,会导致茎秆暴露在低R/FR 和蓝光下,形成弱光胁迫。归结多种报道可知,拟南芥HD-ZIP Ⅰ、Ⅱ对光质变化较为敏感,当光敏色素感知到冠层光信号后主要通过诱导茎秆生长参与避光反应(图4)[63,64]。在拟南芥中,避荫是由基因表达的正向(PIF)和负向(HFR1/SICS1)调节因子进行调节,从而确保植物体快速重塑成最适合生长的环境[64]。PIF1 诱导了AtHB1 的表达,主要集中在下胚轴和根中。AtHB1 在PIF1 下游起作用,在短时间的光周期下促进下胚轴生长[65]。ATHB21,ATHB40,ATHB53 参与了激素响应光信号途径。在低R:FR 或短光周期条件下,腋芽发育抑制因子BRC1可以直接激活ATHB21,ATHB40,ATHB53。 这些基因上调ABA 生物合成基因NCED3 的表达,从而使植物在腋芽内正常充足的ABA 积累,对有限光照条件下芽发育和分支生长的调控至关重要[66]。

图 4 HD-ZIP 避光反应调控通路Fig. 4 Regulatory route of HD-ZIP in response to shading
HD-ZIP II 亚家族中,低R/FR 光线可在下胚轴和子叶柄的延长部分的所有细胞层中迅速诱导ATHB2:GUS表达,因此表明ATHB2 在这些器官中起到控制避光的作用。长时间暴露于低R/FR 下,ATHB2:GUS和ATHB2:GFP蛋白水平都会降低,这表明ATHB2 也可以在蛋白质稳定性水平上进行调节[67]。同时低R/FR诱导的植物生长素稳态和植物生长素运输变化是避光的关键,表明已经建立了ATHB2 和生长素之间的联系,在避光反应中起着至关重要的作用[68]。植物色素(拟南芥中的phyB,phyD和phyE)感知到红(R)与远红(FR)的比率的变化,从而在光质变化之间产生动态的光平衡。phyB,phyD 和phyE 都通过低比率R/ FR 来参与ATHB2 的调控,已证实phyB在遮阴条件下负调控植物下胚轴的伸长率[63,64, 67]与此相关的是,ATHB2 同源基因在单子叶植物(玉米)和双子叶(番茄)植物中都是通过低比率R/FR诱导的,强烈表明HD-ZIP II 的功能可能通过进化得以保持[69,70]。ATHB2 与ATHB4 受避荫反应的负调控因子HFRl/SICSl 的调控。长时间暴露于遮荫条件下,hfr1-4/sics1-1 功能丧失突变幼苗的下胚轴和子叶柄中的ATHB2,ATHB4 上调,而HAT1 和HAT3 则没有变化。ATHB2 和ATHB4 基因协同作用,植物被遮蔽时均显示出叶肉细胞增殖的早期终止,表明在树冠遮荫下控制叶片发育[71]。
HD-ZIP Ⅲ中REV 直接影响几个与植物避荫作用相关的HD-ZIP Ⅱ基因的表达。比如REV 的基因靶标中有HAT3,ATHB4,ATHB2 和HAT2,并且有证据表明HAT3 还同时受PHB 和PHV 的调控,在模拟阳光下HAT3、ATHB4 和PHB,PHV 和REV 中表现出重叠的表达模式[67,72]。上述总结得知,HD-ZIP 转录因子在弱光胁迫下处于下游调控的位置,受到多种因素调控,因此研究HD-ZIP 是否可以在上游发挥作用成为比较新颖的方向。比如HD-ZIP Ⅱ能否在上游通过激活其他转录因子调控PIF 的表达,比如ATHB2 与植物色素PhyB/D/E(PIF 的抑制因子)的负反馈通路,从而达到正调控弱光胁迫的作用。
3.5 响应重金属胁迫的机制
重金属是脂质过氧化的诱导剂,当植物受到重金属特别是有毒重金属污染后会造成生物膜结构功能破坏影响植物代谢。某些重金属元素比如铁(Fe)需要维持含量的稳态从而使植物正常发育。ATHB1通过和Myb.Ph 转录因子的结合从而负调控CaFer1响应铁的表达,从而抑制铁元素过度表达,以此参与对铁元素稳态的调控[73,74]。锰(Mn)是一种有毒重金属,在土壤中诱导会限制农作物的生长。有数据表示,使用cDNA-AFLP 从不耐锰的柑橘和耐锰的柑橘根中鉴定出87 和63 个锰反应基因。在这些基因中,根中HD-ZIP I 蛋白(TDF#170-1 和170-1k)在锰毒性下被上调。HD-ZIP I 的上调在不耐锰性柑橘中比在耐锰性根中更为明显。这些发现突出了HD-ZIP I 蛋白在锰耐受性调节中的作用[75]。镉(Cd)也属于重金属的一种,有研究表明,miR166 与其HD-ZIPⅢ靶基因共同作用,对镉胁迫产生响应[74]。结果显示在Cd 胁迫下叶片中miR166 及其靶基因HD-ZIP 的表达水平呈现负相关关系。当施加外源SA 处理后加大了诱导幅度,miR166 显著上调,而HD-ZIP 因子被显著下调。HD-ZIP 过表达可显著增加稻Cd 积累,可以得知HD-ZIP Ⅲ作为水稻抵御镉元素损伤的负调节因子[76]。
3.6 响应机械损伤的机制
最新的研究表明[77],在机械性创伤下,小麦HD-ZIP Ⅳ蛋白TaGL7 和TdGL7 转录数量迅速增加(在1 小时内),但在发生创伤后3 小时又恢复到原始水平。说明GL7 基因对创伤胁迫的响应是短暂的。GL7 启动子在转基因水稻中的活性总体上强于小麦和大麦则可以证明它具有谷物特异性。小麦HD-ZIP IV 转录因子GL7 激活了三个创伤诱导型防御素启动子TdPRPI-5、TdPRPI-7、TdPRPI-8,触发创伤响应。可能表明TdGL7 位于伤口诱导途径的末端,其产物参与防御和脂质输送以修复受损的细胞壁或表皮,暗示HD-ZIP IV TF 可以直接通过激活某些与病程相关的蛋白来参与植物对病原体的防御[77,78]。除此之外,HD-ZIP I 的基因也被检测到受机械损伤诱导。HD-ZIP I中SIHB2 在机械损伤显著诱导。在0~8 h 上调,在8 h 达到18.1 倍,之后表达量逐渐减少[57]。通过对苹果MdHB-1 启动子在转基因烟草叶子中对胁迫响应分析得知,机械损伤的叶子GUS 活性比对照高1.3 倍,表明MdHB-1 基因启动子可以响应机械损伤胁迫来调节MdHB-1 蛋白的表达[79]。综上,现阶段对于机械损伤的分子调控机制研究不够深入。植物角质层的发育可以抵御机械损伤胁迫以及生物胁迫,所以阐明HD-ZIP 转录因子与脂质转运蛋白之间的调控关系有利于跟进植物防御体系研究。
4 研究展望
HD-ZIP 转录因子参与植物的适应性反应是通过多种机制实现的,这些机制与每个外部因素的信号遗传系统相关。研究发现,这些基因是一个中间环节,将不同的级联结合在一起,并将环境信号导向抗性效应基因。这决定了HD-ZIP 基因成为植物对外部不利因素适应性反应的重要调节剂。对于胁迫应答机制HD-ZIP Ⅰ、Ⅱ亚家族的研究比较详尽,除广泛研究的ABA 信号通路外,其他激素的调控网络中也可深入探讨HD-ZIP Ⅰ、Ⅱ亚家族的调控路径。HD-ZIP Ⅲ亚家族可以结合MIR165/166进行更多关于逆境胁迫的探讨。HD-ZIP Ⅳ亚家族中的HDG11 基因参与了多种调控机制,在调控干旱和盐胁迫中发挥至关重要的作用。机械创伤胁迫响应是HD-ZIPⅣ转录因子较为新颖的生物功能,今后可以作为深入研究的方向。HD-ZIP 分子机制仍需要继续完善,比如不同成员新的逆境表达模式,如何参与不同激素的信号传导途径以及对下游基因的调控表达都需要进一步探讨,以期达到对HD-ZIP 逆境调控机理更为细致全面的阐释。
