喷雾干燥法制备玫瑰茄花色苷微胶囊条件优化
2021-04-19赵彦巧孟翔宇李钰琨
赵彦巧,王 月,孟翔宇,李钰琨
(天津商业大学生物技术与食品科学学院/天津市食品生物技术重点实验室,天津 300134)
0 引言
【研究意义】玫瑰茄(Hibiscus sabdariffa),别名洛神花,是一种药用可食植物[1]。玫瑰茄富含大量的花色苷和有机酸[2−3]。花色苷是一种天然水溶性色素,具有助消化、降血压和抗氧化的重要作用。然而由于其化学稳定性低,易直接受到光、温度、pH 和一些金属离子的影响[4−5],极大限制了花色苷在食品和医药方面的应用。微胶囊技术能够有效保护活性成分,减少外部因素的影响,控制芯材释放,延长产品的储存期限,减少营养物质的流失等[6−7]。其中喷雾干燥法是一种适用于热敏性材料微胶囊化的物理方法[8],与其他方法相比,喷雾干燥法产生的颗粒更细更均匀[9]。麦芽糊精具有溶解性好和稳定性高的特点,阿拉伯树胶是一种具有良好的乳化和成膜特性的水溶性多糖[10],以两者为复合壁材,通过喷雾干燥法制备玫瑰茄花色苷微胶囊,可以提高花色苷的稳定性,使其更好地应用于食品和医药领域。【前人研究进展】唐璐等[11]采用正交试验优化黑果腺肋花楸花色苷微胶囊工艺条件,结果表明最佳工艺条件为:壁材(阿拉伯胶与麦芽糊精)质量比2∶3、芯壁质量比2∶8、入口温度120 ℃、进料量15 mL·min−1,花色苷微胶囊化后稳定性明显提高。Mehdi 等[12]对喷雾干燥法制备薄荷精油微囊的工艺条件进行优化,结果表明最佳条件是壁材35%,精油4%,入口温度110 ℃,最大保留率为91.0%。Mohammed等[13]研究发现,经微囊化处理的红树莓花色苷热稳定性和储存稳定性明显提高,在模拟胃肠道条件下具有良好的释放性能。【本研究切入点】目前采用喷雾干燥法制备玫瑰茄花色苷微胶囊的研究以及微胶囊化花色苷的稳定性在国内外鲜见报道。【拟解决的关键问题】本研究以阿拉伯树胶和麦芽糊精为壁材,玫瑰茄花色苷为芯材,优化喷雾干燥法制备玫瑰茄花色苷微胶囊的工艺条件,以提高包埋率及稳定性;并用扫描电镜观察花色苷微胶囊的微观形貌,考察微胶囊在不同条件下的稳定性,为玫瑰茄的深度开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
玫瑰茄(云南武定),阿拉伯树胶(食品级)、柠檬酸(食品级)(均为河南扩源化工产品有限公司产品),麦芽糊精(食品级)、柠檬酸钠(食品级)(均为浙江一诺生物科技有限公司产品),氯化钾(AR)(天津市致远化学试剂有限公司),浓盐酸(AR)(天津百奥泰科技发展有限公司),无水醋酸钠(AR)(国药集团化学试剂有限公司),无水乙醇(AR)(天津市鑫桥化工贸易有限公司),纯水(实验室自制)。
1.2 仪器与设备
YC-015 实验型喷雾干燥机(上海雅程仪器设备有限公司),SHZ-B 水浴恒温振荡器(上海博迅实业有限公司医疗设备厂),AX224ZH 分析天平[奥豪斯仪器(常州)有限公司],UV-2600 紫外可见分光光度计(日本Shimadzu),ST3100 pH 计(奥豪斯仪器有限公司),RV10DIGITAL 旋转蒸发仪(德国IKA),XO-SM100 超声-微波协同萃取仪(南京先欧仪器制造有限公司),真空冷冻干燥系统[科仪创智(北京)科技发展有限公司],AH-100D 高压均质机[安拓思纳米技术(苏州)有限公司],MA150 水分测定仪[赛多利斯科学仪器(北京)有限公司],S-4800 扫描电镜(日本Hitachi 公司),意大利Niro Soavi试验型高压均质机NS1001L.
1.3 方法
1.3.1 玫瑰茄花色苷提取物的制备 将玫瑰茄在40 ℃下干燥,粉碎并过60 目筛。按料液比1∶35 加入60%乙醇溶液,用超声-微波协同萃取仪进行提取,超声功率350 W、微波功率280 W、提取温度50 ℃、提取时间18 min,然后将提取液进行抽滤、浓缩、真空冷冻干燥以获得玫瑰茄花色苷提取物。
1.3.2 玫瑰茄花色苷纯化物的制备 用AB-8 大孔树脂纯化玫瑰茄花色苷提取物[14],上样质量浓度3.0 mg·mL−1,上样流速2.0 mL·min−1,洗脱液pH 为3.0的80%乙醇,洗脱液流速4.0 mL·min−1,将洗脱液浓缩、真空冷冻干燥得玫瑰茄花色苷纯化物。
1.3.3 玫瑰茄花色苷微胶囊的制备 将麦芽糊精在60 ℃下用pH=3.0 的柠檬酸-柠檬酸钠缓冲液溶解,然后加入阿拉伯树胶粉,搅拌混合物直至其完全溶解,冷却至室温,得壁材溶液;将玫瑰茄花色苷纯化物加入壁材溶液中,充分混合,在40 ℃、40 MPa条件下高压均质3 次,所得混合液进行喷雾干燥,获得玫瑰茄花色苷微胶囊。
1.3.4 花色苷含量的测定
(1)微胶囊总花色苷含量的测定:总花色苷含量用pH 示差法测定[15]。用10 mL 纯水溶解0.3 g 玫瑰茄花色苷微胶囊,过滤,用pH 1.0 和pH 4.5 的缓冲液稀释,然后在520 nm和700 nm 处测量吸光度,并根据式(1)计算花色苷含量:
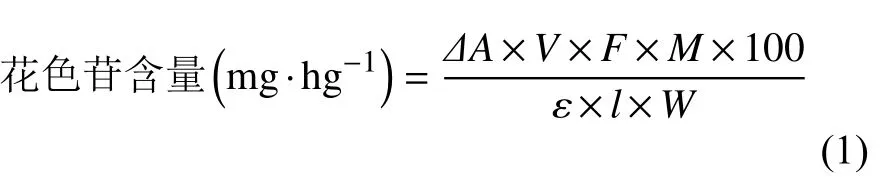
式中:V 为 体 积(mL),F为稀释倍数,M 为矢车菊素葡萄糖苷(Cyanidin-3-glucoside)的分子量(449.2 g·mol−1);ε 为摩尔消光系数[26900 L·(mol·cm)−1],l 为比色皿厚度(cm);W 为样品质量(g)。
(2)微胶囊表面花色苷含量的测定:微胶囊表面花色苷含量用pH 示差法[16]测定。将0.3 g 玫瑰茄花色苷微胶囊溶于10 mL 无水乙醇中,过滤,用pH 1.0和pH 4.5 的缓冲液稀释,然后在520 nm 和700 nm 处测量吸光度,并根据式(1)计算花色苷含量。
1.3.5 花色苷微胶囊包埋率的测定 花色苷微胶囊包埋率计算公式如下[17]:

1.3.6 玫瑰茄花色苷微胶囊的制备工艺优化
(1)单因素试验:由于阿拉伯树胶是一种增稠剂,料液稠度直接影响喷雾干燥过程,而麦芽糊精水溶性较高,因此本研究主要考察阿拉伯树胶对微胶囊化的影响。在进料流量50 mL·h−1、出风温度75℃、麦芽糊精占总固形物质量分数70%的条件下,以包埋率和水分含量为评价指标进行单因素试验,分别考察阿拉伯树胶占总固形物质量分数、花色苷占总固形物质量分数、总固形物质量分数(总固形物包括阿拉伯树胶、花色苷、麦芽糊精以及缓冲液中的柠檬酸-柠檬酸钠)和进风温度对玫瑰茄花色苷微胶囊化的影响。
(2)响应面试验:运用响应面法优化影响玫瑰茄花色苷微胶囊化的四个因素。响应面试验因素水平见表1。

表 1 响应面试验因素与水平Table 1 Factors and levels of response surface design
1.3.7 玫瑰茄花色苷微胶囊的形态观察 用扫描电镜观察玫瑰茄花色苷微胶囊的表面形态,扫描电压为5.0 kV。
1.3.8 玫瑰茄花色苷纯化物与微胶囊产品理化指标的测定
(1)水分含量的测定:分别将0.5 g 玫瑰茄花色苷纯化物和微胶囊粉末置于水分测定仪中,测定水分含量,每一样品进行3 次平行试验。
(2)堆密度的测定:分别称取2 g 的花色苷纯化物和微胶囊粉末,置于10 mL 量筒中,震实静置测量粉末体积,并根据式(3)计算堆密度:

式中:ρ为堆密度,g·mL−1;w为样品粉末的质量(g);v样品粉末的最终体积(mL)。
1.3.9 微胶囊玫瑰茄花色苷稳定性比较
(1)温度对微胶囊花色苷稳定性的影响:分别称取0.2 g 的微胶囊产品和纯化物,置于4、25、40 ℃的培养箱中20 d,每隔1 d 取样进行测定,用式(4)计算花色苷保留率。

式中:C表示某时刻样品中花色苷的含量(mg·g−1);C0表示样品中花色苷的初始含量(mg·g−1)。
(2)光照对微胶囊花色苷稳定性的影响:分别称取0.2 g 的微胶囊产品和纯化物于具塞瓶中,置于避光和光照(50 W 日光灯下静置)条件20 d,每隔1 d 取样进行测定,计算花色苷保留率见式(4)。
(3)金属离子对微胶囊花色苷稳定性的影响:分别称取0.2 g 的微胶囊产品和纯化物,分别加入含有0.05 mol·L−1Na+、K+、Zn2+、Cu2+的溶液中,摇匀,保存于室内避光处20 d,每隔1 d 取样进行测定,用式(4)计算花色苷保留率。
2 结果与分析
2.1 单因素试验结果
2.1.1 阿拉伯树胶占总固形物质量分数对微胶囊包埋率的影响 花色苷占总固形物质量分数5.0%,总固形物质量分数9.0%,进风温度180 ℃,考察阿拉伯树胶占总固形物质量分数对微胶囊包埋率和水分含量的影响,结果如图1 所示。可以看出,在1.0%~3.0%范围内,阿拉伯树胶有较好的乳化性和成膜性[18−19],包埋率随阿拉伯树胶占总固形物质量分数增加而增加;阿拉伯树胶占总固形物质量分数为3.0%时,包埋率最大,为97.20%;此后包埋率随阿拉伯树胶占总固形物质量分数增加而减小,这是由于阿拉伯胶含有较多的亲水基团,易与水分子结合,继续增加会导致物料黏度过大,从而对喷雾干燥过程产生影响,使包埋率降低[20]。阿拉伯树胶占总固形物质量分数为3.0%时有最大包埋率和较低含水量,因此本研究选取本点为零水平进行响应面优化。

图 1 阿拉伯树胶占总固形物质量分数对微胶囊包埋率的影响Fig. 1 Effect of mass fraction of gum Arabic in total solids on encapsulation
2.1.2 花色苷占总固形物质量分数对微胶囊包埋率的影响 阿拉伯树胶占总固形物质量分数3.0%,总固形物质量分数9.0%,进风温度180 ℃,考察花色苷占总固形物质量分数对微胶囊包埋率和水分含量的影响,结果如图2 所示。可以看出,花色苷占总固形物质量分数在1.0%时包埋率最低,这可能是由于芯材浓度过低,导致壁材比例过高,影响了壁材与芯材的充分接触,微胶囊包埋的有效成分会相对减少,导致包埋率低;花色苷占总固形物质量分数在1.0%~5.0%范围内,随着其质量分数的增加,包埋率迅速增加,且在5.0%时达到最大值,为97.20%;随着花色苷占总固形物质量分数继续增加,包埋率逐渐下降,这是因为当花色苷占总固形物质量分数超过壁材的包埋能力时,会导致花色苷包埋不完全,包埋效果变差。花色苷占总固形物质量分数为5.0%时有最大包埋率和较低含水量,因此本研究选取本点为零水平进行响应面优化。
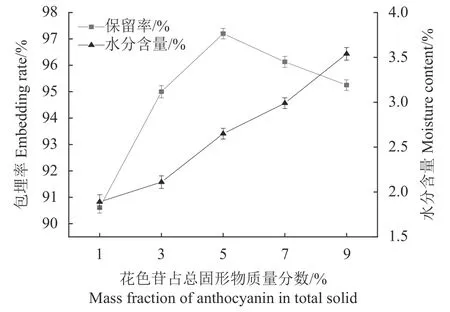
图 2 花色苷占总固形物质量分数对微胶囊包埋率的影响Fig. 2 Effect of mass fraction of anthocyanin in total solids on encapsulation
2.1.3 总固形物质量分数对微胶囊包埋率的影响 阿拉伯树胶占总固形物质量分数3.0%,花色苷占总固形物质量分数5.0%,进风温度180 ℃,考察总固形物质量分数对微胶囊包埋率的影响,结果如图3 所示。可以看出,总固形物质量分数在5.0%~9.0%范围内,总固形物质量分数增大,水分含量增大,物料黏度增大,有利于微胶囊成型,加强微胶囊壁的致密性从而提高包埋率;在总固形物质量分数9.0%时,包埋率达到最大值,为97.20%;此后随着总固形物质量分数持续增加,包埋率逐渐下降,这是由于总固形物质量分数过大,物料雾化难度加大,水分含量过高,物料黏度过大造成沾壁,从而使包埋率降低[21]。因此本研究选取总固形物质量分数为9.0%。

图 3 总固形物质量分数对微胶囊包埋率的影响Fig. 3 Effect of total solid content on encapsulation

图 4 进风温度对微胶囊包埋率的影响Fig. 4 Effect of spray-drying inlet-air temperature on encapsulation
2.1.4 进风温度对微胶囊包埋率的影响 阿拉伯树胶占总固形物质量分数3.0%,花色苷占总固形物质量分数5.0%,总固形物质量分数9.0%,考察进风温度对微胶囊包埋率和水分含量的影响,结果如图4所示。可以看出,进风温度为120 ℃时,水分含量最大,包埋率较低,这是由于温度较低干燥速度较慢,水分残留在微胶囊中使微胶囊强度低不能完全包埋芯材,且高水分含量在喷雾时容易沾壁,从而降低包埋率。温度升高,水分含量降低,包埋率增大,且在160 ℃时包埋率达到最大值,为97.22%。在160~200 ℃范围内,进风温度与包埋率呈负相关。这是由于进风温度过高,一方面会导致花色苷分解,另一方面会使水分散失过快,导致微胶囊出现裂痕、褶皱,从而影响包埋效果,使包埋率迅速下降[22−23]。一般喷雾干燥制备的微胶囊水分含量在1%~5%,Tao 等[24]以喷雾干燥法制备蓝毒花青素提取物微胶囊的研究中观察到具有相似的水分含量(4.05%~4.12%)。进风温度为160 ℃时有最大包埋率,水分含量为3.55%,可以保证粉末微生物安全,因此本研究选取本点为零水平进行响应面优化。
2.2 响应面试验结果
2.2.1 响应面试验方案及结果 响应面试验方案及结果见表2。
2.2.2 模型方程的建立与显著性试验 采用Design-Expert V8.0.6 软件进行数据分析,得出模拟方程:Y=96.88+0.40A+0.72B−0.52C+0.30D−0.42AB−0.21AC+0.64AD+0.29BC−0.45BD+0.96CD−0.66A2−0.37B2−0.53C2−0.73D2。回归方程抛物面开口向下,有极大值点,可以对玫瑰茄花色苷微胶囊制备的工艺条件进行优化[25]。回归模型方差分析结果如表3 所示。
由表3 可知,模型极显著(P<0.0001),且失拟项不显著(P=0.4521>0.05),表明该回归模型是理想的。决定系数R2=0.9080,这表明包埋率的测量值与预测值之间拟合良好。从影响包埋率的角度分析,一次项A、B和C对包埋率影响极显著,D对包埋率影响显著,顺序为B>C>A>D;二次项AD对包埋率有显著影响,CD对包埋率有极显著影响,交互项AB、AC、BC、BD对包埋率无显著影响。
2.2.3 因素间交互作用的响应面 对玫瑰茄花色苷微胶囊包埋率有交互作用的响应面见图5。由图5(c)可知,包埋率随着AD的增加都是逐渐增加然后趋于稳定的,等高线呈椭圆,表明AD交互作用显著。由图5(f)可知,包埋率随D的升高先增加后趋于平稳;包埋率与C呈负相关。等高线呈椭圆形且曲线较密,表明DC交互作用极显著。图5(a)、5(b)、5(d)和5(e)中等高线呈圆形且曲线稀疏,响应面的坡度较平缓,对应的两个因素之间交互作用不显著[26]。
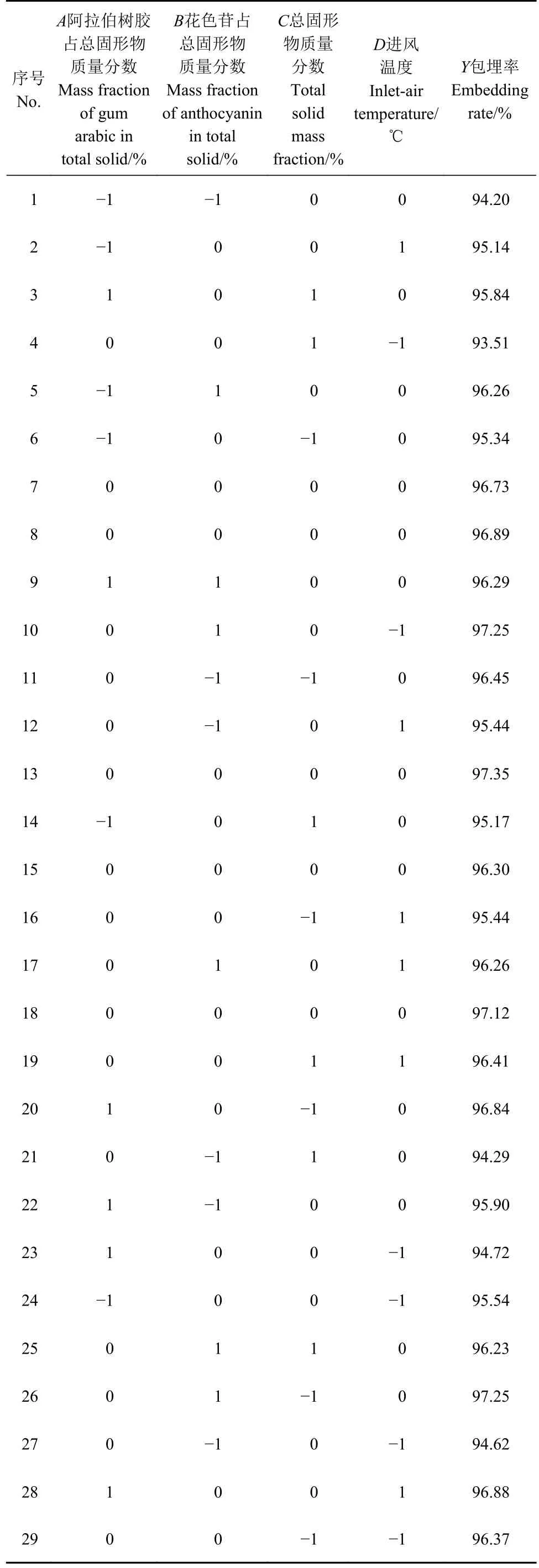
表 2 响应面试验结果Table 2 Results of response surface test
2.2.4 验证实验结果 用上述响应面分析软件得到玫瑰茄花色苷包埋最佳工艺条件为阿拉伯树胶占总固形物质量分数2.73%,花色苷占总固形物质量分数7.00%,总固形物质量分数7.17%,喷雾干燥进风温度143.39 ℃,优化得到包埋率理论值为97.40%。为了操作可行性,调整参数为阿拉伯树胶占总固形物质量分数3.0%,花色苷占总固形物质量分数7.0%,总固形物质量分数7.0%,喷雾干燥进风温度143 ℃,在此条件下进行了3 次验证实验,得到玫瑰茄花色苷的平均包埋率为97.11%,比理论预测值低0.29%,证明了该模型的有效性。

表 3 回归模型方差分析Table 3 Analysis of variance on regression model
2.3 玫瑰茄花色苷纯化物和微胶囊理化指标测定结果
玫瑰茄花色苷纯化物和微胶囊理化指标测定结果见表4。
2.4 玫瑰茄花色苷微胶囊的SEM 结果
在响应面优化的最优条件下制备得到的玫瑰茄花色苷微胶囊的形态观察结果见图6,图6 中(a)、(b)和(c)分别对应放大2.0 k、4.0 k 和8.0 k 倍的SEM 图。能够看出,喷雾干燥制备的玫瑰茄花色苷微胶囊呈圆球形,表面光滑,无明显裂痕。玫瑰茄花色苷微胶囊的囊壁较致密完整,说明芯材(玫瑰茄花色苷)已经被壁材完全包裹。由图6(a)和(b)可以看出,部分玫瑰茄花色苷微胶囊表面有褶皱,这可能是喷雾干燥过程中水分的疾速蒸发,微胶囊膨胀,由于快速失水导致壁材不均匀收缩的结果[27]。
2.5 微胶囊玫瑰茄花色苷稳定性比较分析
2.5.1 温度对微胶囊花色苷稳定性的影响 温度对微胶囊花色苷稳定性的影响结果见图7。由图7 可知,微胶囊花色苷和纯化物均在4 ℃条件下保留率最高。4 ℃保存20 d,纯化物和微胶囊花色苷保存率分别为84.64%、90.12%;25 ℃保存20 d,纯化物和微胶囊花色苷保存率分别为69.78%、77.93%;40 ℃保存20 d,纯化物和微胶囊花色苷保存率分别为57.50%、62.18%。说明在相同温度下,微胶囊花色苷的保留率高于纯化物,表明微胶囊化能有效提高花色苷的稳定性,与毛莹等[28]高温状态微胶囊化的花色苷的热稳定性更高的研究结果一致。

图 5 各因素交互作用对微胶囊包埋率影响的响应面图Fig. 5 Response surface contours showing interactions of various factors in microencapsulation
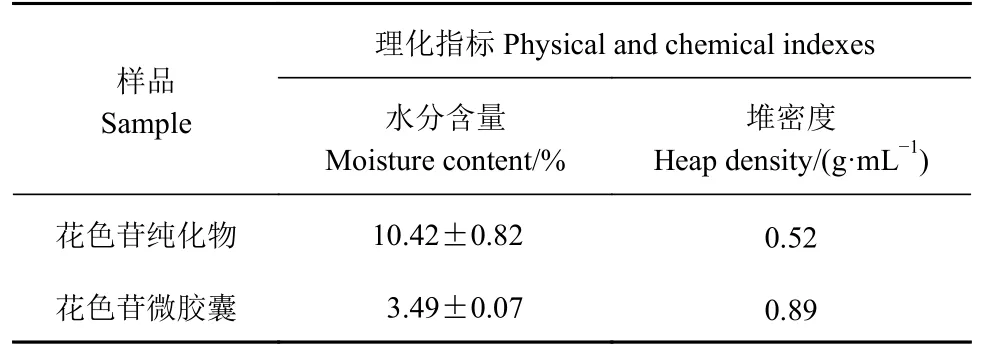
表 4 不同样品理化指标测定结果Table 4 Physiochemical properties of samples

图 6 玫瑰茄花色苷微胶囊的SEM 图Fig. 6 SEM micrograph of H. sabdariffa anthocyanin microcapsule
2.5.2 光照对微胶囊花色苷稳定性的影响 光照对微胶囊花色苷稳定性的影响结果见图8。随着保存时间的延长,避光条件下两种状态(纯化物和微胶囊)花色苷的保留率均高于光照条件,表明花色苷在避光条件下更易储藏。由图8(a)可知,光照条件保存20 d,纯化物和微胶囊花色苷保留率分别为69.69%和79.97%;由图8(b)可知,避光条件保存20 d,纯化物和微胶囊花色苷保留率分别为60.92%和69.51%。在光照和避光两种条件下微胶囊的保留率均明显高于纯化物,表明微胶囊化能有效提高花色苷的稳定性,与周亚杰等[29]微胶囊化避免了番茄红素与外界环境的直接接触从而提高光照稳定性的研究结果一致。
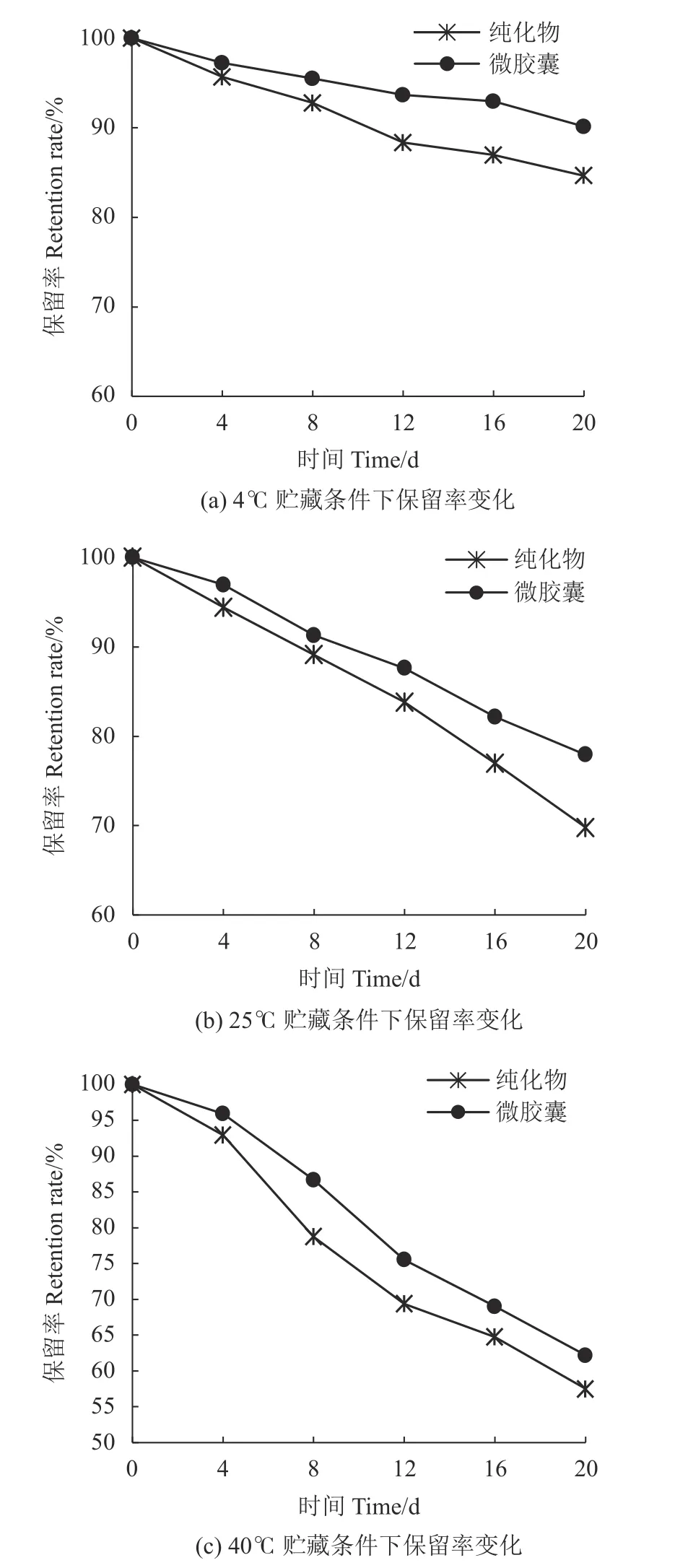
图 7 温度对微胶囊花色苷稳定性的影响Fig. 7 Effect of temperature on stability of anthocyanin microcapsules
2.5.3 金属离子对微胶囊花色苷稳定性的影响 金属离子对微胶囊花色苷稳定性的影响结果见图9。可以看出,Na+和K+对花色苷的稳定性影响较小;Cu2+和Zn2+对花色苷的稳定性有较大影响,使用时应尽量避免与Cu2+和Zn2+的接触。当有Cu2+作用时保存20 d,纯化物和微胶囊花色苷保留率分别为69.69%和79.97%;当有Zn2+作用时保存20 d,纯化物和微胶囊花色苷保留率分别为69.69%和79.97%。微胶囊化的保留率均明显高于纯化物,表明微胶囊化能有效提高花色苷的稳定性。

图 8 光照对微胶囊花色苷稳定性的影响Fig. 8 Effect of light on stability of anthocyanin microcapsules
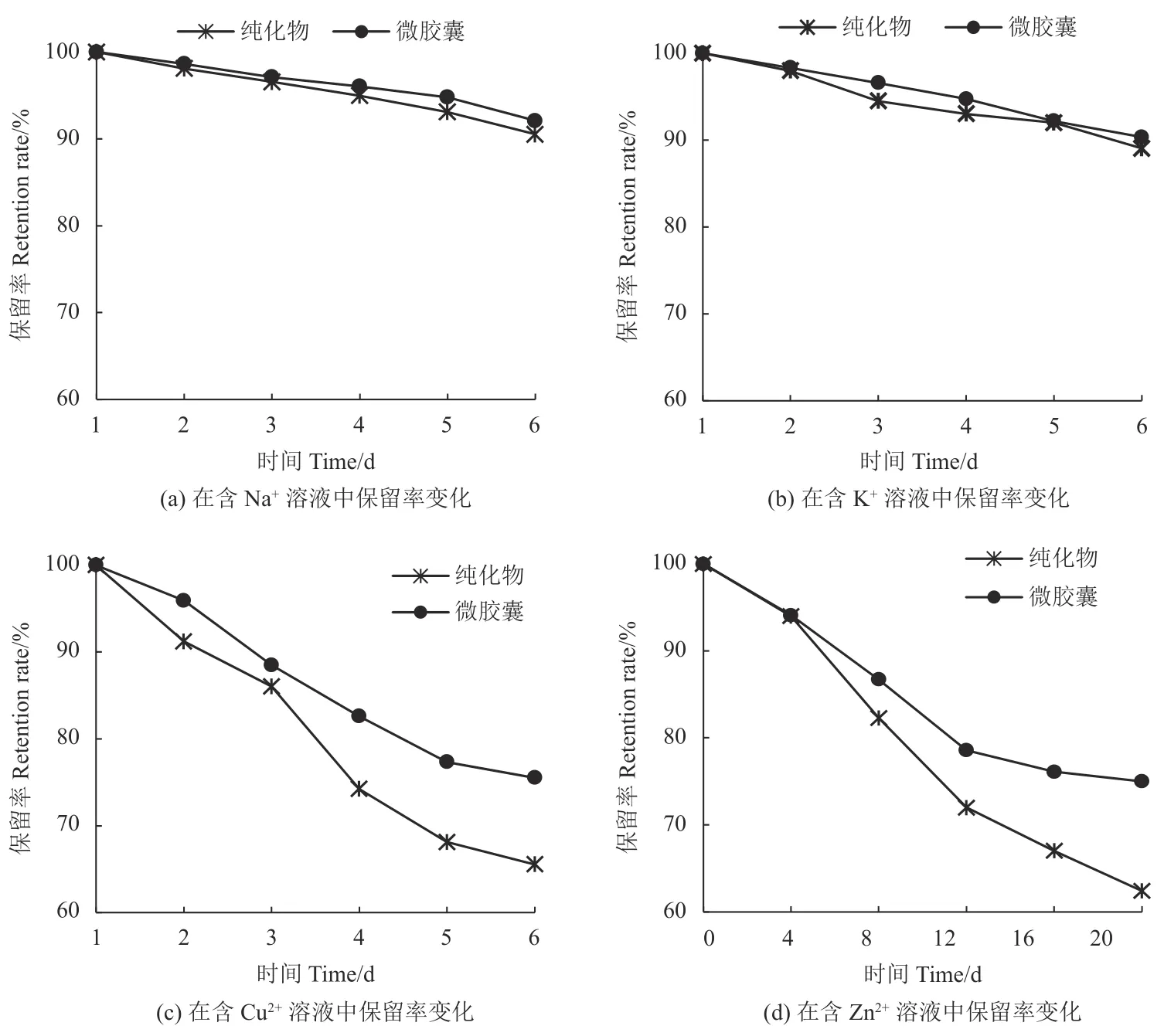
图 9 金属离子对微胶囊花色苷稳定性的影响Fig. 9 Effect of metal ions on stability of anthocyanin microcapsules
3 讨论与结论
研究玫瑰茄花色苷有利于玫瑰茄的开发利用,提高其综合利用价值。由于玫瑰茄花色苷含有大量不饱和键及易氧化官能团,其结构很容易遭到破坏,影响花色苷的生物活性。提高花色苷稳定性的方法有多种,其中微胶囊技术作为重点发展和推广应用的高新技术之一得到广泛应用,但目前利用微胶囊化提高玫瑰茄花色苷稳定性的相关研究报道较少。本研究以阿拉伯树胶和麦芽糊精为壁材,玫瑰茄花色苷为芯材,采用单因素试验和响应面法得到喷雾干燥法制备玫瑰茄花色苷微胶囊的最佳工艺条件:麦芽糊精占总固形物质量分数70%,阿拉伯树胶占总固形物质量分数3.0%,玫瑰茄花色苷占总固形物质量分数7.0%,总固形物质量分数7.0%,喷雾干燥进风温度143 ℃,此条件下玫瑰茄花色苷的包埋率为97.11%。喷雾干燥法制得的玫瑰茄花色苷微胶囊呈圆球形,表面较光滑致密、无裂痕,无孔洞。Kanakdande 等[30]利用喷雾干燥法对孜然油树脂进行微胶囊化,结果显示微胶囊呈微球形,壁面裂纹和孔洞较小,本研究与其研究结果一致。
由玫瑰茄花色苷微胶囊稳定性分析可知,温度对玫瑰茄花色苷的稳定性影响较大,温度升高会加速花色苷的降解,因此在储存、加工时要注意温度的控制。而在相同温度下,花色苷微胶囊的保留率均高于纯化物,这是因为微胶囊中壁材可以控制芯材的释放,使芯材免受外界因素影响,延长产品保存时间,可见微胶囊化能有效提高花色苷的稳定性。光照对玫瑰茄花色苷的稳定性具有一定的影响,在光照和避光条件下,与花色苷纯化物相比,花色苷微胶囊化后保留率变化趋势相对较平缓,这是由于囊壁起到了保护花色苷的作用。在金属离子对玫瑰茄花色苷的稳定性研究显示,Na+和K+对花色苷的稳定性影响较小,而Cu2+和Zn2+对花色苷稳定性影响较大,这可能是花色苷中的酚羟基结构与Cu2+、Zn2+发生反应生成沉淀,使其稳定性降低,因此应避免与这两种金属离子接触。玫瑰茄花色苷微胶囊化后再加入金属离子也发生了改变,但与未微胶囊化相比,变化趋势较小,可见微胶囊化后花色苷在金属离子环境中的稳定性得到明显改善。由以上分析得出,玫瑰茄花色苷微胶囊可有效提高玫瑰茄花色苷的稳定性。
