酸改性H2TiO3-锂吸附剂的制备及其性能研究
2021-04-17邹宇洲刘慧楠
邹宇洲,谢 瑜,刘慧楠,贡 洁,童 霏
江苏理工学院 化学与环境工程学院,江苏 常州 213001
锂作为二十一世纪“高能金属”,用途非常广泛,被广泛应用于电池制造、冶金、航空航天、电子通讯、军事制造、光电技术、玻璃陶瓷制造、生物、现代医学等领域[1].传统的提锂工艺根据锂的来源可分为两类,分别为固体矿石提锂以及水体提锂.海水和盐湖卤水中含有丰富的锂,由于固体提锂工艺复杂,且矿石中锂资源相对水体含量较低,从海水和盐湖卤水中提取锂已成为主流方式[2].在盐湖提锂工艺中,传统的沉淀、溶剂提取和盐化方法,不适合从低锂浓度的海水和盐湖卤水中提取锂,因此急需开发新的工艺.锂离子筛因其具有高选择性、结构稳定等显著特点,越来越受到研究者的关注.根据锂元素所存在的形式而不同,现主要分别从含有锂元素的矿石中提锂、盐湖提锂及海水提锂[3].吸附剂提锂,是当下最具发展前景的提锂方法.盐湖提锂中吸附剂主要分为层状吸附剂、锑酸盐吸附剂、铝基吸附剂和离子筛型吸附剂[4].研究表明,离子筛型吸附剂的优势最为明显.钛酸锂和Li4Ti5O12是常用的钛系吸附剂,合成方法主要有微波法、水解法、溶胶-凝胶法等.
分别以CH3COOLi和Ti(OC4H9)4为锂源和钛源,采用溶胶-凝胶法合成Li2TiO3,用盐酸处理制得H2TiO3-Li吸附剂.由溶胶凝胶法制得的H2TiO3-Li吸附剂对Li+具有优良的选择性,在反应进程中可有效的将Li+吸附.反应进程中将无机化合物与Li+复合生成复合氧化物,接着在不改变复合氧化物晶体结构的前提下将 Li+抽除,得到具有规则空隙结构的多孔材料,即为离子筛[5].该材料对目的离子具有记忆作用,在多种离子共存的情况下可将目的离子吸附从而达到分离效果.结果表明,盐酸处理过后,所有Li+皆可被提取,并且在煅烧温度为650 ℃时,锂离子从钛酸锂中的提取率可达67%.
1 实 验
1.1 试剂与仪器
试剂:醋酸锂(AR,江苏永丰化学试剂有限公司),乙醇(AR,江苏强盛功能化学股份有限公司),一水合氢氧化锂(AR,江苏强盛功能化学股份有限公司),盐酸(AR,江苏强盛功能化学股份有限公司),醋酸(AR,上海强顺化学试剂有限公司),钛酸四丁酯(AR,江苏强盛功能化学股份有限公司).
仪器:控温磁力搅拌器(HJ-3,常州国宇仪器制造有限公司),鼓风干燥箱(101型,常州国宇仪器制造有限公司),电子天平(FA2004N,上海菁海仪器有限公司),X射线衍射分析仪(XRD)((X’Pert Powder,荷兰帕纳克有限公司),大型电子显微镜(SEM)(S-3400N,日本日立有限公司),马弗炉(HF-Kejing,合肥科晶材料技术有限公司),循环水式多用真空泵(SHZ-DIII,上海争巧科学仪器有限公司).
1.2 实验方法
1.2.1 Li2TiO3的合成
采用溶胶-凝胶法合成Li2TiO3.将H2O和CH3CH2OH以1∶3的体积比混合均匀,称取CH3COOLi溶于H2O和CH3CH2OH的混合液中,控制CH3COOLi与H2O和CH3CH2OH的混合液固液比为66∶453.3,制得溶液A. 在无水乙醇和CH3COOH中加入Ti(OC4H9)4,φ(无水乙醇)∶φ(CH3COOH)∶φ(Ti(OC4H9)4)=173∶346∶100,缓慢搅拌,获得溶液B.在强磁搅拌时,通过调整Li-Ti摩尔比2∶1,将A缓慢添加到B中,然后连续搅拌1 h,在60 ℃水浴中处理混合液形成溶胶,之后在烘箱中80 ℃温度条件下干燥,将干燥的样品在马弗炉中煅烧2 h后得到Li2TiO3.
1.2.2 H2TiO3-Li的合成
用盐酸处理制得H2TiO3-Li吸附剂.用0.25 mol/L的盐酸,在70 ℃恒温条件下酸洗所合成的Li2TiO3,洗涤时间为8 h,Li2TiO3与盐酸用量分别为5 g和400 mL,然后通过过滤、洗涤、干燥(80 ℃,6 h),得到H2TiO3-Li吸附剂.
1.3 Li2TiO3性能表征
将干燥的样品在空气气氛中,分别在550,650和750 ℃的条件下在马弗炉中煅烧2 h,然后在炉膛内冷却,在室温下观察Li2TiO3.利用X射线衍射(XRD)及电感耦合等离子光谱仪,对不同温度下煅烧得到的Li2TiO3及过程产物进行表征检测;通过吸附实验,对锂离子筛的吸附性能及最佳煅烧温度进行了探究.
1.4 吸附剂性能研究
用H2TiO3-Li吸附剂从不同Li+浓度的LiOH溶液中吸附Li+,分别在LiOH浓度为0.5,1.0和4.0 g/L条件下,通过制得的吸附剂H2TiO3-Li,在室温下进行静态吸附.在此过程中,用NaOH调节LiOH溶液的pH值.在反应分别进行到1,2,4,8和24 h时取样,用移液枪吸取上层清液,稀释相应倍数后通过电感耦合等离子光谱仪检测溶液中剩余锂离子的含量.

分别以LiOH和LiCl用作锂源控制变量进行吸附,对比吸附容量,探究锂源对吸附容量及选择性的影响.
2 实验结果与讨论
2.1 产物的性能表征
2.1.1 Li2TiO3在不同温度下煅烧的XRD图谱
通过X射线衍射(XRD)、电感耦合等离子光谱仪(ICP)对Li2TiO3及其过程产物进行了表征检测.图1为通过溶胶凝胶法合成并在550,650和750 ℃下煅烧相同时间的Li2TiO3的X射线衍射图谱.
从图1可见:经550 ℃处理2 h后,产生了Li2TiO3晶相,此时衍射峰相对较低且较宽;当温度进一步提高到在650 ℃时,发现衍射峰明显增强,并且每个峰的衍射角向小的方向移动;当温度达到750 ℃时,衍射峰进一步增大.随着煅烧温度的提高,Li2TiO3的衍射峰变得越来越强和尖锐,表明结晶度的提高及晶粒尺寸的增大.这是因为随着煅烧温度的升高,锂在高温煅烧过程中会发生升华,导致锂、钛摩尔比逐渐降低,从而影响吸附剂吸附效率.因此,煅烧温度不宜过高.

图1 溶胶-凝胶法合成的不同温度下煅烧的XRD图谱Fig.1 XRD spectra calcined at different temperatures synthesized by sol-gel method
2.1.2 不同条件下Li2TiO3粉末的XRD图谱
传统的钛系吸附剂以二氧化钛和三氧化二锂为原料,通过常规的固态煅烧合成三氧化二锂,并在室温下用1.0 mol/L盐酸处理3天[6].结果显示,所有Li+皆可被提取.本实验使用0.25 mol/L的HCl,在70 ℃条件下酸洗8 h.图2为酸洗前、酸洗后和锂吸附后的Li2TiO3粉末的X衍射峰图谱.从图2可见,酸洗及反应期间Li2TiO3粉末发生的了变化.这是由于锂离子与二氧化钛结合,会形成(-133)晶面的基本结构[7].从图2还可以看出,酸洗后及吸附后的X衍射峰图谱基本没有变化,而(-133)的衍射峰在酸洗后急剧下降,表明Li2TiO3粉末中的大多数Li+已经被提取.

图2 酸洗前、酸洗后、吸附锂后下Li2TiO3粉末的XRD图谱Fig.2 XRD patterns of Li2TiO3 powder before pickling, after pickling and after lithium adsorption
通过溶胶-凝胶合成的Li2TiO3可以看作是在二氧化钛晶格中引入特定的目标离子Li+,并通过高温再结晶将Li+固定在晶格中,其中Li+处于离子键状态.吸附剂的制备可以看作是用盐酸从晶格中萃取出目标锂离子,伴随氢离子的进入,保证了溶液的电中性.当锂离子被提取之后,空缺的交换位点非常狭窄,且由于记忆效应,这些交换位点对Li+有特殊的选择性[8].对于其他离子,如若不具有相近的离子半径,以及相似的脱水能量,则不能占据这些位点.
众所周知,Li+容易与离子键结合,而H+通常形成共价化合物.因此,在酸洗过程中,随着Li+从晶格中被提取,H+同时进入,溶液维持电平衡.但H+不像原来的Li+以离子键的形式存在,此时H+以静电引力的方式存在[9].在吸附过程中,溶液中的Li+与吸附的H+交换,交换后的Li+的结合态与吸附的H+的结合态相同,一般为静电引力.此外,锂因萃取而留下的交换位置很难被吸附的锂完全占据.夹层中的Li+被赋予一定的自由度,导致Li+的无序排列,即原Li2TiO3中原子的周期排列被破坏.因此,吸附剂的晶体结构在吸附前后保持不变,并且不同于初始的Li2TiO3[10].对于Li2TiO3的第一次酸洗,由于化学键的破坏,该过程是不可逆的化学反应.然而,通过酸洗达到吸附平衡的吸附剂来再生吸附剂,可以被认为是一个可逆的过程,其中Li+与H+交换而不破坏任何化学键[11].除了离子交换之外,表面吸附也会发生.
2.1.3 不同温度下煅烧后Li+的提取率及吸附容量
图3及图4分别为溶胶-凝胶法合成的钛酸锂在不同温度下煅烧后锂的提取率和吸附容量.其中盐酸浓度为0.25 mol/L,温度为70 ℃,时间为8 h,固液比为5.0 g/400 mL;锂在氢氧化锂中的浓度为0.5 g/L,温度为25℃,固液比为2.0 g/100 mL.从图3可见,随着煅烧温度的升高,Li+的提取率先上升后下降,但上升不明显.从图4可见,在温度550~650 ℃时锂的吸附容量略微上升,650~750 ℃时呈现大幅度下降趋势.这是由于加热温度较低时,Li2TiO3的结晶度不高,这将导致酸洗过程中钛的溶解率较高,从而影响吸附剂吸附容量.而反应温度过高时,产物的结晶度高及粒径较大,不利于锂的提取.在650 ℃时,粒子的膨胀导致键长变长,键能变弱,有助于从Li2TiO3中提取锂离子.考虑到煅烧温度低、钛溶出率低、锂离子提取率高、吸附容量大等因素,确认650 ℃是最佳煅烧温度.在此温度下,锂离子从钛酸锂中的提取率可达67%.

图3 溶胶-凝胶法合成的钛酸锂在不同温度下煅烧后锂的提取率Fig.3 Extraction rate of lithium from calcined lithium titanate synthesized by sol-gel method at different temperatures

图4 钛酸锂吸附剂在不同温度下煅烧后的吸附容量Fig.4 Adsorption capacity of lithium titanate adsorbent calcined at different temperatures
2.2 吸附实验结果分析
将制得的H2TiO3-Li吸附剂从不同锂离子浓度的LiOH溶液中吸附Li+,用氢氧化钠调节吸附液pH,分别在LiOH浓度为0.5,1.0和4.0 g/L条件下,通过制得的H2TiO3-Li吸附剂在室温下进行静态吸附,分别在1,2,4,8和24 h时取样,用移液枪吸取上层清液.将所取得的清液稀释相应倍数,通过电感耦合等离子光谱仪检测溶液中剩余锂离子的含量.
为了便于使用电感耦合等离子体原子发射光谱仪进行测量,测量的原液分别稀释了50,20和100倍.表1和表2分别为吸附剂在不同浓度下LiOH的溶液中吸附剩余锂离子浓度及吸附剂吸附容量.由表2可知,当LiOH浓度为4.0 g/L时吸附量最高、吸附效率约达70%,而LiOH浓度为1.0 g/L时吸附效率其次,LiOH浓度为0.5 g/L时吸附效率最低.表明在一定浓度范围内,吸附剂吸附量与原液中锂离子浓度呈正相关.

表1 不同浓度LiOH溶液吸附实验测得的锂离子浓度
2.2.1 吸附浓度
图5通过溶胶-凝胶法制备的钛酸锂吸附剂在不同浓度的LiOH的溶液中锂离子浓度,其中吸附固液比为2 g/100 mL,从图5可见,不同浓度下吸附剂吸附速率曲线变化趋势基本一致,吸附较为迅速.反应在1 h内的吸附速率最高,吸附量可达到24 h吸附量的50%,在2~24 h时吸附效率逐渐趋于平缓,随着吸附时间的延长变化不大.

表2 不同浓度LiOH溶液吸附剂的吸附容量

图5 不同浓度LiOH溶液吸附实验中测得的锂离子浓度Fig.5 Lithium ion concentration measured in different concentration LiOH solution adsorption experiment
2.2.2 吸附容量
图6通过溶胶-凝胶法制备的钛酸锂吸附剂在不同浓度的LiOH的吸附容量.从图6可见:反应1 h内吸附容量速率最快,且与溶液浓度呈正相关;吸附时间为2~24 h时,吸附容量缓慢增加,增势逐渐趋于平缓;随着吸附时间的延长,吸附量也随之增加;当时间达到24 h时吸附容量最大,LiOH浓度为4.0 g/L时溶液的吸附量约为16.20 g/L,LiOH浓度为1.0 g/L时溶液的吸附量约为11.07 g/L,LiOH浓度为0.5 g/L时溶液的吸附量约为2.460 g/L.表明,该吸附剂的吸附容量随着溶液中Li+浓度的增加而呈显著增加,在一定浓度范围内适用于吸附离子浓度较高的环境.

图6 不同浓度LiOH溶液中吸附剂的吸附容量Fig.6 Adsorption capacity of adsorbent in different concentrations of LiOH solution
随着LiOH浓度的增加,一方面溶液中锂离子的浓度增加,这有助于锂离子在吸附剂表面的吸附.另一方面,当溶液中的Li+不断被吸附时,H+释放出来,酸碱度上升,碱性条件更有利于促进交换[12].上述因素说明,LiOH浓度对锂吸附剂吸附性能有显著影响.
2.2.3 吸附结果综合讨论
以溶胶-凝胶法制备的粉末为吸附剂前驱体,氢氧化锂为锂源,加入氢氧化钠调节溶液的pH值(pH≈13)[13],进行静态吸附.当达到吸附平衡时,测试溶液中Li+的浓度,并计算吸附容量,结果如表3所示.由表3可见,随着溶液中初始锂离子浓度的增加,在吸附平衡时残余锂离子的浓度及吸附剂吸附容量都呈现增加趋势.结果表明,锂离子浓度对吸附速率基本没有影响,在一定的pH值下对吸附容量有显著影响,锂离子浓度越高,吸附容量越大.

表3 不同浓度LiOH溶液中吸附结果
2.3 选择性吸附实验
表4为锂离子筛选择性吸附实验结果.由表4可以看出,对于恒定的锂离子水平和酸碱度来说,当LiOH和LiCl分别用作锂源进行吸附时,获得的吸附容量大致相等,这表明影响吸附容量的因素是液体中的锂离子浓度和酸碱度,而不是锂源.表明,该吸附剂具有选择吸附性特性.
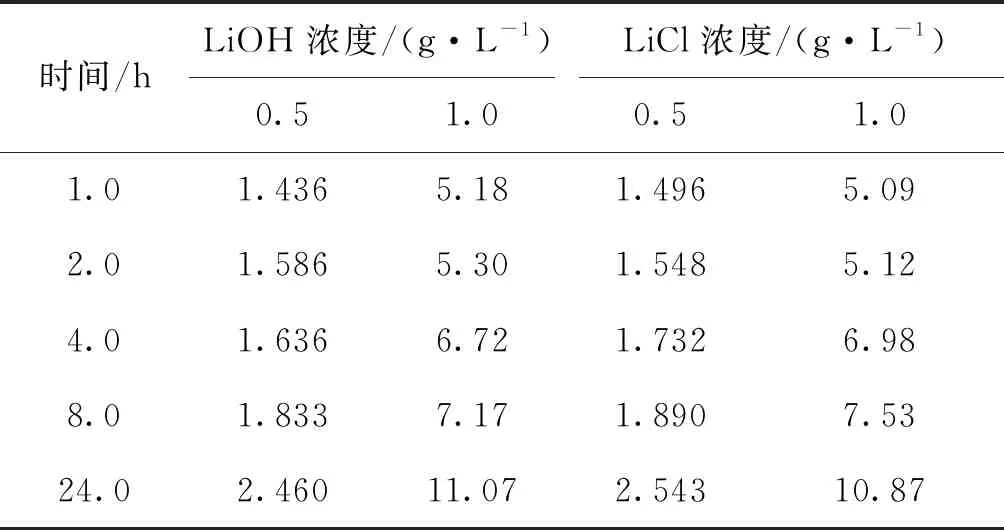
表4 锂离子筛选择性吸附实验结果
4 结 论
以CH3COOLi和Ti(OC4H9)4为锂和钛源,采用溶胶-凝胶法合成出Li2TiO3,然后用盐酸处理制得偏钛酸型吸附剂H2TiO3-Li.与传统的固相反应相比,在溶胶-凝胶的制备过程中,锂和钛的混合更加均匀.以氢氧化锂梯度浓度试液进行吸附,经酸洗、吸附、选择性吸附,对H2TiO3-Li性能进行研究.通过X射线衍射(XRD)、电感耦合等离子光谱仪(ICP)对其产物及过程产物进行表征检测.结果表明:650 ℃是最佳煅烧温度,在此温度下锂离子从钛酸锂中的提取率最佳;反应在1 h内的吸附速率最高,吸附量可达到24 h吸附量的50%,2~24 h内吸附效率逐渐趋于平缓,随着吸附时间的延长,吸附量也随之增加;在恒定的锂离子水平和酸碱度下,以不同的锂源进行吸附时,获得的吸附容量大致相等,表明该吸附剂具有选择吸附性特性;随着氢氧化锂浓度的增加,H2TiO3-Li吸附剂吸附能力显著增大.
通过溶胶凝胶法制备的H2TiO3-Li吸附剂,制备流程简单、可循环吸附、吸附容量高,具有良好的应用价值以及实际发展前景.但离子型吸附剂呈粉末状,具有流动性高、折损率高的特点,因此加强其物理强度成为了新的挑战.
