七叶一枝花中尿苷二磷酸糖基转移酶基因的筛选和分析
2021-04-16宋发军李妍清杨瑞霜孟艳艳
宋发军,李妍清,杨瑞霜,孟艳艳
(中南民族大学 生命科学学院&生物技术国家民委重点实验室&武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉 430074)
重楼皂苷是中药重楼(ParidisRhizoma)最主要的活性成分,具有抗菌、解蛇毒等多重功效.然而,重楼的野生植物资源濒临枯竭,且重楼属植物的种子休眠期长、人工繁育周期长[1-2],从而导致重楼皂苷的供需矛盾日益突出.因此,解析重楼皂苷生物合成途径中的关键基因,对实现人工合成重楼皂苷和保护野生重楼种质资源具有重要意义.
重楼皂苷主要包括薯蓣皂苷和偏诺皂苷两大类,其生物合成途径下游的关键酶类尚未被完全确认.研究表明,重楼皂苷合成的最后步骤中,薯蓣皂苷元被糖苷化生成各种薯蓣皂苷,或薯蓣皂苷元经过羟化生成偏诺皂苷元再苷化生成偏诺皂苷[3],而大多数重楼皂苷的糖苷化主要是由尿苷二磷酸糖基转移酶(UDP glucuronosyltransferase,UGT)负责催化的[3].因此,研究重楼中的UGTs有助于揭示重楼皂苷的合成机制.目前重楼中被鉴定和表征的UGTs数量还很少.基因组信息的欠缺和有限的转录组数据,阻碍了重楼皂苷生物合成途径中UGTs的研究.本课题组前期以中药重楼的正品药源植物七叶一枝花为研究对象,进行了全长转录组的测序工作.本研究在已有数据的基础上,利用隐马尔可夫模型筛选UGTs;同时提取七叶一枝花不同组织的RNA,通过qRT-PCR技术明确UGTs的表达特征,获得可能参与重楼皂苷生物合成的目标UGTs.
1 材料与方法
1.1 材料与处理
七叶一枝花根状茎、根、叶、花、茎及种子均采集于湖北省恩施土家族苗族自治州鹤峰县.根状茎等组织材料均采集于2019年5月,各组织材料迅速放于液氮中冷冻,随后保存于-80 ℃冰箱中超低温冻存备用.七叶一枝花种子采集于2019年10月,去种皮,洗净,晾晒干后保存于4 ℃冰箱.
1.2 七叶一枝花 UGTs 成员鉴定与注释
利用隐马尔可夫模型从七叶一枝花转录组数据中筛选出UGT基因.使用CDD(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线软件分析各个基因所编码蛋白的结构域.
1.3 七叶一枝花UGT蛋白理化性质分析
利用ProtParam(http://web.expasy.org/protparam/)分析七叶一枝花UGT蛋白的基本理化性质,如氨基酸数量、分子量及等电点等.
1.4 七叶一枝花 UGTs 进化关系及motif分析
使用MEGA5.0和Clustalx工具分析蛋白系统进化关系,并采用NJ法构建系统进化树;蛋白motif基序分析利用MEME软件(http://meme-suite.org/tools/meme)完成.
1.5 七叶一枝花UGT蛋白结构分析
通过 SWISS-MODLE(http://swissmodel.expasy.org/)方法在线对蛋白质进行三维立体结构进行预测,随后利用saves(http://servicesn.mbi.ucla.edu/SAVES/)对所得模型进行评估.
1.6 七叶一枝花各组织的RNA提取
叶、花、茎、种子用RNAprep Pure多糖多酚植物总RNA提取试剂盒提取RNA(北京天根生化);根状茎、根用CTAB法结合RNA纯化试剂盒(北京天根生化)提取RNA.所得RNA经超微量分光光度计(Nanophotometer N50 Touch,美国Thermo公司)测量浓度、琼脂糖凝胶电泳检测合格后于-80 ℃下保存备用.
1.7 七叶一枝花 UGTs 定量表达分析
UGT家族基因的引物合成由上海生工完成(表1).使用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(TaKaRa)试剂盒进行反转录获得cDNA,实时荧光定PCR仪为QuantStudio5(Applied Biosystems,美国).选用GAPDH为内参基因.

表1 七叶一枝花UGTs实时荧光定量分析引物
qRT-PCR的总反应体系为20 μL:2 μL cDNA,上、下游引物各0.5 μL,SYBR 10 μL,RNase-Free ddH2O补齐至20 μL;反应程序为:95 ℃ 预变性1 min,95 ℃变性15 s,54.5 ℃退火35 s,72 ℃ 延伸30 s,40个循环,重复3次.扩增后分析扩增曲线及熔解曲线,采用2-ΔΔCT法计算待测基因的相对表达量.
1.8 数据处理与分析
Microsoft Excel 2016及GraphPad Prism 8进行统计分析和图表绘制,结果以3次重复的平均值±标准差(SD)表示;MeV4.8.1绘制表达量聚类分析图谱.
2 结果与分析
2.1 七叶一枝花 UGTs 的筛选及motif分析
利用七叶一枝花的转录组数据库建立隐马尔可夫模型,筛选出属于糖基转移酶基因家族的序列,HMMER软件对其进行提取和分析,共获得54个UGT类似基因.CDD分析蛋白序列保守结构域,发现所获得的序列均含有UDPGT(UDP-glucoronosyl and UDP-glucosyltransferase)结构域,检查缺失并去除冗余序列,鉴定得到属于UGT家族的45个基因序列片段,分别将其命名为PpUGT01~ 45.
MEME对45个UGTs进行motif分析.除去部分较短序列外,有31条序列中含有糖基转移酶特征盒子PSPG box(putative secondary plant glycosyltransferase box)(图1),与植物典型的PSPG box(44个氨基酸)完全一致的氨基酸有32个.其中第5位谷氨酰胺、第9位亮氨酸、第11位组氨酸、第17位苯丙氨酸、第22位甘氨酸、第28位谷氨酸、第40位脯氨酸高度保守.
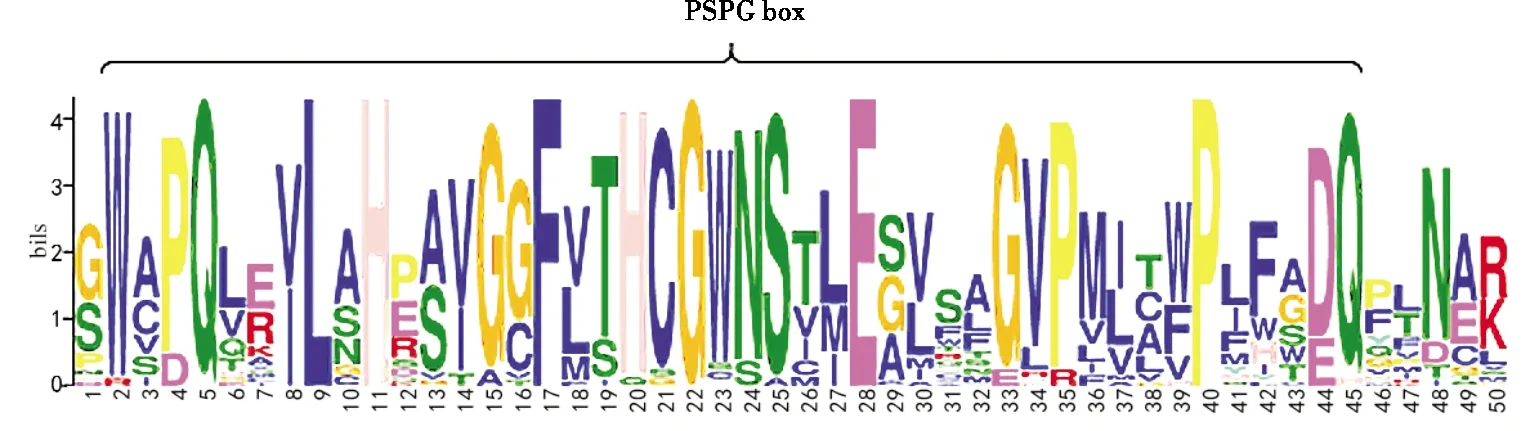
图1 45个UGT蛋白的氨基酸保守序列
2.2 七叶一枝花候选UGTs的理化性质分析
45个UGTs的cDNA全长在138~1437 bp之间(表2),编码的氨基酸长度在46~479之间,蛋白分子为4998.80~53406.59 D,理论等电点为4.36~11.12,其中有中性蛋白质1个(PpUGT40)、碱性蛋白质4个,分别为PpUGT13、PpUGT37、PpUGT41和PpUGT45,其他均属于酸性蛋白质.
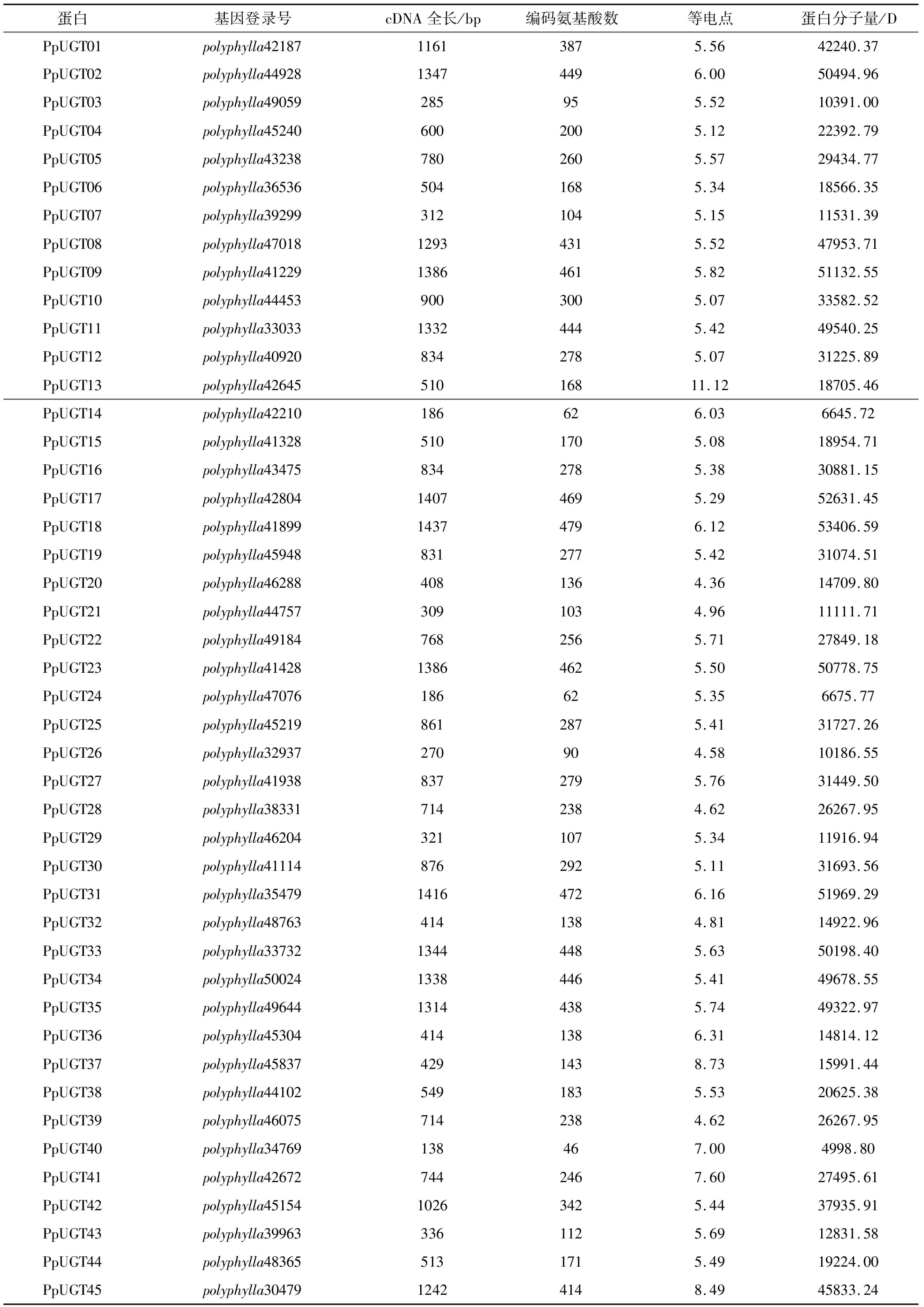
表2 45个UGTs的理化性质
2.3 糖基转移酶基因家族的进化分析
对所得的45个UGTs和拟南芥UGT家族中的119个、北柴胡1个(BcUGT10)、人参3个(PgUGT71A27、PgUGT74AE2和PgUGT94Q2)、三七3个(Pn00082、Pn02086和Pn13895)、王不留行1个(GvUGT74M1)及蒺藜苜蓿3个(MtUGT71G1、MtUGT73K1和MtUGT85H2)、刺茄1个(SaGT4A)、马铃薯1个(StSGT)共177个UGTs采用NJ法构建了系统发育树.依据序列聚类关系及氨基酸序列一致性≥40%的基因归为同一家族的分类原则[4],并参考拟南芥[5]、玉米[6]的UGT分组方式,将177个UGTs分为14个组.由图2可知,七叶一枝花中的45个PpUGTs中有15个分布在D组(UGT73家族)中;8个UGTs分布在A组;6个UGTs分布在K组;4个UGTs分布在L组;4个分布在G组;I组、E组、UGT81家族中分别有2个UGTs;UGT80家族中有1个UGT分布.45个基因主要分布在A、D、G、L、K组中,共有38条序列,占所有序列的84%,而B、C、N、F、H组中未见PpUGT的分布.
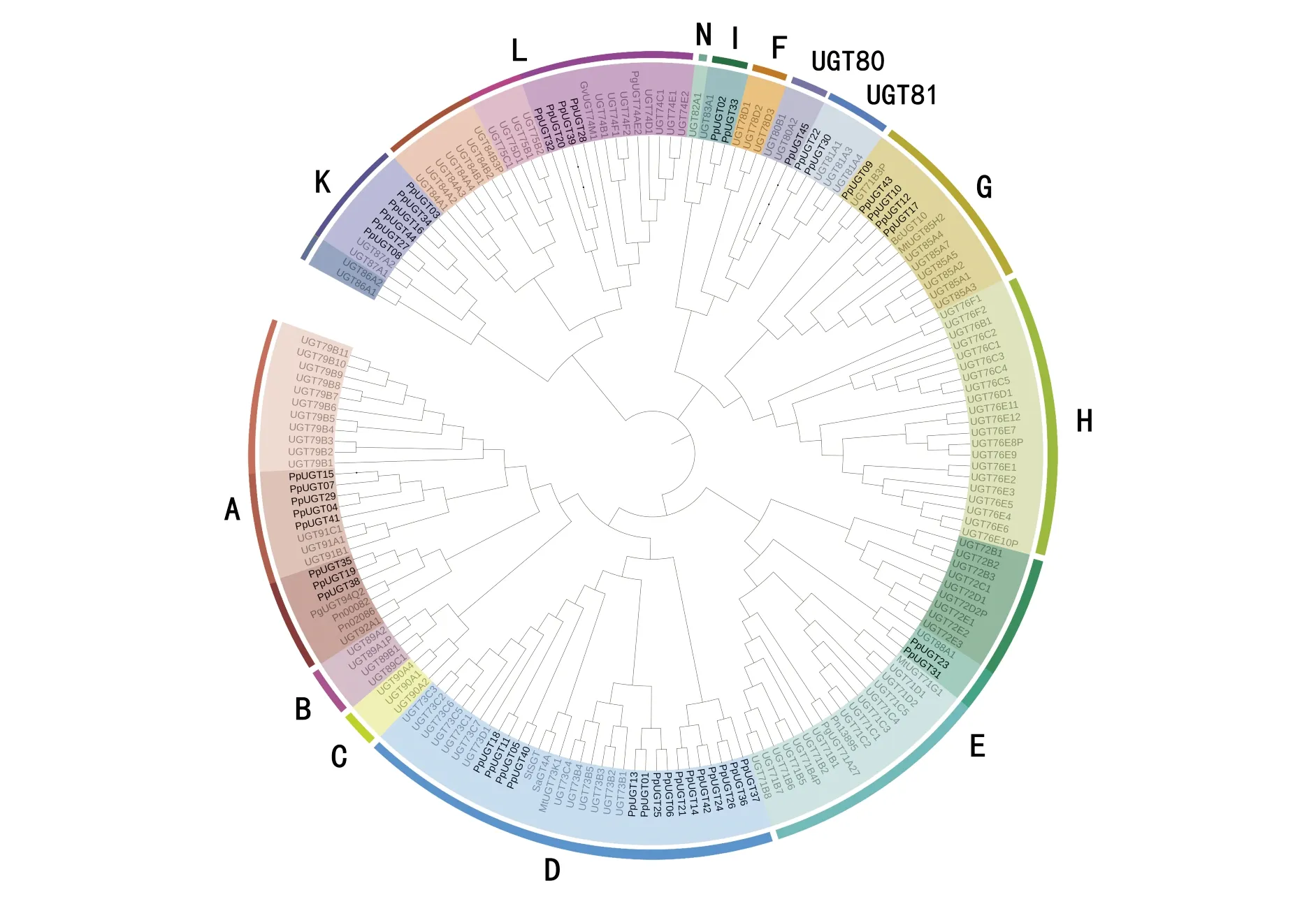
图2 七叶一枝花UGTs的进化树分析
2.4 七叶一枝花 UGTs 在各组织中的表达分析
为了进一步了解UGT家族不同基因的表达特征及其潜在的功能,对45个基因在不同组织中的表达情况也进行了分析(图3).
qRT-PCR分析结果表明,七叶一枝花中的45个UGTs的表达趋势主要分为6类:根状茎中表达量显著上调的UGTs有7个,其中有3个UGTs(PpUGT27、PpUGT30和PpUGT40)在根中表达量也较高;叶中表达量显著上调的UGTs共6个,其中PpUGT25在根中表达量也较高,而PpUGT36在花和茎中表达量也有上调;茎中表达量显著上调的UGTs有10个,其中5个UGTs(PpUGT33等)在叶中表达量也较高;种子中表达量显著上调的UGTs有5个;花中表达量显著上调的UGTs有4个;根中表达量显著上调的UGTs有13个,其中有5个UGTs(PpUGT06等)同时在茎中表达量较高,而PpUGT45花和茎中表达量均上调.
研究发现,包括UGTs在内的多个甾体皂苷合成相关基因在叶片和果实中的表达量较高,因此叶片可能是甾体皂苷类物质合成的主要器官[7].此外,D组和UGT80家族的基因被证明参与了皂苷的合成[8-9].因此,根据qRT-PCR结果,着重分析了在叶片中的表达量显著升高的D组和UGT80亚家族中的UGTs成员.同时考虑到工作量以及试验的准确性等问题,为了进一步锁定候选UGTs序列,重点关注序列长度不低于800 bp的UGTs.初步筛选出了PpUGT01、PpUGT11、PpUGT18、PpUGT42和PpUGT45 5个候选基因(图4).PpUGT01和PpUGT11在叶中表达量显著上调,且PpUGT11在根、花、茎中表达量也较高;PpUGT18基因在根、花和种子中表达量均较为显著,在叶和茎中表达量也较高;PpUGT42基因在茎中表达量显著上调,在花、叶中表达量较根状茎中也有所上调.此外,属于UGT80家族的PpUGT45在根、花、茎中表达量较高,叶和种子中也有表达.

图4 5个候选UGTs在不同组织中的表达量
2.5 七叶一枝花候选UGT的三维结构预测
采用SWISS-MODLE方法,对PpUGT01、PpUGT11、PpUGT18、PpUGT42和PpUGT45 5个候选基因的蛋白序列进行了三维空间结构的预测(图5).结果发现,上述5个蛋白质均为单分子的寡肽结构,没有配体,覆盖率分别为91%、91%、91%、93 %和97%,利用Saves对所得模型进行评估,Verify 3D均有超过80%的残基有大于0.2的3D/1D值,ERRAT评分均为A,whatcheck检测显示5个蛋白结构与正常结构差异较小,5个蛋白均有三项指标能通过评估,表明预测结果比较可靠.

图5 5个候选UGT蛋白的预测三维结构图
3 讨论
植物皂苷在结构上通常由一个或多个亲水性糖残基和疏水性类固醇或三萜类成分组成,糖残基是皂苷化合物亲水性能的决定因素[10-11].UGT可催化糖基残基装配皂苷元.UGT家族中的大多数成员在C末端有一个由44个氨基酸残基构成的PSPG box,该box是将次级代谢产物糖基化的植物UGT的标志性基序[12],它被认为是糖基转移酶识别、结合供体分子的位点[13].本研究筛选得到的45个UGTs中,31条UGTs均具有典型的植物UGT的PSPG box.这表明筛选出的序列符合UGT家族特征,可用于进一步的分析和研究.
文献表明有底物催化活性的UGT主要分布在A、D、E、G、H、L六组中[4,6,14].本研究中共有34条UGTs序列分布在上述6个组中,表明这些基因可能参与七叶一枝花中次级代谢产物的修饰及合成.此外,甾体皂苷的骨架形成分为两个阶段,即UGT催化C-26的糖基化和β-葡糖苷酶去除葡萄糖分子以封闭F环[7].人们发现,UGT73家族(即D组)中的基因可将糖分子连接到C-26的位置[8],在其他植物中关于UGT73家族成员的研究还有:蒺藜苜蓿UGT73K1参与三萜皂苷合成[15]、拟南芥UGT73C6参与类黄酮的糖基化[16].另外,UGT73家族的基因还参与了重楼皂苷主链的后期修饰[9].因此本研究中获得的聚类在UGT73家族中的4个基因(PpUGT01、PpUGT11、PpUGT18和PpUGT42),极有可能含有参与重楼皂苷合成的UGT成员.拟南芥中UGT80A2可催化胆甾醇与UDP-葡萄糖的结合[17],UGT80B1也具有甾醇葡糖基转移酶的活性[18],并且拟南芥UGT80家族参与甾醇糖苷和酰基甾醇糖苷的积累[18].更重要的是七叶一枝花中有UGT80家族成员已经被鉴定出,实验结果表明可能参与了甾体皂苷的生物合成[9].因此,本研究筛选出UGT80家族中的PpUGT45基因,或与重楼皂苷合成有密切关联.
皂苷生物合成的初始步骤可能发生在叶中,而皂苷的存储等后续步骤则发生在根部[19].本实验筛选出PpUGT01、PpUGT11、PpUGT18、PpUGT42和PpUGT45 5个候选基因.这5个候选基因存在于叶、花、茎等组织中,表达量分析表明均有所上调,推测可能与重楼皂苷自合成部位叶向储存部位根的输送有关.此外,对5个候选基因的蛋白质序列建模结果表明,所得模型均较可靠,这些结果为进一步研究UGT蛋白的结构与功能关系提供了理论依据,同时为后期UGT候选蛋白的分析及催化底物筛选奠定了基础.
