痴复康方改善PSCI 大鼠的空间学习和记忆能力及其作用机制
2021-04-16唐梁梁伟海陈志宁林国伟刘晓俊欧阳樱君
唐梁, 梁伟海, 陈志宁, 林国伟, 刘晓俊*, 欧阳樱君
(广州市第一人民医院 1 中医科, 2 神经内科, 广东 广州510180)
卒中后认知障碍 (PSCI) 是脑卒中的重要并发症, 发病率极高 (80.97%)[1-2], 对患者的自理能力及生存质量产生严重的影响。 著名中医脑病专家刘茂才教授研制出治疗PSCI 的痴复康方, 其临床疗效显著, 但作用机制尚未明确。 NR2B/CaMKⅡ信号通路广泛存在于脑神经元中, 促进神经突触的重塑、 学习、 记忆功能, HMGB-1、 TGF-β1/Smad 信号通路在PSCI 发病过程中诱导神经元的损伤和凋亡。 基于此, 本实验通过对48 只大鼠双侧颈总动脉结扎制作PSCI 模型, 观察痴复康方对大鼠的空间学习、 记忆能力的改善情况, 检测NR2B/CaMKⅡ信号通路及HMGB-1、 TGF-β1/Smad 信号通路以阐明其可能的作用机制, 现报道如下。
1 材料与方法
1.1 实验动物
SD 大鼠48 只, 雄性, 体重180 ~220 g, 由广东省医学实验动物中心提供 [许可证号: SCXK (粤) 2018-0002]。
1.2 造模
SD 大鼠分离出左右颈总动脉, 用止血钳夹住近心端颈总动脉, 用弯头镊排空远心端血管中的血液, 对双侧颈总动脉行两点结扎。
1.3 分组及给药方法
将48 只SD 大鼠随机分为正常组、 模型组、 尼莫地平组以及痴复康方低、 中、 高剂量组, 每组8 只。 正常组实施假手术, 其余均实施双侧颈总动脉结扎术。 低、 中、 高剂量组分别予以痴复康0.22 g·kg-1·d-1、 0.44 g·kg-1·d-1、 0.88 g·kg-1·d-1灌胃, 尼莫地平组予以尼莫地平1 mg·kg-1·d-1, 模型组、 正常组予以生理盐水10 mL·kg-1·d-1, 均为1 次/d, 连续30 d。
1.4 Morris 水迷宫实验测试大鼠的空间学习和记忆能力
1.4.1 获得性训练
将水迷宫装置水池分为4 个象限, 平台置于其中一个象限区的中央。 将大鼠头朝池壁放入水中, 记录动物找到水下平台的时间 (s), 连续训练5 d。
1.4.2 定向航行实验
第30 d 药后1 h, 将大鼠面向池壁放入水中, 入水顺序为Ⅲ象限→Ⅰ象限→Ⅳ象限→Ⅱ象限, 记录90 s 内大鼠登上平台并停留3 s 所用时间, 即逃避潜伏期 (s), 超过90 s 记为90 s。
1.4.3 空间探索实验
完成定向航行测试后, 立即撤去平台, 将大鼠从原平台象限对侧第Ⅰ象限面向池壁放入水中, 记录90 s 内大鼠穿越原平台次数 (次) 和原平台象限停留时间 (s)。
1.5 病理切片观察
各组大鼠取脑组织, 经过固定、 脱水、 包埋、 切片、 染色, 在显微镜下观察并拍照。
1.6 qPCR 法检测大鼠脑组织中NR2B、 CaMKⅡ、 HMGB-1、TGF-β1、 Smad7 mRNA 的表达量
根据Trizol 总RNA 提取试剂说明书提取总RNA, 测定浓度和纯度, 取500 ng 总RNA 用于cDNA 合成, 根据TaKaRa逆转录试剂盒合成cDNA 用于实时荧光定量PCR 反应, 检测mRNA 的表达情况。
1.7 统计学分析
采用SPSS 19.0 统计软件处理数据。 计量资料符合正态分布的, 以± s 表示, 采用单因素方差分析, 多重比较采用LSD 法,P <0.05 为差异有统计学意义。
2 结果
2.1 痴复康方对大鼠逃避潜伏期、 穿越原平台次数、 原平台象限停留时间的影响
与正常组相比, 模型组的逃避潜伏期延长, 穿越原平台次数减少, 原平台象限停留时间缩短, 差异有统计学意义 (P <0.01)。 与模型组相比, 低、 中、 高剂量组逃避潜伏时间均缩短, 原平台象限停留时间均延长, 差异有统计学意义 (P <0.01)。 与模型组相比, 中、 高剂量组穿越原平台次数均增加,差异有统计学意义 (P <0.01)。 见表1。
表1 痴复康方对大鼠逃避潜伏期、 穿越原平台次数和原平台象限停留时间的影响 ( ± s)

表1 痴复康方对大鼠逃避潜伏期、 穿越原平台次数和原平台象限停留时间的影响 ( ± s)
注: 与正常组比较, aP <0.01; 与模型组比较, bP <0.01。
组别 n 逃避潜伏期 (s) 穿越原平台次数(次)原平台象限停留时间 (s)高剂量组 8 43.89±7.56b 7.502±1.61b 25.79±9.17b中剂量组 8 52.49±10.13b 6.501±1.60b 24.05±7.67b低剂量组 8 62.27±9.32b 4.875±2.03 23.44±4.02b尼莫地平组 8 46.22±10.57 7.125±1.25 25.16±4.87模型组 8 68.63±14.43a 3.625±1.06a 10.15±3.90a正常组 8 51.67±9.80 8.250±1.49 26.88±3.43
2.2 病理切片观察
模型组大鼠海马神经元明显减少, 细胞排列松散, 不规则, 部分可见核仁消失、 锥体细胞减少; 痴复康方低、 中、 高剂量组随着剂量增加, 大鼠海马组织神经元细胞结构改善明显, 神经元增加, 坏死细胞明显减少, 细胞核固缩减少, 正常神经元增加, 细胞轮廓清晰, 排列整齐, 其中以高剂量组改善最明显。 见图1。

图1 病理改变HE 染色 (×100)
2.3 痴复康方对NR2B、 CaMKⅡ的影响
与正常组相比, 模型组的NR2B、 CaMKⅡ表达减少, 差异有统计学意义 (P <0.01); 与模型组相比, 低、 中、 高剂量组的NR2B、 CaMKⅡ表达均增加, 差异有统计学意义 (P <0.01)。见表2。
表2 痴复康方对NR2B、 CaMKⅡ的影响 ( ± s)

表2 痴复康方对NR2B、 CaMKⅡ的影响 ( ± s)
注: 与正常组比较, aP <0.01; 与模型组比较, bP <0.01; 与尼莫地平组比较, cP <0.01。
组别 n NR2B CaMKⅡ高剂量组 8 0.88±0.05b 0.95±0.16b中剂量组 8 0.42±0.03bc 0.72±0.05b低剂量组 8 0.44±0.05bc 0.60±0.07bc尼莫地平组 8 0.97±0.11 0.90±0.13模型组 8 0.16±0.01a 0.13±0.01a正常组 8 1.00±0.09 1.00±0.06
2.4 痴复康方对HMGB-1、 TGF-β1、 Smad7 的影响
与正常组相比, 模型组的HMGB-1、 TGF-β1、 Smad7 表达均增加, 差异有统计学意义 (P <0.01); 与模型组相比, 中、高剂量组的HMGB-1 表达均减少, 差异有统计学意义 (P <0.01); 与模型组相比, 低、 中、 高剂量组的TGF-β1、 Smad7表达均减少, 差异有统计学意义 (P <0.01)。 见表3。
表3 痴复康方对HMGB-1、 TGF-β1、 Smad7 的影响 ( ± s)
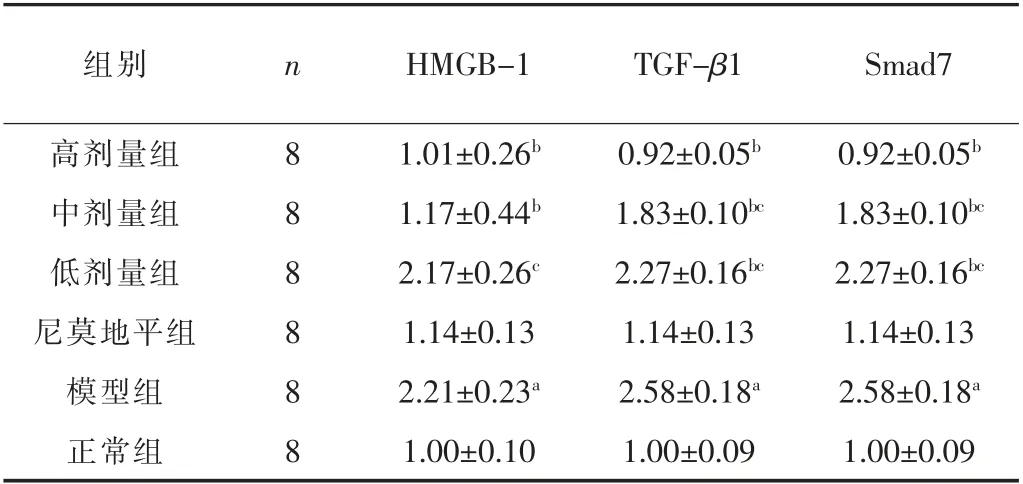
表3 痴复康方对HMGB-1、 TGF-β1、 Smad7 的影响 ( ± s)
注: 与正常组比较, aP <0.01; 与模型组比较, bP <0.01; 与尼莫地平组比较, cP <0.01。
组别 n HMGB-1 TGF-β1 Smad7高剂量组 8 1.01±0.26b 0.92±0.05b 0.92±0.05b中剂量组 8 1.17±0.44b 1.83±0.10bc 1.83±0.10bc低剂量组 8 2.17±0.26c 2.27±0.16bc 2.27±0.16bc尼莫地平组 8 1.14±0.13 1.14±0.13 1.14±0.13模型组 8 2.21±0.23a 2.58±0.18a 2.58±0.18a正常组 8 1.00±0.10 1.00±0.09 1.00±0.09
4 讨论
卒中后认知障碍 (PSCI) 的发病机制目前尚未完全明确,有相关研究[3]认为其可能与脑关键部位血管损害、 脑神经退行性病变、 脑部炎性反应及遗传有关。 N-甲基-D-天门冬氨酸(NMDA) 受体是一种分布在大脑海马和皮层的离子通道型谷氨酸受体, 通过调控突触可塑性和神经元突触长时程增强效应,在学习、 记忆方面起重要作用。 NR2B 作为NMDA 受体的重要功能亚基, 对于前额叶皮层神经元突触长时程增强效应的形成以及依赖前额叶皮层相关记忆的形成发挥重要作用[4]。 CaMKⅡ是大脑组织内的非脯氨酸依赖蛋白激酶, 是学习、 记忆的分子基础, 参与神经元突触长时程增强效应。 NR2B 被激活后,促进Ca2+内流激活CaMKⅡ, 刺激CaMKⅡ下游信号通路, 引起突触后膜致密区磷酸化, 促进神经元突触长时程增强效应, 促进NR2B 表达, 从而增强学习记忆能力[5]。 但NR2B 过度表达会引起神经元内Ca2+超载而损害神经元, 导致疾病发生[6]。NR2B/CaMKⅡ信号通路存在双向作用, 既能改善认知功能,也可损害认知功能, 所以调节NR2B/CaMKⅡ信号通路是治疗认知功能障碍的重要靶点。
炎性因子在认知功能障碍发病中也起到重要的作用。HMGB-1 是组织受到缺血缺氧等刺激后大量释放至细胞外的促炎性因子, 会加剧机体炎症[7-8]。 相关研究[9]表明, HMGB-1在血管性痴呆患者血清中高表达, 且与其严重程度呈正相关,与患者预后有明显相关性。 TGF-β1/Smad 信号通路参与血管性痴呆的发病机制[10]: TGF-β1 在海马等组织中表达, 与细胞膜受体结合, 使Smad 磷酸化, 调节靶向基因的表达, 其中Smad7 诱导细胞凋亡。
本实验结果表明, 痴复康方能够改善PSCI 大鼠的空间学习、 记忆能力, 其机制可能与减少海马神经元坏死, 上调海马组织NR2B、 CaMKⅡmRNA 表达, 下调HMGB-1、 TGF-β1、Smad7 mRNA 表达有关, 其治疗PSCI 的详细机制还有待进一步的研究。
