槐耳对人急性T淋巴细胞白血病CEM-C1细胞耐药性的逆转作用及机制
2021-04-15任丹薇龙思利覃祥牛亚娜钟芳芳刘静刘文君
任丹薇,龙思利,覃祥,牛亚娜,钟芳芳,刘静,刘文君
西南医科大学附属医院儿科血液肿瘤病区/四川省出生缺陷临床医学研究中心,四川泸州 646000
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是儿童最常见的恶性肿瘤,约占15岁以下儿童确诊总数的25%,且近年来ALL的发病率逐年升高[1-3]。文献报道,T细胞急性淋巴细胞白血病(T-ALL)的无事件生存率(event-free survival,EFS)明显低于B细胞急性淋巴细胞白血病(B-ALL),且T-ALL诱导失败、复发、早期死亡的风险高于B-ALL[4]。欧美国家T-ALL患儿的5年EFS(5-EFS)为65.7%~83.8%,我国为40.2%~66.0%,预后较差[5-6]。 耐药及复发是ALL治疗失败的主要原因,也是阻碍ALL患儿长期存活的瓶颈[7]。其中,糖皮质激素(glucocorticoid,GC)耐药是导致儿童ALL治疗失败的主要原因之一[8]。儿童ALL初治病例中,约有20%的患儿对GC产生原发性耐药;而复发病例中,GC耐药率高达70%[9-10]。因此,寻找ALL耐药相关基因并制定克服ALL耐药的方案,已成为ALL临床研究的热点。
槐耳清膏是槐耳菌质的初提物,其主要活性成分是由6种单糖与18种氨基酸结合形成的多糖蛋白,具有调节免疫、抗肿瘤、抗病毒等作用[11-14]。另有研究发现,槐耳可逆转多种肿瘤的耐药性[15-17], 但目前尚无槐耳逆转ALL耐药的相关报道。莫罗尼鼠白血病病毒前病毒整合位点(provirus integrating site moloney murine leukemia virus,Pim)家族基因包括Pim1、Pim2及Pim3,编码丝氨酸/苏氨酸激酶,可整合到细胞信号网络中,并调节多种细胞行为,如细胞增殖、存活及迁移等,与肿瘤的发生发展密切相关[18-19]。Pim3是新近发现且研究较少的一个Pim亚型,与胰腺癌等多种肿瘤耐药相关,可能参与了肿瘤耐药性的形成过程[20-21]。本研究以GC耐药细胞株CEM-C1及GC敏感细胞株CEM-C7为研究对象,探讨槐耳能否逆转ALL细胞对GC的耐药性及其可能机制,旨在探索改善ALL对GC耐药的新方法,为优化儿童ALL治疗方案及改善患儿预后提供新思路。
1 材料与方法
1.1 材料 人ALL细胞株CEM-C1、CEM-C7由四川大学华西第二医院马志贵教授馈赠。槐耳购自中国江苏启东盖天力药业有限公司;地塞米松(dexamethasone,DEX)购自国药集团容生制药有限公司;RPMI 1640培养液购自美国Hyclone公司;胎牛血清购自中国杭州四季青公司;二甲基亚砜(DMSO)购自美国Sigma公司;青霉素及链霉素双抗、总RNA提取试剂盒、CCK-8及辣根过氧化物酶标记山羊抗兔二抗购自上海碧云天公司;反转录试剂盒及实时荧光定量聚合酶链反应(qRT-PCR)试剂盒购自日本ToYoBo公司;GAPDH、Pim3引物购自上海生工生物工程股份有限公司;FITC Annexin V Apoptosis Detection Kit Ⅰ细胞凋亡检测试剂盒购自美国BD公司;细胞周期检测试剂盒购自南京凯基生物科技有限公司;兔抗人GAPDH一抗购自美国Proteintech公司;兔抗人多药耐药基因1(MDR1)、Pim3单克隆抗体一抗购自英国CST公司。
1.2 实验方法
1.2.1 细胞培养及分组 将CEM-C1、CEM-C7细胞悬浮于含10%胎牛血清、100 U/ml青霉素及0.1 mg/ml链霉素双抗的完全培养基中,并接种于培养瓶,置于37 ℃、含5%CO2、饱和湿度的培养箱中连续培养,每2 d更换1次培养液并传代,取对数生长期的细胞进行后续实验。CEM-C1、CEM-C7细胞经不同浓度(0、100、200、400、600、800 μg/ml) 槐耳处理24、48、72 h后,根据CCK-8实验确定48 h为干预时间,200、600 μg/ml槐耳为后续实验的干预浓度,100 μg/ml槐耳作为联合用药浓度与不同浓度(12.5、25、50、100、200 μg/ml)DEX联合作用于CEM-C1细胞。
1.2.2 CCK-8检测细胞的增殖抑制率 收集对数生长期的CEM-C1、CEM-C7细胞,调整细胞密度为2×105个/ml,转移90 μl细胞悬液至96孔板中,每孔加入10 μl预设浓度的各组药物,使槐耳终浓度为50、100、200、400、600、800 μg/ml,DEX终浓度为12.5、25、50、100、200 μg/ml,以及100 μg/ml槐耳联合不同浓度(12.5、25、50、100、200 μg/ml)DEX,同时设置对照组(仅含培养基及细胞)及空白组(仅含培养基),每组设4个复孔,放入CO2培养箱内培养24、48、72 h后,每孔再加10 μl CCK-8溶液,放入CO2培养箱内孵育4 h,用酶标仪在450 nm处测定各孔的光密度(OD)值。实验独立重复4次。细胞增殖抑制率(%)=1-[(OD实验组-OD药物对照)/(OD对照组- OD空白组)]×100%。采用GraphPad Prism7软件计算半数抑制浓度(IC50)。耐药逆转倍数=耐药株的IC50/加药处理耐药株的IC50。两药相互作用指数(coefficient of drug interaction,CDI)=AB/(A×B),其中AB为OD联合组/OD对照组,A、B分别为两种药物的OD单药组/OD对照组。若CDI<1,两药为协同作用,值越小协同作用越强;CDI=1,两药为相加作用;CDI>1,两药为拮抗作用,值越大拮抗作用越强[22]。
1.2.3 流式细胞术检测细胞凋亡情况 取对数生长期的CEM-C1、CEM-C7细胞,经不同浓度(0、200、600 μg/ml)槐耳处理48 h后,用冷PBS洗涤2次,加入1×结合缓冲液重悬细胞,调整细胞密度为3×106个/ml,取100 μl细胞悬液于5 ml Falcon试管中,加入5 μl FITC Annexin V及5 μl PI,室温避光染色15 min,然后加入300 μl结合缓冲液混匀,在1 h内用流式细胞仪检测细胞凋亡率。实验独立重复3次。
1.2.4 流式细胞术检测细胞周期 取对数生长期的CEM-C1、CEM-C7细胞,经不同浓度(0、200、600 μg/ml)槐耳处理48 h后,用冷PBS洗2次,调整细胞密度为1×106个/ml,取1 ml单细胞悬液,弃上清,用70%的冷乙醇500 μl悬浮细胞,4 ℃过夜固定;PBS洗涤后加入500 μl预先配制的PI/RNase A工作液混匀,室温、避光放置30~60 min,流式细胞仪检测488 nm波长处的红色荧光。实验独立重复3次。
1.2.5 Western blotting检测细胞MDR1、Pim3蛋白的表达水平 收集细胞,设置CEM-C1、CEM-C7细胞组及C E M-C 1 细胞经不同浓度(0、2 0 0、600 μg/ml)槐耳处理组,按照全蛋白提取试剂盒说明书提取细胞全蛋白。BCA法测蛋白浓度,根据蛋白浓度取等量蛋白,加5×SDS上样缓冲液煮沸5 min,进行SDS-PAGE电泳后将蛋白转移到PVDF膜上,用含5%脱脂奶粉的PBST封闭1 h,经PBST充分洗涤10 min×3次,MDR1、Pim3单克隆抗体均按1:1000稀释。4 ℃孵育过夜,充分洗涤后加山羊抗兔二抗,按1:2000稀释,室温孵育1 h,化学发光显影。采用Image J软件分析图像,以MDR1、Pim3蛋白条带灰度值与GAPDH蛋白条带灰度值的比值表示目的蛋白的相对表达水平。实验独立重复3次。
1.2.6 qRT-PCR检测细胞中Pim3 mRNA的表达水平 收集细胞,设置CEM-C1、CEM-C7细胞组及CEM-C1细胞经不同浓度(0、200、600 μg/ml) 槐耳处理组,用总RNA提取试剂盒提取总RNA,反转录为cDNA,荧光定量PCR法扩增目的基因及内参基因GAPDH。Pim3引物:正向5'-ACCGACTT CGACGGCAC-3',反向5'-TATCGTAGAGAAGCACG CCC-3';GAPDH引物:正向5'-ATGCTGGCGCT GAGTACGTC-3',反向5'-GGTCATGAGTCCTTCCA CGATA-3'。qRT-PCR反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火10 s,72 ℃延伸30 s,共40个循环。采用公式2-ΔΔCt计算目的基因mRNA的相对表达水平。均设3个复孔,实验独立重复3次。
1.3 统计学处理 采用SPSS 20.0软件进行统计分析。计量资料以±s表示,两样本比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 槐耳对ALL细胞增殖的影响 CCK-8检测结果显示,用槐耳对CEM-C1及CEM-C7细胞处理24 h及72 h,100、200、400、600、800 μg/ml槐耳组的增殖抑制率明显高于50 μg/ml槐耳组;槐耳处理48 h,细胞增殖抑制率呈剂量依赖方式增加,差异有统计学意义(P<0.05,图1)。根据结果选用200、600 μg/ml槐耳作为本实验的干预浓度,100 μg/ml 槐耳作为联合用药浓度。槐耳处理CE M-C 1 及CEM-C7细胞24、48、72 h后,CEM-C1细胞的IC50分别为2272.0、313.4、1275.0 μg/ml,CEM-C7细胞的IC50分别为1406.0、757.5、1653.0 μg/ml,表明槐耳处理48 h对CEM-C1及CEM-C7细胞增殖的抑制作用最强,因此后续实验选择48 h作为干预时间。
2.2 槐耳对CEM-C1细胞耐药性的逆转作用 CCK-8检测结果显示,不同浓度(12.5、25、50、100、200 μg/ml)DEX单独作用于两种细胞48 h后,CEM-C1细胞的IC50为98.89 μg/ml,CEM-C7细胞的IC50为0.16 μg/ml,依据公式计算CEM-C1细胞的耐药倍数是CEM-C7细胞的618.06倍,符合两种细胞的特性。槐耳(100 μg/ml)+DEX处理CEM-C1细胞后的IC50为73.75 μg/ml,耐药逆转倍数为1.34倍,差异有统计学意义(P<0.05);而联合用药对CEM-C7细胞无明显影响。与单用DEX各组比较,100 μg/ml 槐耳联合低浓度(12.5、25、50 μg/ml)DEX提高了CEM-C1细胞的增殖抑制率,差异有统计学意义(P<0.05,表1);各浓度DEX联用槐耳的CDI均<1,表明两药具有协同作用。
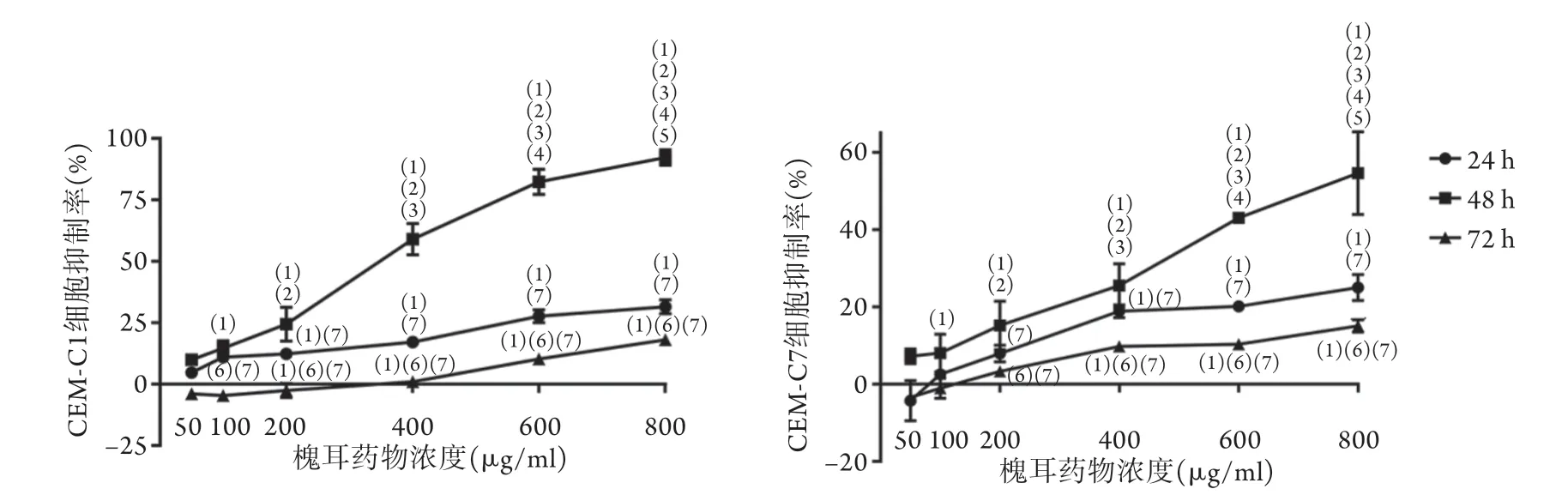
图1 槐耳对CEM-C1及CEM-C7细胞增殖的影响(n=4)Fig.1 Effect of Huaier on the proliferation of CEM-C1 and CEM-C7 cells (n=4)
2.3 槐耳对CEM-C1、CEM-C7细胞凋亡的影响 流式细胞术检测结果显示,随着槐耳浓度的增加,CEM-C1及CEM-C7细胞的凋亡率逐渐增高,与对照组(0 μg/ml槐耳)比较差异有统计学意义(P<0.05,表2)。
表1 DEX+槐耳对CEM-C1细胞增殖抑制率的影响(±s,n=4)Tab.1 Effect of DEX+Huaier on the inhibition ratio to CEM-C1 cells proliferation (±s, n=4)
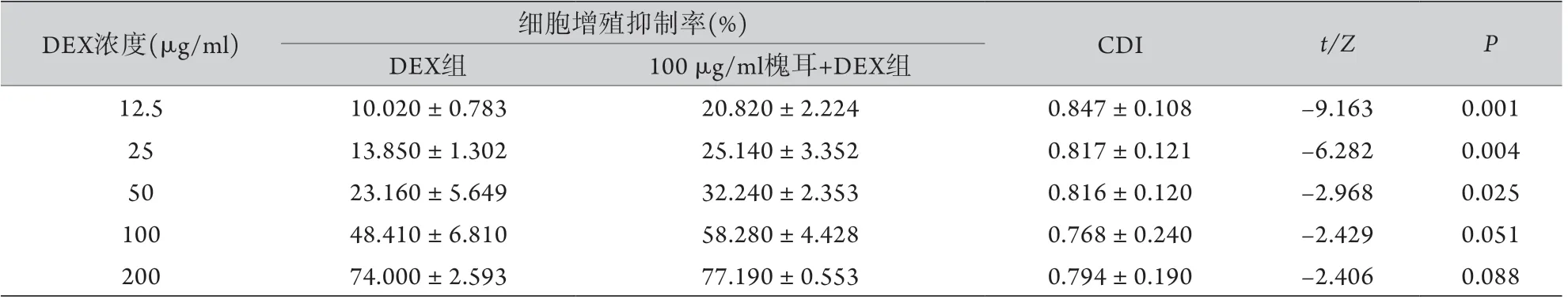
表1 DEX+槐耳对CEM-C1细胞增殖抑制率的影响(±s,n=4)Tab.1 Effect of DEX+Huaier on the inhibition ratio to CEM-C1 cells proliferation (±s, n=4)
CDI. 两药相互作用指数
DEX浓度(μg/ml) 细胞增殖抑制率(%) CDI t/Z P DEX组 100 μg/ml槐耳+DEX组12.5 10.020±0.783 20.820±2.224 0.847±0.108 -9.163 0.001 25 13.850±1.302 25.140±3.352 0.817±0.121 -6.282 0.004 50 23.160±5.649 32.240±2.353 0.816±0.120 -2.968 0.025 100 48.410±6.810 58.280±4.428 0.768±0.240 -2.429 0.051 200 74.000±2.593 77.190±0.553 0.794±0.190 -2.406 0.088
表2 不同浓度槐耳对CEM-C1及CEM-C7细胞凋亡率的影响(%,±s,n=3)Tab.2 Effect of different concentrations of Huaier on the apoptosis of CEM-C1 and CEM-C7 cells (%,±s, n=3)
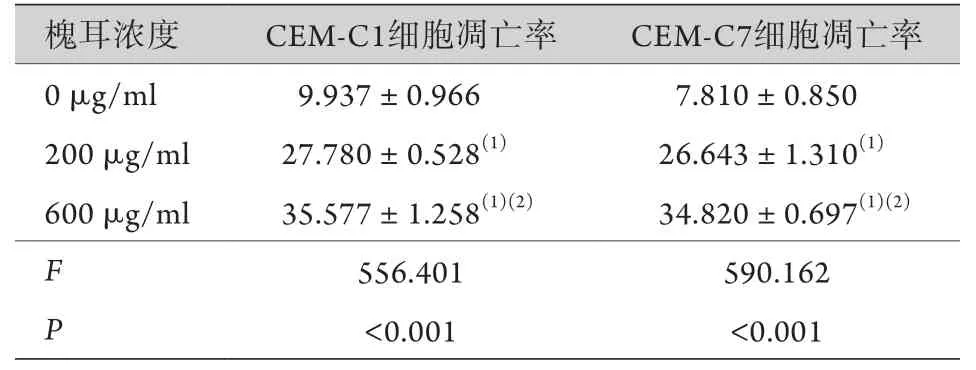
表2 不同浓度槐耳对CEM-C1及CEM-C7细胞凋亡率的影响(%,±s,n=3)Tab.2 Effect of different concentrations of Huaier on the apoptosis of CEM-C1 and CEM-C7 cells (%,±s, n=3)
与0 μg/ml槐耳组比较,(1)P<0.05;与200 μg/ml槐耳组比较,(2)P<0.05。
槐耳浓度 CEM-C1细胞凋亡率 CEM-C7细胞凋亡率0 μg/ml 9.937±0.966 7.810±0.850 200 μg/ml 27.780±0.528(1) 26.643±1.310(1)600 μg/ml 35.577±1.258(1)(2) 34.820±0.697(1)(2)F 556.401 590.162 P<0.001 <0.001
2.4 不同浓度槐耳对CEM-C1细胞周期的影响 流式细胞术检测结果显示,200、600 μg/ml槐耳处理CEM-C1、CEM-C7细胞48 h后,S期细胞比例比对照组增高,G0/G1期细胞比例比对照组降低,差异有统计学意义(P<0.05),各组细胞的G2/M期比例差异无统计学意义(P>0.05,表3)。
2.5 CEM-C1、CEM-C7细胞中及槐耳处理后CEM-C1细胞中MDR1、Pim3蛋白表达水平比较 Western blotting检测结果显示,CEM-C1细胞中MDR1蛋白表达水平(2.41±0.32)明显高于CEM-C7细胞(1.34±0.43),差异有统计学意义(t=3.45,P<0.05,图2A)。CEM-C1细胞经200、600 μg/ml槐耳处理后,MDR1蛋白表达水平均低于0 μg/ml槐耳组(1.62±0.03、1.34±0.16 vs. 1.92±0.10),差异有统计学意义(P<0.05,图2B)。CEM-C7细胞中Pim3蛋白表达水平(0.13±0.05)明显低于低于CEM-C1细胞(0.39±0.10),差异有统计学意义(t=3.94,P<0.05,图2C)。CEM-C1细胞经200、600 μg/ml槐耳处理后,Pim3蛋白表达水平均低于0 μg/ml槐耳组(1.05±0.14、0.75±0.13 vs. 1.48±0.33),差异有统计学意义(P<0.05,图2D)。
2.6 CEM-C1、CEM-C7细胞中及槐耳处理后CEM-C1细胞中Pim3 mRNA表达水平的比较 qRTPCR结果显示,CEM-C7细胞的Pim3 mRNA相对表达水平低于CEM-C1细胞(0.37±0.02 vs. 1.00),差异有统计学意义(t=58.88,P<0.05,图3A);与0 μg/ml槐耳组(1.00)比较,200、600 μg/ml槐耳组CEM-C1细胞中Pim3 mRNA的表达水平均明显降低(分别为0.79±0.12、0.59±0.10),且600 μg/ml槐耳组明显低于200 μg/ml槐耳组,差异有统计学意义(P<0.05,图3B)。
表3 不同浓度槐耳对CEM-C1及CEM-C7细胞周期的影响(%,±s,n=3)Tab.3 Effects of different concentrations of Huaier on the cell cycle of CEM-C1 and CEM-C7 cells (%,±s, n=3)
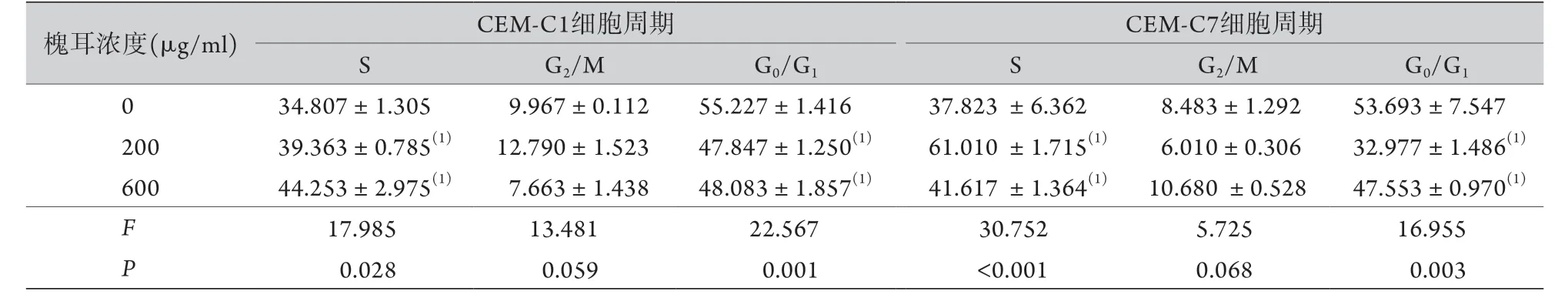
表3 不同浓度槐耳对CEM-C1及CEM-C7细胞周期的影响(%,±s,n=3)Tab.3 Effects of different concentrations of Huaier on the cell cycle of CEM-C1 and CEM-C7 cells (%,±s, n=3)
与0 μg/ml槐耳组比较,(1)P<0.05。
槐耳浓度(μg/ml) CEM-C1细胞周期 CEM-C7细胞周期S G2/M G0/G1 S G2/M G0/G1 0 34.807±1.305 9.967±0.112 55.227±1.416 37.823 ±6.362 8.483±1.292 53.693±7.547 200 39.363±0.785(1) 12.790±1.523 47.847±1.250(1) 61.010 ±1.715(1) 6.010±0.306 32.977±1.486(1)600 44.253±2.975(1) 7.663±1.438 48.083±1.857(1) 41.617 ±1.364(1) 10.680 ±0.528 47.553±0.970(1)F 17.985 13.481 22.567 30.752 5.725 16.955 P 0.028 0.059 0.001 <0.001 0.068 0.003
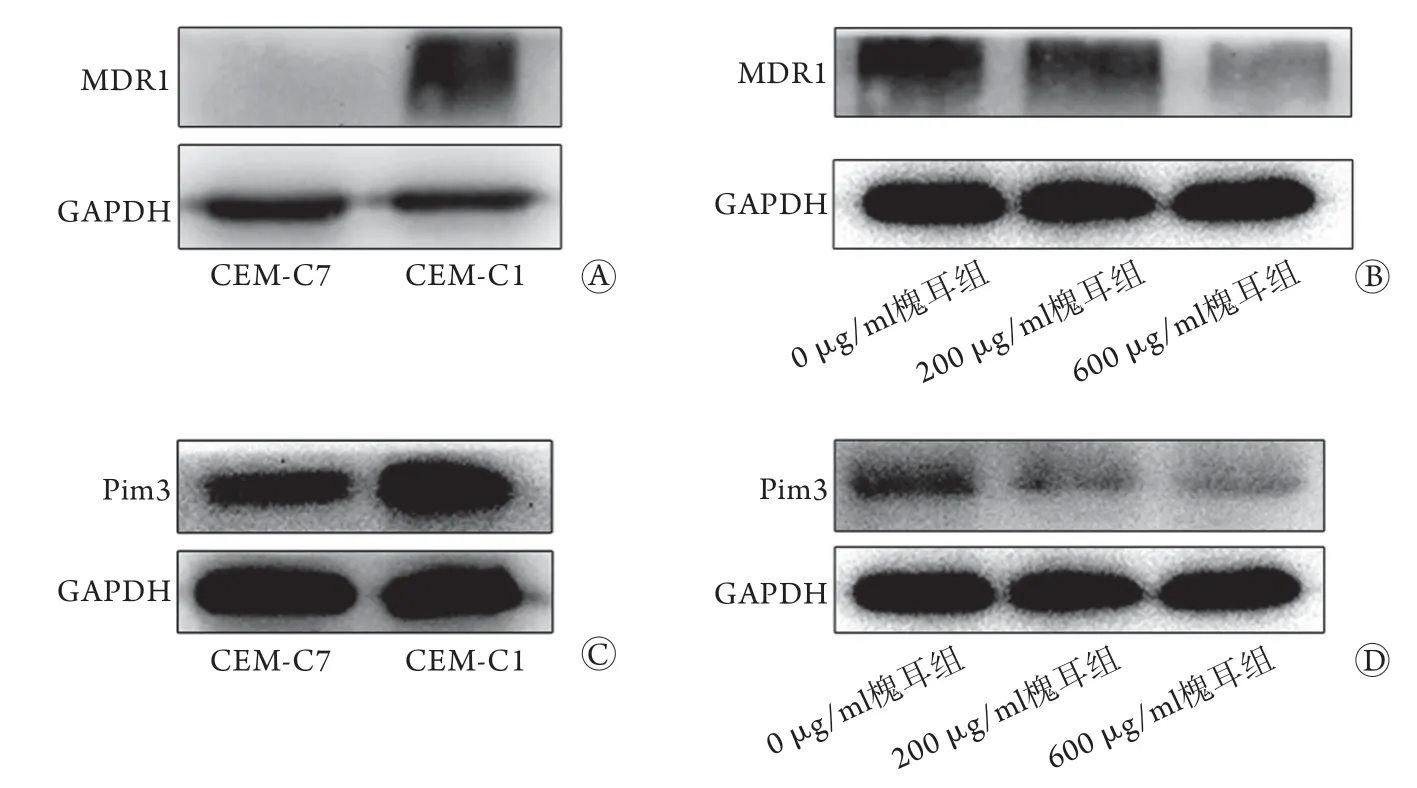
图2 各组细胞中MDR1、Pim3蛋白表达水平比较Fig.2 Comparison of the protein expression levels of MDR1, Pim3 in each group
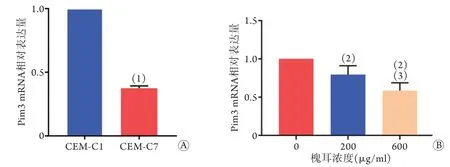
图3 各组细胞中Pim3 mRNA表达水平比较 (n=3)Fig.3 Comparison of the expression levels of Pim3 mRNA in each group (n=3)
3 讨 论
目前对肿瘤的治疗多采用放疗、化疗、手术等综合治疗,但随着对中草药认识的深入,中草药在肿瘤治疗中也发挥了独特的作用,与化疗药物联合应用可增效解毒、延长生命、改善患者生存状态,已成为近年来研究的热点。槐耳又名槐栓菌,为寄生于槐树上的木耳,是一种非常重要的药用真菌,始载于《唐本草》[23]。槐耳清膏作为槐耳菌质的初提物,通过加入相应的辅料、烘干可制作成槐耳颗粒。槐耳因具有抗肿瘤作用,现已广泛应用于原发性肝癌、胃癌、乳腺癌等肿瘤的辅助治疗[24-26]。单中心研究发现,槐耳颗粒治疗成人慢性粒细胞白血病慢性期患者的总有效率可达80%[27]。本研究发现,槐耳可剂量依赖性地抑制CEM-C1、CEM-C7细胞的增殖并促进其凋亡,表明槐耳对ALL细胞具有抗肿瘤效应。有研究表明,槐耳可逆转肝癌、胃癌等肿瘤细胞的耐药性[28-30]。Qu等[31]的研究发现,槐耳可增强伊马替尼在Ikaros基因亚型6(ikaros isoform 6,Ik6)阳性及Ph染色体阳性的急性淋巴细胞白血病(Ik6+Ph+ALL)中的敏感性。本研究发现,与单用DEX比较,100 μg/ml槐耳联合DEX可进一步抑制CEM-C1细胞的增殖,耐药逆转倍数为1.34倍。与对照组(0 μg/ml槐耳)比较,200、600 μg/ml 槐耳组的G0/G1期细胞比例降低,S期细胞比例增高,提示槐耳可在一定程度上阻滞细胞的G0/G1期,减少细胞分裂增殖,从而促进细胞凋亡,部分逆转CEM-C1细胞对GC的耐药性。本研究还发现,与GC敏感株CEM-C7细胞比较,GC耐药株CEM-C1细胞中多药耐药基因MDR1呈高表达,经槐耳处理后,CEM-C1细胞中MDR1的表达呈剂量依赖性的下降,与童琳等[12]在肝癌中的研究结果相似。以上结果表明,槐耳可在一定程度上逆转ALL细胞的耐药性,并增强CEM-C1细胞对DEX的敏感性。
Pim3基因最初是通过病毒插入筛选发现的,该基因可促进淋巴瘤的发展[32-33]。作为Pim家族中的一员,Pim3位于22号染色体(22q13),是发现最晚、研究最少的一个亚型[34-35]。Pim3参与介导多种肿瘤的发生发展,在胃癌、肝癌、胰腺癌、乳腺癌、卵巢癌、急性白血病及淋巴瘤等恶性肿瘤中均呈高表达[36-41]。还有研究发现抑制Pim3能抑制前列腺癌、肝癌、胃癌等肿瘤的进展[36-37,42]。作为新近发现且研究较少的一个亚型,Pim3还被发现与多种肿瘤耐药相关:Guo等[37]发现,沉默Pim3能逆转胃癌耐药;Xu等[20]发现,沉默Pim3可抑制胰腺癌细胞的增殖并增加其对吉西他滨化疗的敏感性。本研究结果显示,耐药细胞CEM-C1中Pim3蛋白及mRNA表达水平均高于敏感细胞CEM-C7,提示Pim3可能参与介导了ALL的耐药;采用不同浓度槐耳处理CEM-C1细胞后,其Pim3蛋白及mRNA表达水平均明显降低,表明Pim3可能是槐耳逆转ALL耐药性的靶点之一。因此,以Pim3为目的基因的基因抑制可能为逆转ALL耐药提供新的治疗策略及治疗靶点。
综上所述,槐耳作为一种中成药制剂,可抑制ALL细胞的增殖并促进其凋亡,调节细胞周期,增强白血病细胞对GC的敏感性,其作用机制可能与下调Pim3有关。本研究结果为槐耳辅助治疗ALL提供了新的理论依据,槐耳抑制Pim3基因的表达可能是一种潜在的治疗ALL耐药的有效方法,但其具体机制尚需进一步深入研究。
