针刺的神经保护作用及BDNF信号通路活化机制*
2021-04-15孙忠人李佳诺尹洪娜曾祥新
孙忠人,李佳诺,尹洪娜,李 全,曾祥新
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040; 2.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001)
针刺广泛应用于治疗脑脊髓神经疾病,对病后引起的运动功能障碍、感觉功能障碍以及尿潴留等并发症具有良好的治疗效果[1]。研究发现[2],针刺及电针对治疗各种神经系统疾病疗效显著,能促进神经修复。其中包括脑卒中及其运动功能障碍、阿尔茨海默病(AD)和帕金森疾病(PD)[3]。目前,大量的实验研究证明针刺是通过调节信号通路发挥治疗作用。例如,针刺介导的神经保护作用可通过降低p38MAPK水平,减少促炎因子及介质的表达,增加神经生长因子(NGF)表达而实现[4-5],与神经元和少突胶质细胞的细胞凋亡相关[6]。神经营养因子(Neurotrophins)是脑内一类重要的信号分子,负责轴突靶向,神经元生长及发育过程中突触的成熟和可塑性调节。其家族包含神经生长因子(NGF1)、脑源性神经营养因子(BDNF)以及神经营养素3/4,其中BDNF在突触可塑性方面优于其他[7],在中枢神经功能的许多方面发挥着关键作用[8]。最新数据表明,电针可通过调节BDNF及其信号通路缓解神经病理性疾病,针刺的作用机制与刺激神经末梢释放神经肽和调节神经营养因子表达相关[9]。本研究的目的是通过阐述针刺神经保护作用及针刺诱导BDNF及其信号通路激活的治疗机制。
1 BDNF/TrkB信号通路的神经保护作用
BDNF蛋白广泛分布于中枢神经系统(CNS)的神经元胞体、轴突和树突中,参与神经元突触可塑性调节。BDNF在成熟的大脑中也具有突触可塑性的基本功能[10],并且对学习和记忆过程至关重要[11]。在神经发育过程中,BDNF为正常轴突生长的信号[12],已知BDNF是多巴胺能、GABA能及胆碱能和5-羟色胺能神经元正常发育和存活所必需[13]。
最近数据表明,pro-BDNF和成熟的BDNF激活不同的细胞内信号通路[14]。Pro-BDNF信号通过低亲和力神经营养素受体p75传递,被认为参与细胞凋亡[15]。成熟的BDNF信号通过其高亲和力原肌球蛋白相关激酶B(TrkB)受体传递,当BDNF与TrkB结合时,诱导其二聚化,受体酪氨酸激酶被自身磷酸化,导致细胞内信号级联激活以及N-甲基-D-天冬氨酸(NDMA)受体电流的增加[16]。BDNF-TrkB激活可以调节至少3种信号转导途径,如图1。TrkB受体介导的BDNF信号转导,与BDNF结合,受体酪氨酸激酶TrkB出现磷酸化。不同位点的磷酸化导致不同下游通路的激活。①PI3K途径激活蛋白激酶B(AKT),导致细胞存活;②MAPK/ERK途径导致细胞生长和分化;③PLCγ途径激活三磷酸肌醇受体释放细胞内钙离子,增强钙调蛋白激酶(CaMK)活性,导致突触可塑性。这3条途径都汇聚在转录因子CREB上,CREB可以上调BDNF基因表达。
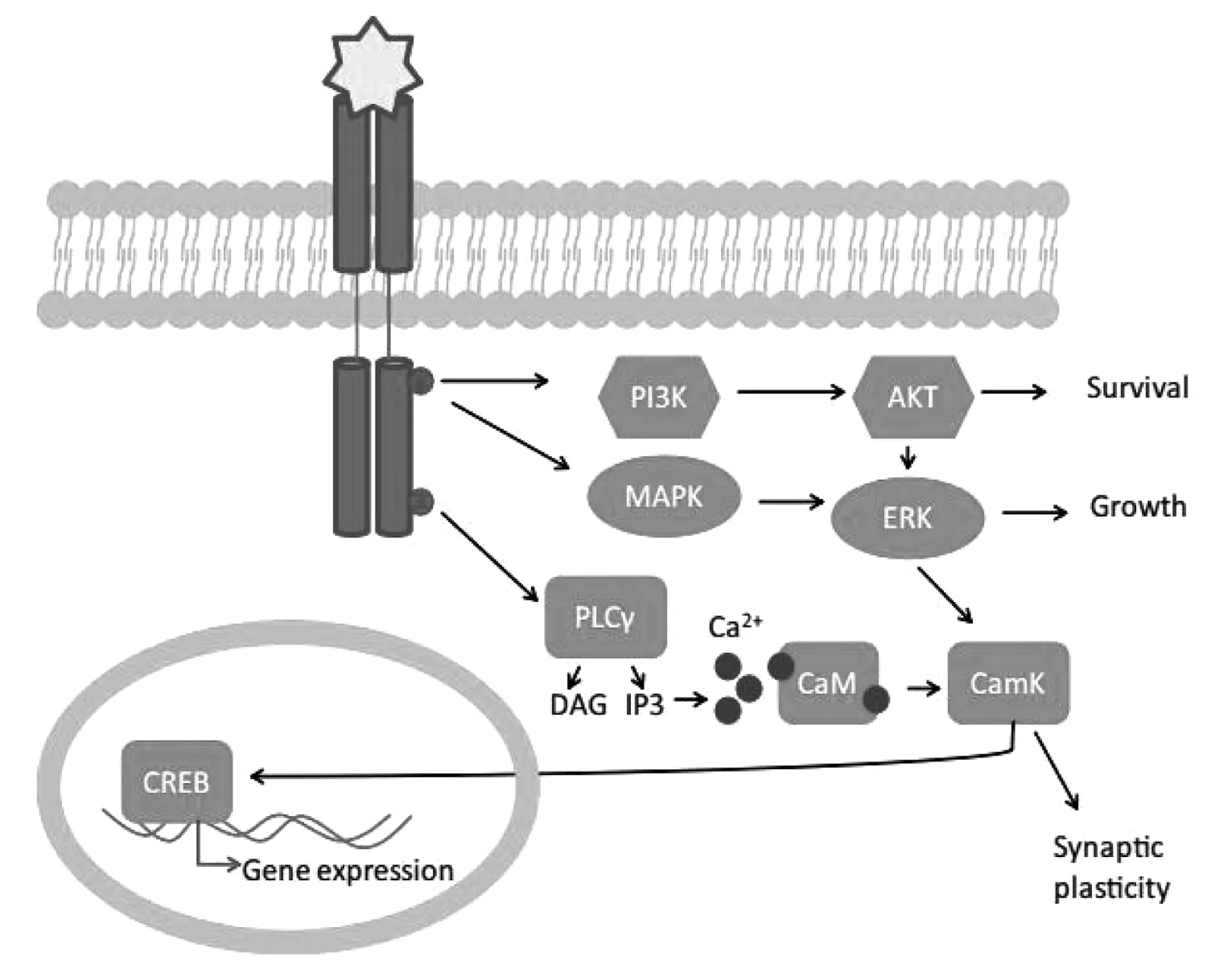
图1 BDNF-TrkB激活信号转导途径
磷脂酶Cγ(PLCγ)途径,导致蛋白激酶C的激活;磷脂酰肌醇3激酶(PI3K)途径,激活丝氨酸/苏氨酸激酶AKT;以及丝裂原活化的蛋白激酶(MAPK或细胞外信号相关激酶ERK)途径,激活下游效应分子。简而言之,快速突触和离子通道效应被认为依赖于PLCγ介导的细胞内钙离子储存的释放,涉及转录的更长时间的效应被认为是在PI3K和MAPK通路的下游。
众所周知,如电刺激诱发神经元活化,可调节BDNF的mRNA和蛋白质向树突转运,被认为是局部产生的BDNF调节突触传递和突触发生的能力[17]。此外,BDNF可通过自分泌和旁分泌机制发挥作用,这取决于其发出信号的细胞表面受体的位置[18]。有报道表明,BDNF通过活化ERK通路,抑制DNA损伤导致的大脑皮层神经元和小脑神经元的细胞死亡。另有研究表明,BDNF对细胞凋亡的保护作用不仅需要激活PI3K/Akt,但也通过抑制GSK-3β和激活cAMP反应元件结合蛋白(CREB)来激活ERK通路[19]。BDNF诱导的抗神经元凋亡保护作用机制,为防止皮层纹状体有机型培养物中N-甲基-D-天冬氨酸受体(NMDA)阻断引起的神经元死亡,其作用依赖于ERK和PI3K/Akt信号转导通路的刺激。
BDNF和TrkB定位于突触前和突触后,突触前BDNF信号促进神经递质释放,而突触后BDNF信号参与增强各种离子通道功能,包括α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic酸受体、NMDA受体、瞬时受体电位阳离子通道以及钠和钾通道[20]。BDNF同时作用于兴奋性和抑制性突触[21],实验证据表明BDNF可能调节自发和刺激性神经元活动[22]。
2 针刺对脑脊髓功能的神经保护作用
针刺效应得益于感觉系统,为周围神经传入活动的特殊模式,如β-内啡肽是介导针灸止痛的重要因素,许多其他分子和系统也可能被针刺刺激,从而产生一些生物效应,如压力、疼痛、自主活动和免疫系统的调节。目前研究证实,针刺可以释放多种神经递质,如谷氨酸、乙酰胆碱、GABA和血清素,以及中枢神经系统(CNS)和周围神经系统(PNS)中的神经肽[23]。最近研究表明,针刺信号可以通过传入神经途径进入CNS,引起各种神经和生理变化[24],Choi 等提示针刺刺激通过加速脑血流并增加糖尿病大鼠在缺血条件下的血浆渗透压和细胞外谷氨酸来保护神经元[25]。其他研究表明,针刺可通过增加酪氨酸羟化酶(TH)和多巴胺转运蛋白(DAT)的表达水平来抑制1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)中毒引起的黑质纹状体神经变性。此外,在MPTP模型中,与髋部非穴位相比,针刺阳陵泉和太冲穴引起小鼠脑组织中纹状体和黑质致密区中TH细胞水平显著升高[4]。实验证实针刺对治疗PD的证据表明具有神经保护作用,可以增加各种神经保护因子表达,如BDNF,GDNF和亲环素A(CypA)[26]。研究证实,电针长强穴治疗大鼠脊髓损伤(SCI),采用免疫荧光法(IF)观察损伤组织周围 NGF及BDNF含量均升高[27]。
3 针刺疗法与不同疾病的BDNF信号通路
综上所述,针刺为治疗疾病的重要干预疗法,其在中枢神经系统中具有多种神经调节功能。针刺通过激活BDNF及其下游信号通路在CNS中发挥有益作用[28-29]。
3.1 脑缺血损伤(Cerebral Ischemia Injury)
电针可以减轻脑缺血再灌注损伤,并通过调节多种凋亡相关基因的表达提供神经保护作用,如原癌基因(c-fos)、热休克蛋白70(HSP70)及神经营养素(NT)家族蛋白[30]。如针刺可以通过提高脑缺血再灌注损伤后小鼠海马BDNF mRNA的表达水平,从而保护神经元免受损伤,抑制海马细胞凋亡,在CNS中发挥有益作用。同时,电针百会穴显著增加BDNF和TrkB的表达,促进运动功能恢复[31]。针刺可以通过激活PI3K/Akt通路来发挥其对缺血性卒的神经保护作用[32]。此外,电针预处理可通过上调BDNF和趋化因子基质细胞衍生因子1α(SDF-1α)来增强对局灶性脑缺血的耐受性。Kim等证实电针百会和大椎穴预处理20 min可增加脑组织BDNF水平,并上调血浆中SDF-1α含量[33]。此外,一些研究人员指出,电针改善了缺血脑中的神经功能缺损,并增加了PI3K/Akt通路的神经保护活性[34]。因此,电针诱导的PI3K/Akt通路的激活抑制脑细胞凋亡。此外,电针还可提高缺血大鼠血清BDNF和GDNF水平,激活PI3K通路,增强Bcl-2/Bax比值等抗凋亡信号的表达。最近研究结果表明,电针曲池和足三里穴可能通过激活PI3K/Akt通路发挥缺血性卒中的神经保护作用[35]。
3.2 脊髓损伤(SCI)
研究证实,NT-3与受体TrkC结合激活通路Ras/Rap-丝裂酶原激活蛋白激酶(MAPK)/细胞外信号调节激酶(ERK)来发挥保护作用,BDNF与TrkB结合可激活PI3K/Akt发挥效应[4]。督脉电针可促进内源性NT-3与其受体TrkC结合,激活ERK信号通路[36]。采用电针长强治疗SCI,组织中NGF及BDNF表达含量增高[18]。有学者认为淋巴T细胞分泌BNDF可促进神经元恢复[37]。
3.3 炎症(Inflammation)
BDNF在针刺中的抗炎作用主要与激活阿片类和非阿片类神经递质有关。最近的研究表明,针刺可以降低神经营养因子(如NGF,BDNF和NT-3)的表达,而神经营养因子可增加超敏反应,也可增强炎症反应。然而,亦有报道针灸可以下调过敏性炎症疾病中的某些促炎神经肽和神经营养因子(包括BDNF和NGF),并可以改善临床体征和症状,如减少打喷嚏、鼻痒、鼻漏和鼻塞[38]。此外,针刺可能在过敏性鼻炎中发挥抗炎作用,这意味着针刺的作用可能在不同的组织中发挥不同的作用。
3.4 抑郁症(Depression)
电针刺激足三里在CNS产生了多种神经调节功能,特别是束缚应激大鼠的海马。电针刺激可显著增强AD患者海马中BDNF mRNA的表达[39]。关于针刺治疗抑郁症的机制,有报道电针可上调海马BDNF蛋白和mRNA及其受体TrkB的表达。此外,这种效应可能通过激活腺苷酸环化酶-cAMP-PKA-CREB信号通路[40]。针刺“百会”“印堂”穴可有效逆转慢性应激诱导的抑郁模型大鼠额叶皮质和海马BDNF mRNA和蛋白表达下调,通过保护神经元再生发挥其抗抑郁样作用。针刺“百会”“印堂”穴可有效逆转慢性应激诱导的抑郁模型大鼠额叶皮质和海马BDNF mRNA和蛋白表达下降,从而通过保护神经元再生发挥抗抑郁样作用[41]。
4 针刺对BDNF信号通路调节作用机制
据报道,针刺可促进BDNF表达,并可保护体内外神经元免受损伤[42],通过与TrkB相结合,经原癌基因ras编码的Ras蛋白通路实现信号转导反应,此机制可保护神经元免受谷氨酸损害。通过免疫组化法(IHC)研究发现,BDNF mRNA及蛋白质可表达在中枢神经系统和周围神经系统的神经元和小胶质细胞,可促进神经元生长发育、成熟,对神经再生有促进作用,对神经应激性损伤初期也具有保护作用[43]。
另有报道表明,针刺可以增加MPTP诱导的帕金森病小鼠模型中BDNF和CypA的表达[44],提示对DA神经元变性的保护作用是通过提高CypA水平实现。研究表示,CypA在大脑中普遍表达[45],并且主要定位于神经元[46]。一些研究表明,虽然具体机制不明确,但CypA在神经元分化中发挥重要作用[47]。因此,如果将电针后增加的BDNF表达水平与CypA联系,可假设CypA通过针刺刺激激活BDNF及其信号通路。此外,细胞层面研究,BDNF处理诱导了SH-SY5Y细胞中CypA的表达[44]。因此,BDNF可能是在针刺治疗过程中调节CypA表达的重要上游因子。又因针刺在神经保护中也起着至关重要的作用,其可能通过触发一条有序的信号通路发挥作用,其中BDNF可能位于其他内源性防御系统的上游,以保护神经元。基于前期研究,针刺可以增加脑缺血再灌注损伤后小鼠海马和前额叶皮质(PFC)中BDNF和p-ERK1/2蛋白水平[48]。体外研究也证实,CypA刺激培养的皮层神经元ERK1/2信号通路,并通过激活ERK1/2信号通路保护体外氧化和缺血损伤的神经元[49]。总而言之,针灸机制的一个合理解释可能是激活CypA-ERK通路,上调BDNF表达并改善各种神经元功能障碍[44]。
此外,基于对BDNF功能和针刺效应的临床研究,发现针刺亦可以通过神经营养素介导的作用促进某些神经疾病患者的神经再生。根据多项动物实验证明,针刺诱导的内皮BDNF增加在神经损伤后发挥神经保护作用。接受针刺治疗3个月的PD患者外周血液中BDNF水平升高。然而,发现脊髓损伤(SCI)患者针刺后48 h BDNF水平降低[50]。因此,血BDNF在SCI中作用仍不确定,早期研究表明,BDNF储存在人类血小板中,并通过物理刺激释放[51]。然而,针刺后人血清中的血小板数量、BDNF相关的神经营养因子NGF和其他细胞因子水平保持不变,而BDNF水平下降[52]。虽然已有报道血液BDNF水平与针灸、炎症和应激的时间有关,但此关系的潜在机制仍不清楚。
5 小结
鉴于上述研究,证明针刺可以通过激活BDNF信号通路来防止神经元死亡,提高神经元存活和突触可塑性。尽管这种关系的确切机制尚未确定,但一些研究表明,穴位选择是针刺诱导BDNF升高的一个重要因素。例如,与针刺足三里比较,阳陵泉刺激在PD小鼠模型中产生了更显著的神经保护作用。在激活BDNF之后,阳陵泉的刺激也增强了CypA的表达[44]。此外,在涉及针刺对SCI影响的研究中,与针刺水道比较,选取关元穴产生更高水平的BDNF和TrkB。着眼于特殊模型中特殊穴位之间的关系,有一些迹象表明,对于空间记忆障碍或抑郁样行为改变模型,相较于其他经络的穴位,针刺神门穴可以显著上调BDNF的表达,优于其他穴位[53]。总之,结果表明无论何种实验模型,针刺都具有高度的穴位特异性效应。
综上所述,多项疾病均可引发 BDNF信号通路传导,且各系统均涉及。而针灸刺激体表穴位激活BDNF表达,多种通路最后均作用于CREB,CREB磷酸化后以激活相关的靶基因转录,最终形成针刺效应。其作用机制在各脑区、组织和体液中均表达。笔者认为 BDNF-CREB 信号通路可能作为具有潜在的针刺广谱性效应物质及保护机制,这涉及多通路、多途径、多层次、多水平和多靶点上实现信号的整合与调控,为指导临床工作具有重要意义。
