夹脊电针调控P2X7R/NLRP3信号通路相关因子改善脊髓损伤大鼠微环境炎症反应的作用机制研究*
2021-04-15刘玲玲梅继林李晓宁
刘玲玲,梅继林,李 诺,李晓宁
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040; 2.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001)
脊髓损伤(Spinal cord injury,SCI)患者通常长期残疾,丧失工作和日常生活能力,需要长期甚至终生的医疗护理[1-2]。脊髓损伤后脊髓组织微环境平衡被破坏,导致占主导地位的神经免疫细胞——小胶质细胞过度活化,在脊髓局部微环境中进一步发生炎症反应、氧化应激及细胞凋亡等病理机制,加重神经元继发性损伤,在病理机制中炎症反应又扮演着重要角色,因此学者将如何在脊髓损伤发生后及时控制炎症反应作为研究治疗脊髓损伤的重中之重[3]。课题组前期研究发现夹脊电针能通过抑制脊髓损伤大鼠NLRP3炎症小体的活化,达到减轻脊髓损伤后炎性损伤作用[4],然而调控NLRP3炎症小体的上游因子还不清楚。本研究通过检测SCI大鼠夹脊电针治疗后微环境中 P2X7R/NLRP3信号通路相关因子表达变化,探讨该信号通路对炎症反应可能的作用机制。
1 实验材料
1.1 实验动物及分组
Sprague-Dawley(SD)大鼠120只,由辽宁长生生物技术有限公司提供。随机分为5组,假手术组(Sham)、模型组(Model)、夹脊电针组(EA)、P2X7干扰组(P2X7R siRNA)和干扰对照组(Control siRNA);每组又划分成1 d、3 d、7 d和21 d共4个时间点,实验过程遵照国际方面相关的动物使用标准。
1.2 主要试剂及仪器
1.2.1 试剂 过氧化氢(国药,中国);苏木精、 DAB 显色液、山羊血清和抗荧光衰减封片剂(Solarbio,中国);cleaved caspase-1(Wanleibio,中国);OX42(abcam,美国);P2RX7(alomone,以色列);IL-1β(Bioss,中国);Cy3标记山羊抗兔IgG、FITC标记山羊抗小鼠IgG(中国Beyotime);HRP标记山羊抗兔IgG(thermofisher,美国);P2X7慢病毒、阴性对照慢病毒(沈阳万类生物科技有限公司)。
1.2.2 仪器 电热恒温鼓风干燥箱 (精宏实验设备,上海);石蜡切片机(Leica,德国);超纯水系统(Heal Force,香港);电热恒温培养箱(DH36001B,天津泰斯特公司);显微镜、激光共聚焦扫描显微镜(OLUMPUS,日本);电针仪(KWD-808II,中国英迪)。
2 实验方法
2.1 模型制备及评价
改良打击法Allen’s制作脊髓损伤使用的动物模型,给予10%比例水合氯醛腹部麻醉,待大鼠麻醉后,将其固定于手术台上,以T10为中心进行脱毛、备皮和消毒,之后以T10棘突为中心点切开大约3 cm大小的手术切口,将T9~11棘突暴露。观察到大鼠尾巴摆动,身体呈现痉挛性抽搐,提示造模成功,之后将伤口缝合。最后给予生理盐水注射,肌注青霉素。等待大鼠苏醒后,BBB评分在1~3分范围内以及触诊到膀胱胀大者,确认造模成功[5]。BBB评分对大鼠后肢运动功能情况进行评定,评分1~3分者纳入实验。
2.2 干预方法
2.2.1 Sham 除去对应椎板,只是暴露不进行脊髓打击,捆绑,常规喂养,无其他干预。
2.2.2 Model 造模成功后,除正常捆绑外,不给予其他处理。
2.2.3 EA 造模成功后[6]3 h夹脊电针干预:刺入T9、T11节段对应的夹脊穴4~5 mm,之后把电针仪正极和负极分别夹在同侧对应的针灸针的两针柄上,计时30 min,调节电流大小为1~2 mA,频率为100 Hz,每日1 次,30 min/次。
2.2.4 P2X7R siRNA 造模成功的大鼠,注射滴度为107 TU/mL P2X7R干扰慢病毒,抽取8 μL的病毒悬液,选取损伤部位头侧和尾侧分别进行注射,各注射点注射2 μL悬液。
2.2.5 Control siRNA 同上述方法,给予阴性的对照慢病毒。造模成功后采取单笼独立饲养,正常捆绑,无其他干预。
2.3 指标检测
2.3.1 BBB评分评估大鼠后侧肢体运动功能 于模型建立后第1天、3天、7天和21天进行运动功能评估,评分0~21分[7-8],评分越低提示后肢运动功能损伤越严重。
2.3.2 免疫组化法 检测大鼠脊髓组织中Cleaved caspase-1、IL-1β和P2X7R的表达情况 脊髓组织固定后修复、脱水和二甲苯固定,包埋后将其切成5 μm厚度的薄片,置于60 ℃温箱中2 h,之后进行烘干、脱蜡和IHC检测。
2.3.3 免疫荧光双标法观察P2X7R与OX42共定位情况 脊髓组织切片脱蜡至水:每一张石蜡切片放置在切片架上,60 ℃烘箱烤片,之后分别浸于Ⅰ级、Ⅱ级二甲苯中,依次浸入95%、85%和75%乙醇中;抗原修复:放置在煮沸抗原修复液中,进行低火修复;血清封闭:加入山羊血清直至完全覆盖全部组织;一抗孵育:加入一抗共同孵育;二抗孵育:加入荧光二抗直至完全覆盖全部组织;DAPI复染:加入DAPI进行复染核;抗荧光衰减封片:加入抗荧光衰减封片剂之后,进行封片;最后显微镜镜检[9]。
2.4 统计学处理
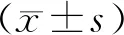
3 实验结果
3.1 各组比较大鼠BBB评分比较
与Sham组,4个时间点Model组大鼠BBB评分明显降低(P<0.05)。与P2X7R siRNA组相比较,3 d、7 d和21 d 3个时间点Control siRNA组大鼠评分明显降低(P<0.05)。与Model组相比较,3 d、7 d和21 d时间点EA组与P2X7R siRNA组评分都升高(P<0.05)。随着时间的推移,EA组与P2X7R siRNA组评分为上升趋势,说明EA组与P2X7R siRNA组均对大鼠脊髓损伤后后侧肢体功能有改善作用,并且21 d时效果更显著。见表1。
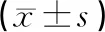
表1 各组大鼠BBB评分比较

表2 各组大鼠脊髓组织Cleaved caspase-1的平均光密度值
3.2 各组大鼠脊髓组织相关因子表达变化情况
3.2.1 各组大鼠脊髓组织中Cleaved caspase-1表达变化比较 与Sham组比较,4个时间点Model组表达含量明显升高,差异有统计学意义(P<0.05),表明模型制备成功。与P2X7R siRNA组比较,1 d、3 d、7 d和21 d时间点Control siRNA组表达含量仍较高,差异有统计学意义(P<0.05),表明构建干扰慢病毒载体成功。夹脊电针治疗后,3 d、7 d和21 d 3个时间点EA组表达均低于Model组,差异有统计学意义(P<0.05);质粒病毒装载小片段RNA注射脊髓组织后,3 d、7 d和21 d 3个时间点P2X7R siRNA组表达均低于Model组,差异有统计学意义(P<0.05)。见图1、表2。结果提示脊髓损伤后微环境中Cleaved caspase-1表达明显升高,质粒病毒siRNA干扰P2X7R能抑制Cleaved caspase-1表达,夹脊电针也可抑制Cleaved caspase-1蛋白表达,进而可能干扰其介导的炎症反应,治疗脊髓炎性损伤,随着时间的进展治疗优势更明显。

图1 各组大鼠脊髓组织Cleaved caspase-1表达的比较(400×)

图2 各组大鼠脊髓组织IL-1β表达的比较(400×)
3.2.2 各组大鼠脊髓组织IL-1β表达比较 与Sham组比较,各时间点Model组表达显著升高,差异有统计学意义(P<0.05),表明模型制备成功。与P2X7R siRNA组比较,3 d、7 d和21 d时间点Control siRNA组表达水平仍较高,差异有统计学意义(P<0.05),表明构建干扰慢病毒载体成功。经夹脊电针治疗后,3 d、7 d和21 d共3个时间点EA组表达均低于Model组,差异有统计学意义(P<0.05);质粒病毒装载小片段RNA注射脊髓组织后,3 d、7 d和21 d时间点P2X7R siRNA组表达均低于Model组,差异有统计学意义(P<0.05)。见图2、表3。结果提示脊髓损伤后微环境中IL-1β蛋白表达水平明显升高,质粒病毒siRNA干扰P2X7R能抑制IL-1β表达,夹脊电针也可抑制IL-1β的表达,进而可能抑制其介导的炎症反应,治疗脊髓炎性损伤,随着时间增加,其治疗优势更明显。
3.2.3 各组大鼠脊髓组织P2X7R表达比较 与Sham组比较,各时间点Model组P2X7R蛋白表达显著升高,差异有统计学意义(P<0.05),表明模型制备成功。与P2X7R siRNA组比较,1 d、3 d、7 d和21 d时间点Control siRNA组表达水平仍较高,差异有统计学意义(P<0.05),表明构建干扰慢病毒载体成功。经夹脊电针治疗后,3 d、7 d和21 d 3个时间点EA组表达均低于Model组,差异有统计学意义(P<0.05);质粒病毒装载小片段RNA注射脊髓组织后,3 d、7 d和21 d时间点P2X7R siRNA组表达均低于Model组,差异有统计学意义(P<0.05)。见图3、表4。随着时间的推移,Model组表达在1 d、3 d和7 d表现为上升趋势,7 d时表达量达到最高,21 d时出现下降趋势;EA组大鼠脊髓组织表达在1 d和3 d表现为上升趋势,3 d时表达量达到最高,7 d和21 d时出现下降趋势。结果提示脊髓损伤后微环境中P2X7R表达明显升高,质粒病毒siRNA干扰P2X7R能抑制表达,夹脊电针也可抑制表达,进而可能抑制其介导的炎症反应,治疗脊髓炎性损伤,随着时间增加治疗优势更明显。

表3 各组大鼠脊髓组织IL-1β的平均光密度值

图3 各组大鼠脊髓组织P2X7R表达的比较(400×)

表4 各组大鼠脊髓组织P2X7R的平均光密度值
3.3 各组大鼠脊髓组织中P2X7R与OX42共定位表达
P2X7R与小胶质细胞标志物OX42免疫荧光双染可见,P2X7R与OX42存在共定位,且红色荧光为P2X7R阳性,绿色荧光为OX42阳性,蓝色荧光为细胞核,双阳性为橙色。与Sham组比较,各时间点Model组P2X7R与OX42共定位明显增多。夹脊电针治疗后3 d、7 d和21 d 3个时间点EA组表达明显低于Model组;质粒病毒装载siRNA干扰P2X7R表达后,3 d、7 d和21 d 3个时间点P2X7R siRNA组表达显著低于Model组。以上实验结果表明脊髓损伤后P2X7R在脊髓组织小胶质细胞中表达明显增多,夹脊电针和质粒病毒装载siRNA干扰P2X7R表达能够有效抑制小胶质细胞中P2X7R表达,起到抑制炎症反应的作用。见图4。
4 讨论
外伤性脊髓损伤导致严重的不可逆性功能丧失。据估计,全世界有2 700多万人在脊髓损伤后长期残疾,其中90%是由于外伤造成的[10]。课题组前期已经发现脊髓损伤后NLRP3炎症小体被激活并且引起一系列的炎症级联反应,证实夹脊电针可以通过抑制NLRP3活化,减轻NLRP3炎症级联反应,促进脊髓损伤后的肢体功能恢复,但是激活NLRP3炎性小体上游的调节因子尚未明确。酒精性脂肪性肝炎可以通过抑制或沉默P2X7R阻断P2X7R/NLRP3信号轴减少IL-1β以及其他炎性因子的释放,从而减轻炎症反应[11]。急性脊髓损伤后可以引起小胶质细胞中P2X7R表达量增加,NLRP3炎症小体相关因子表达升高,从而加重神经损伤[12]。夹脊电针是否可以通过抑制P2X7R阻断NLRP3炎症小体活化,减少相关因子的释放。本实验通过检测SCI大鼠在夹脊电针治疗后微环境中P2X7R/NLRP3通路相关因子的表达变化,探讨该信号通路对脊髓损伤炎症的作用机制。
炎症小体首先由 Tschopp 及其同事提出[13],指的是可以通过 NOD 样受体[14](NOD- like receptors, NLR)传递细胞内危险信号的多蛋白复合物,它的激活可引起下游的炎症级联反应。在所有 NLR 炎性小体中,NLRP3 是研究最广泛的[15-16]。NLRP3炎症小体是一种多蛋白复合物,主要由NOD样受体家族成员NLRP3、凋亡相关斑点样蛋白ASC以及pro-caspase-1三部分构成[17]。NLRP3炎症小体的形成通常包括两个不同的步骤,即启动(信号1)和激活(信号2)[18]。在功能性 NLRP3炎性小体形成之前,细胞内除了必须在转录和翻译水平保证 NLRP3 的合理表达外,还必须积累一定量的 pro-IL-1β和 IL-18,这是一个称为炎性小体启动的过程,或“信号 1”。NLRP3 在接受刺激[19-20],与ASC等蛋白形成功能性NLRP3 炎症小体,将 pro-capase-1 剪切形成活化的 caspase-1(Cleaved-caspase-1),进而将 pro-IL-1β和 pro-IL-18 剪切形成炎症因子 IL-1β和 IL-18,导致炎症反应的发生,这一过程称之为炎症小体的激活过程,或“信号 2”。激活NLRP3炎症小体的机制很多,主要有细胞内钾离子的外排、溶酶体破裂、线粒体活性氧(Reactive oxygen species, ROS)的生成和内质网的应激等[21]。其中,钾离子外排是引起炎症的常见机制,三磷酸腺苷(Adenosine triphos-phate, ATP)与嘌呤受体P2X7(Purinergic 2X7 receptor,P2X7R)结合使其激活。研究证实P2X7R是NLRP3炎性小体最有效的激活因子之一,也是caspase-1裂解和成熟IL-1释放的激活因子之一[22]。在脊髓损伤中,抑制NLRP3炎症小体的激活有显著的神经保护作用[23],因此,阻断ATP-P2X7R-NLRP3信号通路的激活有可能是脊髓损伤治疗的新靶点。课题组前期实验研究发现夹脊电针能通过抑制脊髓损伤大鼠NLRP3炎症小体的活化,达到减轻脊髓损伤后炎性损伤[4]、促进肢体功能恢复的作用,但对与通路上下游的炎症因子的研究较少。本研究发现,脊髓损伤后,模型组Cleaved-caspase-1、 IL-1β和P2X7R蛋白表达量增加,说明此信号通路的相关因子参与了脊髓损伤的机制,抑制剂Cleaved-caspase-1、 IL-1β和P2X7R表达量均显著降低,是由于特异性地抑制P2X7R的表达,从而减少微环境中Cleaved-caspase-1、 IL-1β的含量,抑制脊髓组织的炎症反应,发挥神经保护作用。
脊髓损伤的临床表现与痿病的肢体筋脉迟缓、不能随意运动和肌肉萎缩的症状相似,故脊髓损伤归为中医“痿病”的范畴。《黄帝内经》中将痿分为“脉痿”“筋痿”“肉痿”“骨痿”,又言:“治痿者独取阳明一经,阳明者五脏六腑之海,主润宗筋,能束骨而利机关也”“阳明为之长……而络于督脉”。由此,治痿离不开督脉。脊髓损伤位置正在督脉所过之处,“经络所过,主治所及”。夹脊穴位于脊椎两侧,督脉位于脊椎正中央,夹脊穴、督脉与脊柱形成一体两翼的关系。从夹脊穴的解剖来说,其下走行脊神经,脊神经前根负责运动,后跟负责感觉,刺激夹脊穴可直接调节运动和感觉功能。电针疗法(EA)是将电流应用于针刺入体内的针上,在脊髓损伤周围形成电磁场,是治疗脊髓损伤的有效方法[24-25]。夹脊电针能明显缓解和延缓脊髓损伤,促进脊髓损伤后脊髓神经的恢复[26]。

图4 各组大鼠脊髓组织中P2X7R与OX42共定位表达(600×)
本实验结果显示:脊髓组织损伤大鼠脊髓组织中的炎症相关因子表达量增加,而夹脊电针可以降低加重炎症因子的表达量,因而加快了脊髓损伤大鼠运动功能恢复。因此,笔者得出结论,夹脊电针作用机制可能与抑制大鼠脊髓损伤组织微环境 P2X7R/NLRP3信号通路相关炎症因子表达有关。
