海口市美兰区畜禽生鲜肉沙门氏菌分离及耐药性分析
2021-04-15郭定乾满初日嘎
郭定乾,罗 瑛,洪 枫,满初日嘎
(海南大学 动物科技学院,海口 570228)
沙门氏菌(Salmonella)为肠杆菌科沙门氏菌属成员,具有极其广泛的动物宿主,是一种常见的人畜共患病食源性病原体,主要寄生在人和动物体肠道内,通过多种方式与微生物竞争,破坏微生物区系平衡,最终引发腹泻、肠炎等疾病;而沙门氏菌致病因子鞭毛和脂多糖等也可诱导炎症的产生[1]。鸡肉是沙门氏菌感染人的主要媒介之一,在屠宰前鸡的沙门氏菌携带率为3%~4%,离开屠宰场时鸡肉沙门氏菌污染率达到35%[2]。对于猪肉而言,沙门氏菌存在于猪养殖的各个阶段,尤其是在屠宰后贮藏和销售过程中猪肉极易被沙门氏菌污染,检出率也较高[3]。而由肉类沙门氏菌引发的人体食物中毒现象层出不穷,此菌也是报道最为频繁的食源性致病菌之一。近几年,四川[4]、江苏[5]、宁夏[6]、上海[7]、重庆[8]等地己报道了多起由于沙门氏菌导致的食物中毒事件,而全球每年更是有过亿人口感染沙门氏菌。由此可见,沙门氏菌对常见肉类的污染从而对食品安全构成了较大威胁。沙门氏菌可以通过饲料原料、生产设备、鼠和垫料等介质传播,因此饲料原料的把控、严格的生物安全措施、畜舍卫生的加强、垂直传播的控制等是目前预防沙门氏菌感染的主要措施。
海南属于热带季风气候,年平均气温较高(23~26 ℃)且常年降水充沛,此高温湿润环境非常适合细菌等微生物的生长和繁衍,而生鲜肉也为微生物的繁殖提供了良好温床[9],由此导致海南地区市场售卖生鲜肉感染沙门氏菌概率较高。目前,尚未有关海南海口地区市场生鲜肉感染沙门氏菌的相关调查或检测报告。因此,本研究选取海口市美兰区大型农贸市场和超市为采样点,评估市场室内、外环境下猪肉和禽类肉品感染沙门氏菌的情况,旨在为预防海口本地沙门氏菌引起的食源性疾病提供参考依据。
1 材料与方法
1.1 实验材料按简单随机抽样原则采集生鲜肉样,分别于2019 年3 月至5 月从海口市美兰区大型农贸市场室内、室外采集样本共50 份,样品信息详见表1。每次取2 份平行样,分别放于2 支无菌袋中,2 h内低温运回实验室进行下一步处理。
1.2 细菌培养基缓冲蛋白胨水(BPW)、四硫磺酸钠煌绿增菌液(TTB)、营养琼脂培养基、营养肉汤培养基、HE 琼脂培养基(HE)、三糖铁琼脂培养基(TSI)、动力−吲哚−尿素基础培养基(MIU)和革兰氏染色液等试剂购于青岛海博生物技术有限公司;亚硫酸铋琼脂培养基(BS)购于杭州微生物试剂有限公司。
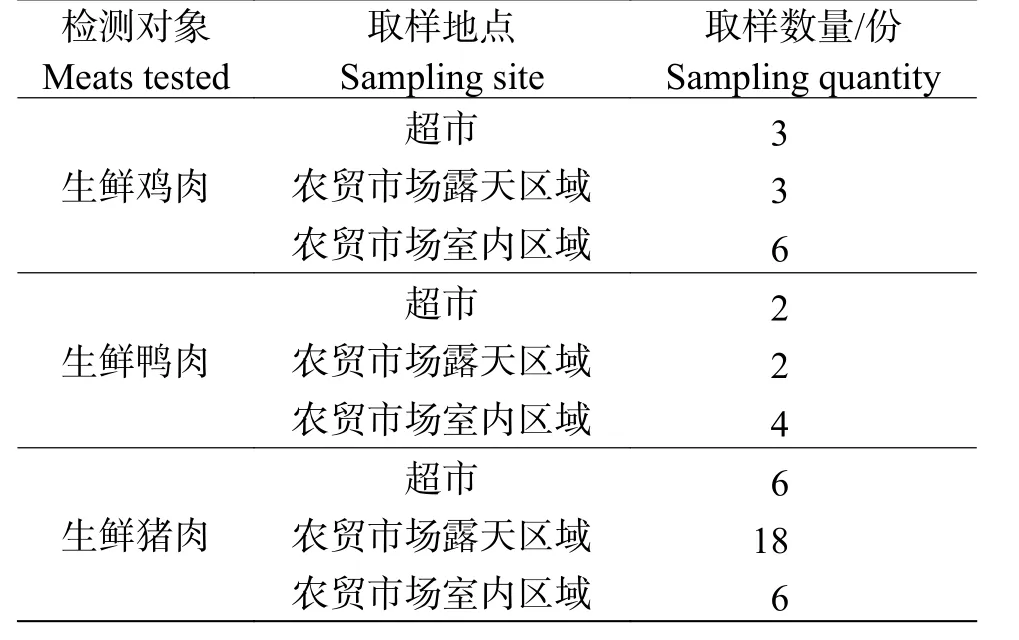
表1 生鲜肉样品信息Tab.1 Samples of meats collected
1.3 药敏纸片药敏实验抗生素(购于杭州微生物试剂有限公司)按化学成分分为青霉素类:青霉素(Penicillin)、阿莫西林(Amoxicillin)、氨苄西林(Ampicillin);头孢菌素类:头孢拉定(cephradine);氨基糖苷类:卡那霉素(Kanamycin)、庆大霉素(Gentamicin)、链霉素(streptomycin);四环素类:多西环素(doxycycline)、四环素(Tetracycline);酰胺醇类:氯霉素(chloramphenicol)、氟苯尼考(Florfenicol);大环内酯类:红霉素(Erythromycin)、吉他霉素(kitasamycin);喹诺酮类:诺氟沙星(Norfloxacin)、环丙沙星(Ciprofloxacin);磺胺类:磺胺异噁唑(Sulfisoxazole)。
1.4 菌株分离纯化本研究样品参照按照国标GB4789.4—2016 方法进行操作:在超净工作台中剪取每个样本5 g,置于盛有45 mL BPW 的无菌三角瓶中,以1 000~1 300 r·min−1均质1~2 min,振荡混匀后37 ℃培养24 h。将培养后的BPW 前增菌液样本混合均匀,取1 mL 菌液置于TTB 增菌液中,恒温(37 ℃)振荡培养18~24 h。随后挑取菌落在HE 和BS 琼脂培养基中进一步培养18~24 h,随后观察培养基上是否产生了黑色、有金属光泽的疑似沙门氏菌菌落,并将可疑菌落接种于BS 琼脂平板上,37 ℃培养18~24 h,再次观察BS 琼脂平板是否产生了单个疑似沙门氏菌菌落,若无则继续纯化培养至有上述描述菌落为止。将纯化的菌落挑至营养肉汤培养基中,37 ℃培养18~24 h,用于后续实验。
1.5 生化鉴定挑取纯化后获得的单个菌落,在超净工作台上均匀涂布在滴有生理盐水无菌载玻片上,进行革兰氏染色,镜检观察可疑菌落菌体形态结构。
1.6 PCR 鉴定选择沙门氏菌保守基因invA设计引物序列(F5′-AAACCTAAAACCAGCAAAGG -3′;5′-TGTACCGTGGCATGTCTGAG-3′)[10],目的片段大小605 bp。采用菌落PCR 扩增反应,体系为:2×PCR预混液12.5 μL,上游引物1 μL,下游引物1 μL、菌液2 μL,ddH2O 8.5 μL,共计25 μL。PCR 反应参数:95 ℃ 预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共30 个循环,最后72 ℃延伸10 min,4 ℃保存。取5 μL PCR 产物,经w=1.5%琼脂糖凝胶电泳检测基因片段扩增情况,PCR 产物进行测序(生工生物工程上海股份有限公司)。
1.7 药敏试验按WHO 提供的Kindy-Bauer 纸片扩散方法进行,以抑菌圈的大小作为评定沙门菌株对药物敏感度强弱的依据,药敏结果判断依据NCCLS2010 年标准。挑选PCR 鉴定为沙门氏菌的菌液,接种至营养肉汤培养基中37 ℃ 培养18 h,轻摇0.5 号麦氏浊度标准管,将液体培养物加入无菌试管中,并加入无菌生理盐水,直到浓度与0.5 号麦氏浊度标准管浓度相同,菌液密度约为1.5×108cfu·mL−1,取1 mL 菌液滴加在营养琼脂培养基上并涂布均匀,37 ℃下培养24 h,每个培养皿贴上4 种不同药敏片,37 ℃培养24 h,观察培养基里纸片药敏圈大小并记录直径。
1.8 耐药基因PCR 检测3 种耐药基因(qurB,sul2,tetA)引物序列分别为qurB:F 5′-GATCGTGAAA GCCAGAAAGG -3′,R 5′-ACGATGCCTGGTAGTTGTCC -3′,目的条带大小为469 bp;sul2:F5′-GCGC AGGCGCGTAAGCTGAT-3′,R 5′-CGAAGCGCAGCCGCAATTC-3′,目的条带大小为514 bp;tetA:F5′-GCTACATCCTGCTTGCCTTC-3′,R5′-CATAGATCGCCGTGAAGAGG-3′,目的条带大小为210 bp[10]。对鉴定为沙门氏菌的样本菌株进行菌落PCR 扩增反应,体系为2×PCR 预混液12.5 μL,上游引物1 μL,下游引物1 μL、模板DNA 2 μL,ddH2O 8.5 μL,共计25 μL。PCR 产物进行w=1.5%琼脂糖凝胶电泳检测基因片段扩增情况。
2 结果与分析
2.1 沙门氏菌分离及生化试验结果如图1 所示,BS 琼脂平板上疑似沙门氏菌的单个菌落,革兰氏染色后镜检结果显示菌体形态为短棒状的革兰氏阴性菌,初步判断39 份样本分离到了疑似菌株。

图1 BS 培养基可疑菌落革兰氏染色8、10、16、29 为分离菌株编号。Fig.1 Gram staining of suspicious colonies in BS mediumStrain number: 8、10、16、29.
将样本进行进一步TSI 接种培养,结果显示(表2),50 株分离菌株样本中检测出17 株非沙门氏菌,33 株为疑似沙门氏菌。从表3 可知,MIU 琼脂反应现象观察统计50 株分离菌株样本中检测出13 株非沙门氏菌,37 株为疑似沙门氏菌。

表2 三糖铁琼脂培养基菌群培养Tab.2 Triple sugar iron agar medium culture of isolates

表3 沙门氏菌分离株生化反应鉴定Tab.3 Biochemical identification of Salmonella isolates
2.2 PCR 扩增电泳以invA毒力基因为靶基因PCR 扩增产物的部分电泳结果见图2,605 bp 位置有条带可判定为阳性,即该菌为沙门氏菌。从图2 中可知,50 份样本中4 份为阳性,编号为8,10,16,29,P 为阳性样本,为实验室保存的鼠伤寒沙门氏菌CMCC 50 013 DNA 样。根据以上实验结果,在海口美兰区海甸岛农贸市场选取的50 份样本猪肉和鸡鸭肉样本中,4 份检出阳性,总阳性检出率为8%,鸡肉检出率8.33%,鸭肉检出率25%,猪肉检出率3.33%,室内检出率2.56%,室外检出率9.1%(表4)。

图2 沙门氏菌分离株invA 靶基因PCR 扩增结果阳性为阳性对照鼠伤寒沙门氏菌(CMCC 50013)。Fig.2 Electrophoretic detection of target gene invA from Salmonella isolatesPositive of standard Salmonella typhimurium (CMCC 50013).

表4 生鲜肉样本沙门氏菌检出数Tab.4 Salmonella detection of meat samples

表5 Kindy-Bauer 法药敏实验Tab.5 Kindy-Bauer antibiotic resistance test
2.3 药敏试验反应分析结果分离沙门氏菌菌株进行16 种抗生素药物敏感实验结果见表5。从表5 可知,除环丙沙星外,4 株沙门氏菌对其他抗生素呈现出不同耐药性。其中,4 株菌株对青霉素、氨苄西林、四环素和吉他霉素产生完全耐药性,耐药率为100%;4 株菌株中有3 株对氯霉素、阿莫西林和磺胺异噁唑产生完全耐药,耐药率为75%;4 株中有2 株对多西环素、红霉素、卡那霉素、诺氟沙星和链霉素产生完全耐药,耐药率为50%;4 株菌株中有1 株对头孢拉定和庆大霉素产生完全耐药,耐药率为25%。
2.4 耐药基因PCR 鉴定以qurB、tetA和sul2耐药基因为靶基因进行PCR 扩增鉴定,判定沙门氏菌的该种类耐药基因对相应药物的耐药性。其中,4 株沙门氏菌(菌株编号为8、10、16、29)对磺胺类药物耐药基因sul2和喹诺酮类耐药基因qurB基因检出率为0;而有2 株菌株(菌株编号为16、29)检出四环素类耐药基因tetA。
3 讨 论
沙门氏菌常存在于禽畜肉类及其制品中,人食用后可引发呕吐、腹泻等食物中毒症状。本研究结果显示,50 份猪肉及鸡鸭禽类样本中有4 份检出阳性,总检出率为8%,其中,禽类检出率为15%,猪肉检出率3.33%。彭峻烽等[11]对成都地区343 份鸭源样本检测结果显示沙门氏菌的分离率为28.86%;宋晟等[12]在长沙地区市场上采集的猪肉和鸡肉样本中沙门氏菌的检出率分别为83.8%和78.9%;郭耀东等[13]的检测结果表明,西安地区白条鸡在销售环节样品中沙门氏菌的检出率为18.75%;王莹等[14]在长春市售猪肉鸡肉中检出沙门氏菌比例为16.84%。此外,亚洲其他国家如泰国、马来西亚以及欧洲、非洲等其他地区近年也有在畜禽类产品中检测到沙门氏菌的报道[15−18]。由此可见,畜禽肉类生鲜产品存在的沙门氏菌污染情况在世界范围内依旧普遍。而本研究中,沙门氏菌检出率较低的原因可能是样品量来源于局部区域且数量较少,也与不同地区沙门氏菌流行情况不同有关。本研究结果同时显示,4 例检出样本中3 例是室内样本。因此,在室内情况下人口密度大、环境较封闭、局部温度高,细菌更易生存与繁殖。
目前,畜牧养殖过程中抗生素依旧是治疗动物沙门氏菌等病菌感染的主要药物,抗生素的广泛使用也导致沙门氏菌耐药范围逐渐扩大、耐药程度逐渐增加,对于预防和治疗相关疾病带来极大挑战[19]。本研究药敏试验结果显示,样品中分离的沙门氏菌对青霉素、氨苄西林、四环素、氯霉素、阿莫西林、磺胺异噁唑和吉他霉素具有很高的耐药性,而对头孢拉定、庆大霉素和环丙沙星不敏感,且对红霉素、卡那霉素、诺氟沙星和链霉素等也具有一定敏感性,4 株菌的耐药谱达到10 余种,因此具有多种耐药性。黄裕等[20]对深圳市畜禽产品中分离的沙门氏菌菌株进行药敏试验的结果显示,70 株沙门氏菌有24 种多重耐药谱,全部菌株对头孢唑啉、阿米卡星和庆大霉素耐药,对厄他培南、亚胺培南和美洛培南敏感。杜雄伟等[21]对大连市零售猪肉中分类的沙门氏菌检测发现其对硫酸庆大霉素、盐酸诺氟沙星、氟苯尼考和盐酸环丙沙星、阿莫西林、头孢噻吩、头孢噻肟、氨苄西林等均有耐药性,共产生10 种耐药谱。可见不同地区畜禽鲜肉中感染的沙门氏菌均具有较强的耐药性。本实验对分离的沙门氏菌株分别进行磺胺类(qurB)、四环素类(tetA)和喹诺酮类(sul2)耐药基因检测,结果发现只存在tetA耐药基因。李少博等[22]认为,食源性沙门氏菌的耐药性是由于编码沙门氏菌某些成分的基因发生突变而造成的,而抗性基因的嵌入以及通过基因的转移也能导致细菌耐药性不断增强。因此,检测食源沙门氏菌的耐药性有助于全面掌握耐药性的流行规律,为抗菌药物预警制度和遏制耐药性产生措施的建立和实施提供科学合理的依据。益生元、益生素、植物提取物(中草药)以及有机酸等通过改善肠道菌群结构及微生态环境从而对沙门氏菌的增殖起到一定的抑制作用,也在一定程度上能够逐渐解决抗生素使用而产生的细菌抗药性问题[23−24]。
目前,海南省海口市美兰区市场生鲜肉感染沙门氏菌的情况并不普遍,但分离得到的菌株具有较强的耐药性,可能在畜牧养殖业中存在抗生素使用的情况,相关部门应加强养殖过程中抗生素滥用的监管。同时,应重视畜禽动物养殖、屠宰、运输、加工、贮存及销售等环节的管理,明确海南市售生鲜肉沙门氏菌易感来源及关键环节,并进行针对性的防控;监管部门应对生鲜肉流通过程中所处环境进行监督, 督促相关人员对有关环节进行消毒和灭菌工作, 防止交叉感染, 降低沙门氏菌污染机率,以降低其感染人的风险,保证消费者的健康和安全。
