基于网络药理学探究灵宝护心丹治疗急性心肌梗死的潜在机制
2021-04-15史大卓马晓娟
谭 宇,史大卓,柴 华,马晓娟
急性心肌梗死(acute myocardial infarction,AMI)是指各种原因导致冠状动脉血供急剧减少或完全中断,使相应供血区域的心肌急性缺血性坏死的心血管疾病,是冠心病的严重类型,严重危害人类健康,是全球死亡的主要原因之一。《中国心血管病报告2018》概要指出:我国现有冠心病病人1 100万人,且冠心病的发病率、死亡率逐年升高,其中近20年AMI死亡率总体呈快速上升趋势[1]。根据马尔科夫模型预测,未来20年间中国将新增2 100万例急性冠状动脉事件,发生700万例心源性死亡[2]。既往大量研究表明,在常规西药治疗基础上联合应用中药,可有效缓解AMI病人的临床症状、降低AMI病人的心源性死亡风险、改善病人心功能及生活质量[3-5]。因此,积极探讨防治AMI的有效治疗药物具有极其重要的意义。
AMI在中医学古籍中没有确切病名记载,但对其症状及治疗早有论述。《素问·藏气法时论》: “心病者, 胸中痛, 胁支满, 胸背肩胛间痛, 两臂内痛。”《灵枢·厥病》: “真心痛, 手足青至节, 心痛甚, 旦发夕死, 夕发旦死。”这就是中医学文献对AMI并发休克的最早记载。《黄帝内经》认为此病与气虚、气滞、寒凝、血瘀、痰饮有关。汉代医家张仲景进行了进一步论述,认为其属胸痹心痛,《金匮要略》: “胸痛彻背, 背痛彻心。”其所描述的症状类似AMI发作,同时张仲景提出温通宣痹、通阳复脉的治疗原则至今仍对临床治疗AMI有重要影响。晋隋唐时期医家对AMI发病的认识发展为内虚致病论,多数医家认为病患多有内虚的同时,兼夹瘀血、痰热、寒邪等邪气所客从而发病,如《诸病源候论》提出了胸痹是正虚邪盛之病。唐朝孙思邈在《千金要方》中记载的多首方剂均是在前人所用药物基础上加用辛香通散之品。而明清医家将活血化瘀疗法发扬壮大,《医宗金鉴》中记载的颠倒木金散、《时方歌括》中记载的丹参饮、《医林改错》中的代表方剂血府逐瘀汤等, 都是采取活血化瘀法治疗胸痹的代表方。现代中医学认为AMI是由于心脉血瘀痹阻、痰瘀互结、心失所养所致,治法上应予活血化瘀、强心复脉,并佐以芳香开窍、解毒化痰之品为佳[6]。灵宝护心丹(LBHX)中所含中药大部分属心经,方中红参大补元气,三七益气活血又能止痛,使气足阳旺,血脉流通[7-8];合以麝香、蟾酥加强了强心作用,能提高冠状动脉流量,增强心肌收缩功能[9];牛黄既可清心解毒,又能解痉镇痛[10];麝香、苏合香、冰片不但芳香开窍,且可行气开郁,使瘀血痰浊,随气而化[11];再配以琥珀、丹参宁心安神、养血活血[12]。全方组成紧密,相辅相成,共达强心益气、通阳复脉之功,更有芳香开窍、活血镇痛之用。
网络药理学融合了系统生物学、多向药理学和计算生物学等多学科的技术手段和内容,能通过多层次网络的构建,从整体角度探索中药与不同疾病间的关联,为研究中药复方提供了一种从系统水平寻找潜在活性成分和作用靶点的新策略。因此,本研究采用网络药理学与分子模拟对接结合的方法,预测分析灵宝护心丹治疗AMI的多成分、多靶点和多途径的潜在作用机制,为进一步开展该方的实验研究工作奠定基础。
1 资料与方法
1.1 活性化合物的收集 通过中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)寻找灵宝护心丹中9 味中药化学成分,根据药物ADME参数(吸收、分布、代谢、排泄)进行筛选,纳入口服利用度(oral bioavailability,OB)≥30%且类药性(drug likeness,DL)≥0.18的活性化合物[13];从中医综合数据库(traditional Chinese medicines integrated database,TCMID)(http://119.3.41.228:8000/tcmid/)获得灵宝护心丹所含中药相关活性化合物[14];通过大规模文本挖掘获得灵宝护心丹中所含中药的活性化合物,所用数据库包括PubMed、Web of Science、中国知网。
1.2 药物靶标的识别 通过人类基因数据库(GeneCards)(https://www.genecards.org/)获得AMI相关基因,所选物种的条件为智人[15]。根据TCMSP和药物数据库(Drugbank)(https://www.drugbank.ca/#)检索和验证筛选所得化合物的作用靶标。通过蛋白数据库(UniProt)(http://www.uniprot.org/)对筛选的蛋白质靶标进行名称标准化处理,取其交集靶点作为灵宝护心丹治疗AMI的潜在作用靶标。在此之后,将这些修订后的靶标导入蛋白互作数据库(String 11.0)(https://string-db.org/)预测相关的蛋白质相互作用,以获得与AMI给定基因具有直接(物理)和间接(功能)相互作用的目标基因。
1.3 化合物-靶标(C-T)网络的构建与拓扑分析 为了全面了解灵宝护心丹治疗AMI的分子机制,构建了化合物-靶标(Compunds-Target,C-T)网络。利用开源生物信息学软件Cytoscape 3.7.2生成并可视化该二维互作网络。在此图形网络中,节点表示化合物或作用靶标,边代表不同节点之间的交互作用。随后,对该网络中节点的多个拓扑参数进行分析。这些拓扑参数包括度中心性(degree centrality,DC)、中间中心度(betweenness centrality,BC)、紧密中心性(closeness centrality,CC)、拓扑系数(topological coefficient,TC)。
1.4 基因本体(GO)功能和京都基因与基因组百科全书(KEGG)通路富集分析 通过鉴定AMI相关靶基因的生物学途径以分析灵宝护心丹的作用机制及其药效学作用,基于GO和KEGG数据库, 采用Cytoscape软件所含插件ClueGO +Cluepedia生成蛋白质途径,构建Target-Pathway网络,程序参数如下[16]:Analysis Mode: ClueGo: Functions; Load Marker List(s):HomoSapiens[9606];ClueGO Settings:Ontologies/Pathways:KEGG;Network Specificity:Medium。另外,将P≤0.05作为通路聚类标准。ClueGO网络是根据Kappa值进行统计而建立的,并基于相似度反映不同条目之间的关系。在通路分析的基础上,利用ClueGO软件对多个亚组的重叠靶标进行生物过程(biological process,BP)分析,以探索功能相互作用。
1.5 蛋白质-蛋白质相互作用(PPI)网络的构建 利用蛋白质互作关系预测数据库(GeneMANIA)(http://genemania.org/)构建靶基因蛋白互作网络,以分析其蛋白互作关系[17]。该数据库集成了多种生物特有的功能基因组学和蛋白质组学数据源,包括来自基因表达公共数据库(gene expression omnibus,GEO)(http://www.ncbi.nlm.nih.gov/geo/)的共表达数据;来自蛋白质和遗传相互作用数据库(biological general repository for interaction datasets,BioGRID)(https://thebiogrid.org/)的物理和遗传相互作用数据;基于蛋白质相互作用数据库(Interologous Interaction Database,I2D)(http://ophid.utoronto.ca/ophidv2.204/links.jsp)的同源蛋白质预测数据;来源于生物通路数据库(pathway commons,PC)(http://www.pathwaycommons.org/),和人类相关蛋白数据库(human protein reference database,HPRD)(http://www.hprd.org/)等数据库的通路和分子相互作用数据。
1.6 化合物-靶标蛋白的分子模拟对接 利用分子对接模拟软件Autodock Vina 1.1.2,对关键药效分子与核心靶标进行配体-受体对接模拟计算[18]。具体流程:从蛋白质数据库(RCSB PDB database) (https://www.rcsb.org/)下载靶标的3D蛋白质结构,利用分子三维结构显示软件PyMoL 1.7.2.1将蛋白与其配体进行拆分,同时将去除配体后的蛋白及其分离出的配体由pdb格式转为pdbqt格式。从有机小分子活性化合物数据库(PubChem)(https://pubchem.ncbi.nlm.nih.gov/)下载灵宝护心丹所含核心化合物的3D结构,利用Chem Bio Office 2014将小分子化合物由mol2格式转化为pdbqt格式。通过将蛋白及其原配体输入分子对接辅助软件Auto Dock Tools-1.5.6,以寻找靶标蛋白结构中的配体-受体对接位置,活性口袋中心被定义为40×40×40的三维网格,网格间距为0.375。利用对接主程序Autodock Vina 1.1.2将靶标蛋白与小分子化合物进行配体-受体分子模拟对接,根据两者对接的最低结合能值评估靶标蛋白与药效分子的结合稳定性。
2 结 果
2.1 灵宝护心丹化合物-靶点网络的构建及拓扑分析 根据OB及DL的阈值,剔除缺乏预测靶点的化合物,并结合多方数据库以及既往文献报道,最终筛选出104个活性化合物。其中麝香3个活性化合物,蟾酥7个活性化合物,琥珀6个活性化合物,人工牛黄5个活性化合物,冰片3个活性化合物,苏合香3个活性化合物,丹参65个活性化合物,红参4个活性化合物,三七8个活性化合物。利用104个活性化合物与57个疾病靶点之间的互作关系构建化合物-靶点网络(见图1),其中红色节点代表丹参,浅绿色节点代表琥珀,紫色节点代表红参,褐色节点代表人工牛黄,天蓝色节点代表苏合香,深绿色节点代表三七,深蓝色节点代表麝香,粉色节点代表冰片,黄色节点代表蟾酥,橙色节点代表靶点。在此化合物-靶点互作网络中共有161个节点(57个疾病靶点节点,104个活性化合物节点)和840条边。每条边代表化合物与对应靶点之间的互作关系。
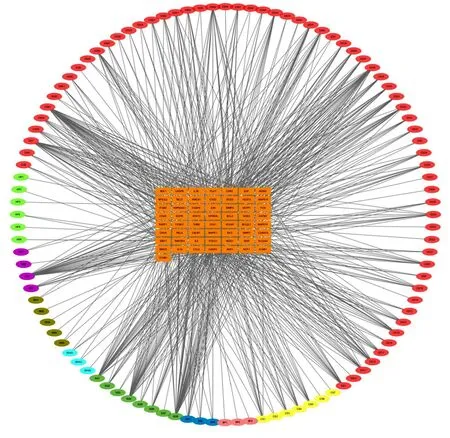
图1 灵宝护心丹治疗AMI化合物-靶点互作网络
利用Cytoscape软件中的网络拓扑计算工具Network Analyzer对该网络中的节点的拓扑系数进行分析,degree的中位数2倍为10,BC、CC、TC的中位数分别为0.001 478 38,0.383 248 73,0.300 653 59,核心节点需满足以上拓扑参数的中位数卡值,所有节点分布情况见图2。结果显示共有12个疾病靶点满足以上卡值,列出这些核心靶点的拓扑数值(见表1),从表1中可见各靶点的degree值,叉头转录因子[Forkhead box protein O1(FoxO1),77];沉默信息调节因子-1(NAD-dependent protein deacetylase sirtuin-1,Sirt1,72);Caspase-3(CASP3),65;Interleukin-6(IL-6),57;RAC-alpha serine/threonine-protein kinase(AKT1),55;Superoxide dismutase[Mn](SOD2),54;Bcl2-associated agonist of cell death(Bcl2),46;Apoptosis regulator Bax(Bax),39;Signal transducer and activator of transcription 3(STAT3),27;matrix metalloproteinase-9(MMP-9),17;mitogen-activated protein kinase 1(MAPK1),16;SLC2A4 regulator(SLC2A4),12。
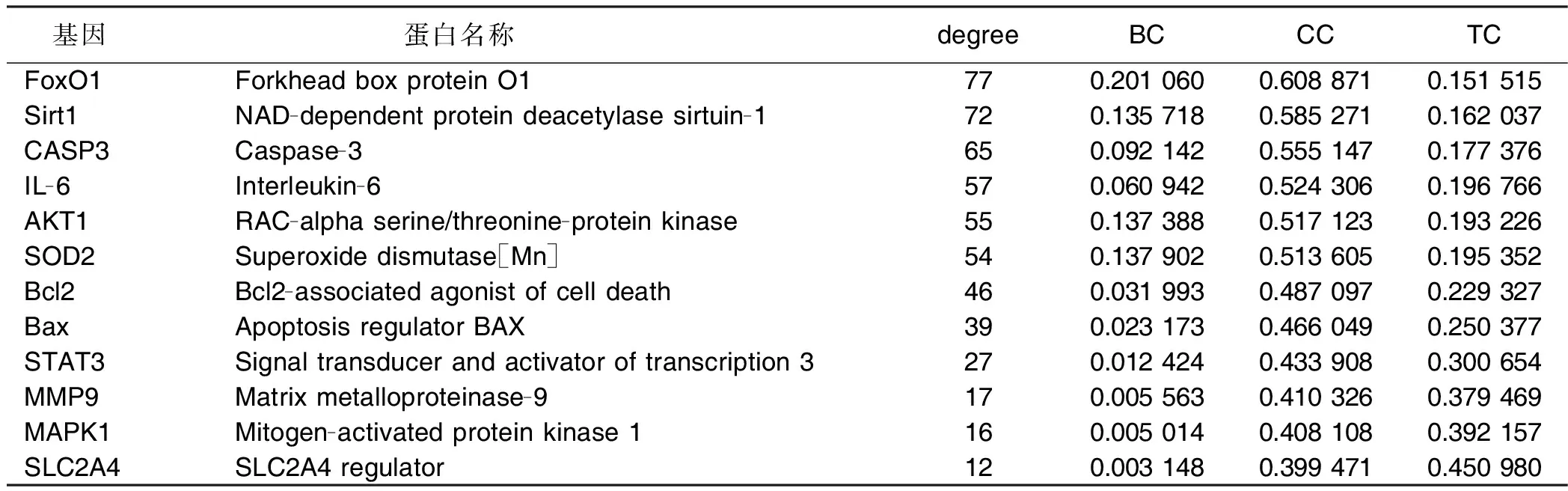
表1 灵宝护心丹治疗AMI化合物-靶点互作网络核心靶点拓扑参数
通过对C-T网络中代表活性化合物的节点进行拓扑学参数分析,可以挖掘出灵宝护心丹中相对重要的活性化合物,并列出所有化合物的OB及DL值(见表2)。这些degree值高的靶点和化合物可能在灵宝护心丹治疗AMI的过程中发挥重要作用。

图2 灵宝护心丹治疗AMI化合物-靶点互作网络核心节点拓扑参数分布情况
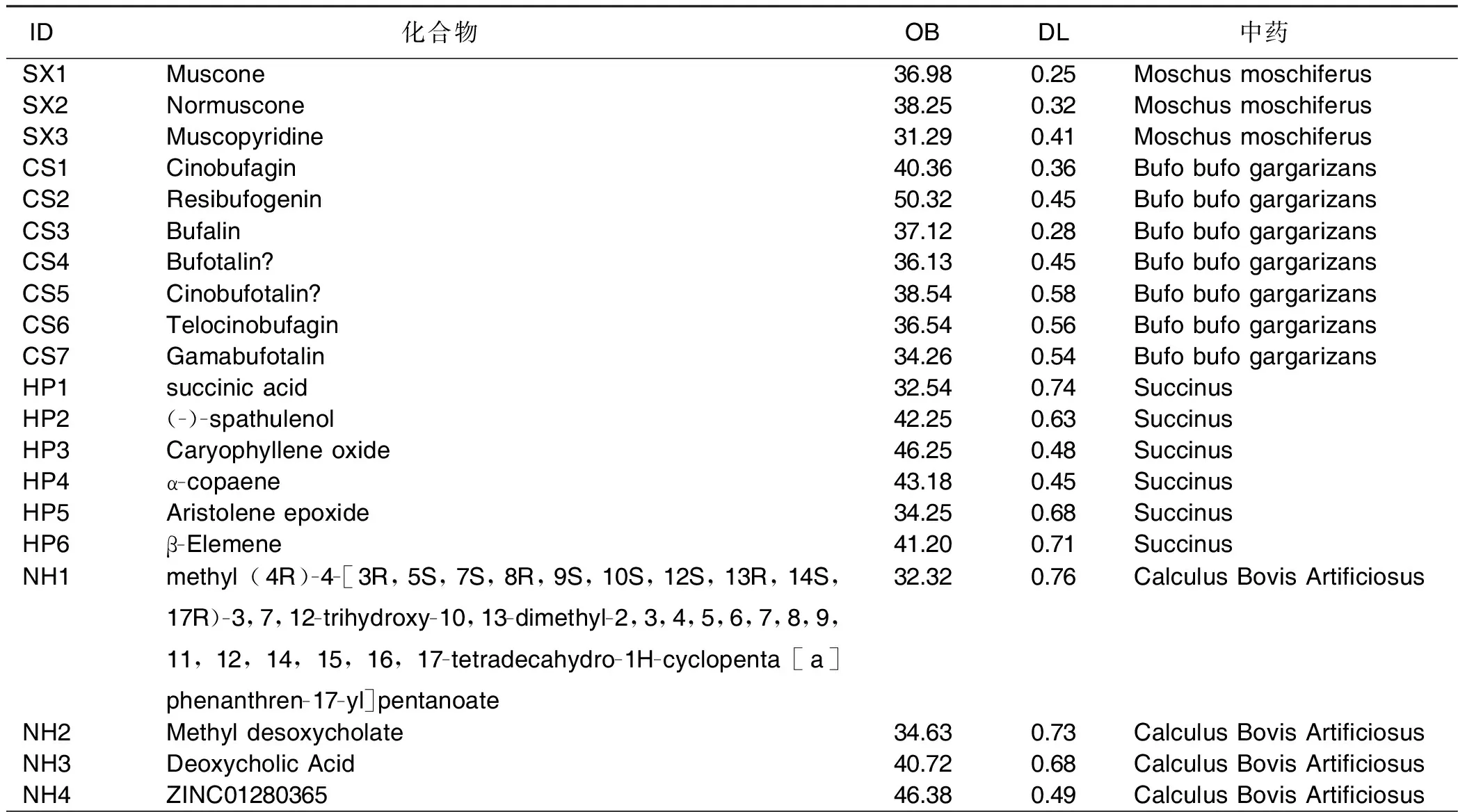
表2 灵宝护心丹所含活性化合物信息
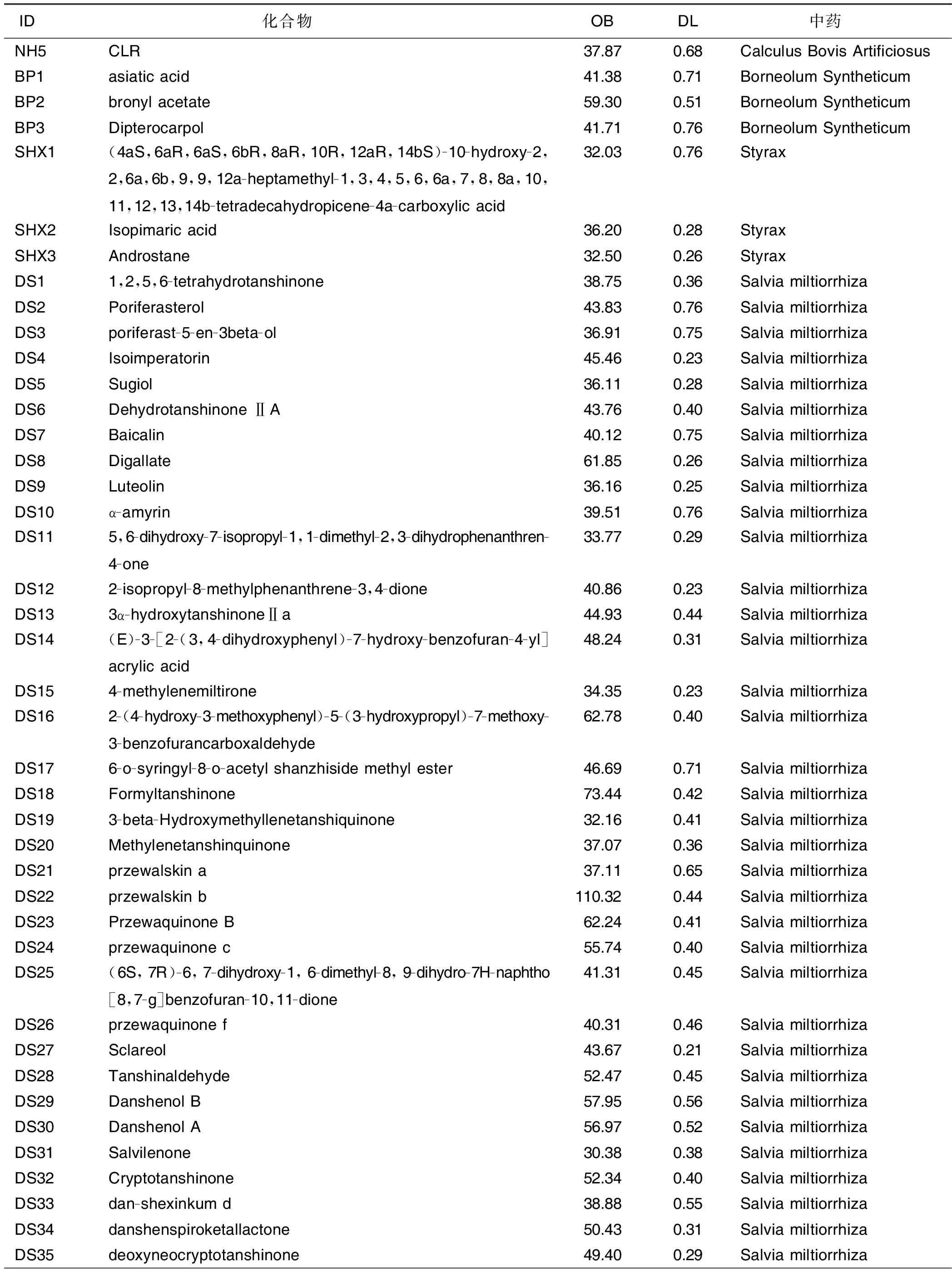
(续表)
(续表)
2.2 靶点生物功能及靶点-通路分析 使用ClueGO KEGG通路富集功能对57个疾病靶点进行系统生物学分析以探索其靶基因功能。结果表明57个靶基因被定位到111个通路上,并且被分类为16个具有统计学意义的亚组。这些亚组中的基因主要被富集于以下通路:Viral myocarditis(KEGG:05416),Fluid shear stress and atherosclerosis(KEGG:05418),Leukocyte transendothelial migration(KEGG:04670),Longevity regulating pathway (KEGG:04211),p53 signaling pathway(KEGG:04115),HIF-1 signaling pathway(KEGG:04066),FoxO signaling pathway(KEGG:04068),Apoptosis(KEGG:04215),Measles(KEGG:05162),Pancreatic cancer(KEGG:05212),Relaxin signaling pathway(KEGG:04926),NF-kappa B signaling pathway(KEGG:04064),Chronic myeloid leukemia(KEGG:05220),Pertussis(KEGG:05133),Human papillomavirus infection(KEGG:05165),Necroptosis(KEGG:04217)。详见图3。通过对各亚组中所富集的基因进行分析,发现上述C-T网络中的12个关键靶点基因在不同亚组中亦具有重叠,表明这些基因在通路网络中也扮演重要作用。因此,运用ClueGO BP分析功能对这些基因进行生物过程富集分析,以探索它们之间的功能相互作用(见图4)。结果表明这些基因富集出73个条目,主要包括以下生物学过程:cellular response to cadmium ion(GO:0071276),leukocyte homeostasis(GO:0001776),negative regulation of oxidative stress-induced intrinsic apoptotic signaling pathway(GO:1902176),leukocyte apoptotic process(GO:0071887),apoptotic mitochondrial changes(GO:0008637),leukocyte apoptotic process(GO:0071887),regulation of oxidative stress-induced cell death(GO:1903201)。
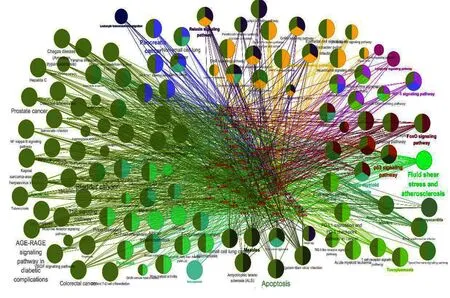
图3 57个关键疾病靶点ClueGO KEGG通路富集

图4 12个关键靶点基因的生物学过程亚组分析
2.3 PPI网络的构建和分析 利用Cytoscape插件GeneMANIA将12个关键基因构建可视化的PPI网络,其中共包括32个基因节点(见图5)。结果表明这些基因间的相互作用关系类型主要为以下几种:Pathway占38.15%,Predicted占31.49%,Co-expression占15.01%,Physical Interactions占9.45%,Co-localization占3.1%,Shared protein domains占2.78%。并列出由这12个关键基因具有统计学意义的前20个重要生物学功能,包括cellular response to peptide hormone stimulus(GO:0071375),response to peptide hormone(GO:0043434),cellular response to peptide(GO:1901653),response to peptide(GO:1901652),neurotrophin TRK receptor signaling pathway(GO:0048011),neurotrophin signaling pathway(GO:0038179),regulation of cellular response to stress(GO:0080135),intrinsic apoptotic signaling pathway(GO:0097193)。详见表3。
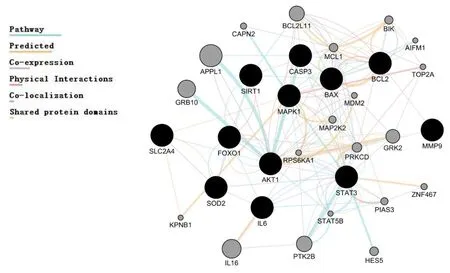
图5 12个关键基因构建的蛋白靶点PPI互作网络

表3 关键靶点的生物学功能分析
2.4 分子对接模拟 对灵宝护心丹中的核心活性化合物和C-T网络中的关键靶点进行配体-受体分子对接模拟,以最低结合能评估化合物与靶标蛋白结合的稳定性,结合能越小表明二者结合的稳定性越好。结果显示,3个核心活性化合物与核心靶标蛋白Sirt1、FoxO1、CASP3的结合能均小于-5.0 kJ/mol,表明这些化合物与以上蛋白结合较稳定。详见图6。
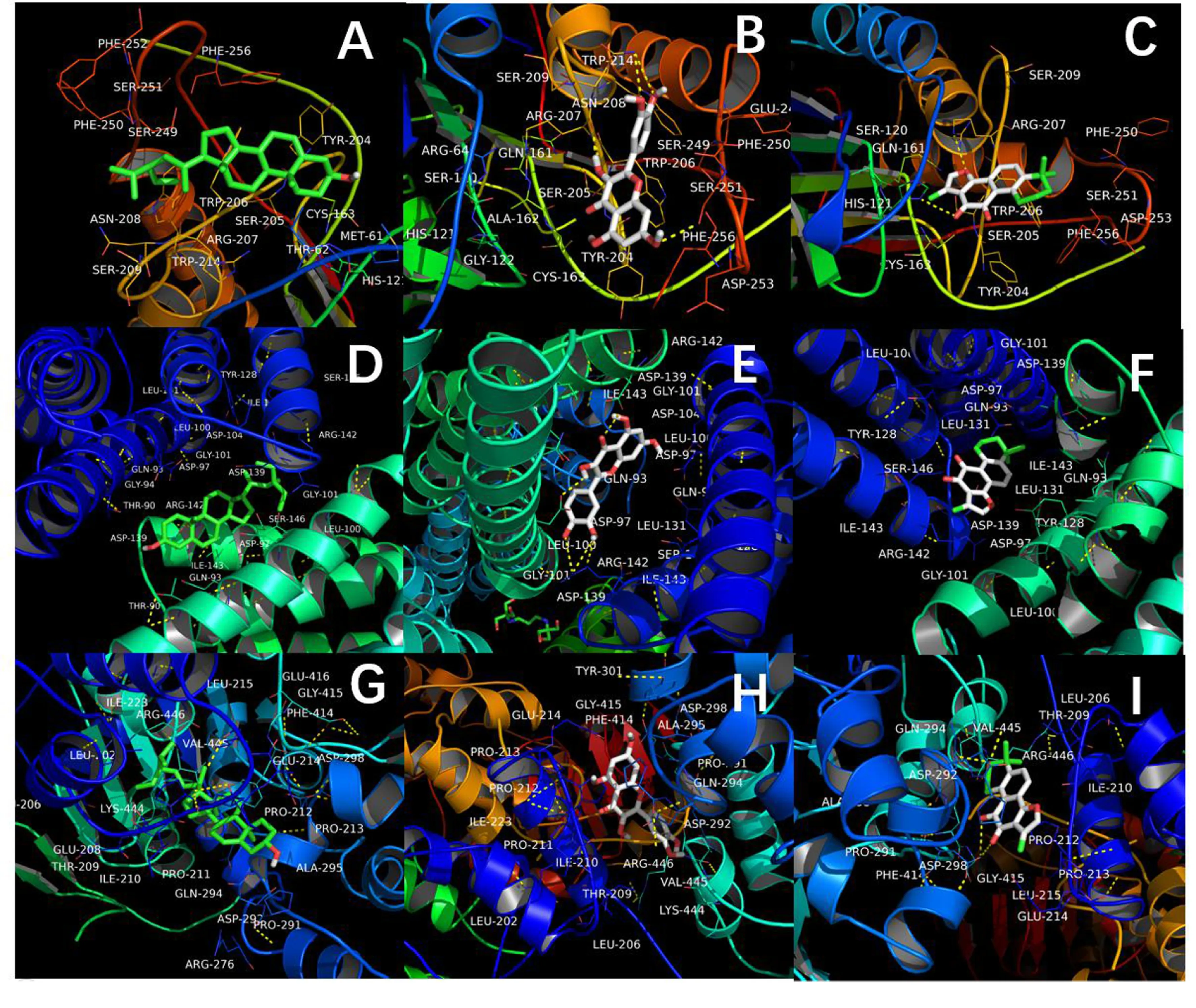
图6 关键活性化合物与核心靶点蛋白分子模拟对接
3 讨 论
灵宝护心丹具有强心益气、通阳复脉、芳香开窍、活血镇痛之功效,临床用于冠心病心绞痛及气虚血瘀所致的胸痹,症见胸闷气短、心前区疼痛、脉结代者,具有良好的临床疗效。本研究基于生物信息学及网络拓扑的策略,预测灵宝护心丹治疗AMI的靶点,探索灵宝护心丹治疗AMI的潜在机制,为进一步研究灵宝护心丹的疗效作用提供科学依据。
3.1 灵宝护心丹治疗AMI的关键蛋白靶点及其生物学功能分析 鉴定与疾病发生有关的重要靶蛋白对于探索灵宝护心丹治疗AMI的分子机制至关重要,对此本研究构建了化合物-靶标网络,并对该网络中节点的多个拓扑参数进行分析以筛选出关键作用靶标。该网络包含161个节点和840条边,通过计算所有节点的拓扑参数获得了12个关键基因,包括FoxO1、Sirt1、CASP3、IL-6、AKT1、SOD2、Bcl2、Bax、STAT3、MMP9、MAPK1、SLC2A4。同时,通过对所有基因进行生物信息学分析发现,这些基因在KEGG富集网络中的不同亚组间具有重叠性,这证明这些基因在C-T网络以及通路网络中同时承担了关键节点的作用。根据基因功能分类,结果显示灵宝护心丹的药效作用可影响多种AMI的病理过程,不仅集中在调节氧化应激诱导的细胞凋亡上(FoxO1、Sirt1、CASP3、SOD2、Bcl2、Bax),同时对炎症反应亦有调节作用(IL-6、AKT1、STAT3、MMP9、MAPK1、SLC2A4)。 Sirt1是NAD+依赖性蛋白脱乙酰酶,在细胞分化、衰老、凋亡、生理节律、代谢调控、转录调节、信号转导、氧化应激等多种重要的生物学过程中发挥重要作用[19]。过往有急性心肌缺血和缺血预处理动物实验表明Sirt1通过抗氧化、抗炎、减少凋亡等机制发挥心肌保护作用[20]。FoxO1是Sirt1的下游底物,Sirt1通过使FoxO1去乙酰化从而刺激其介导的细胞保护效应的基因表达,已有研究表明Sirt1通过FoxO1刺激转录,并增强损伤/修复(I/R)诱导的FoxO1在心脏的核定位[21]。FoxO1转录因子属于FoxO家族成员,主要参与细胞凋亡、应激、DNA损伤/修复、肿瘤发生、血管生成和糖代谢等生命过程。Sirt1可通过激活FoxO1对SOD2、Bax等下游细胞因子起到调控作用[22]。炎症反应是心肌梗死后心室重构、心功能恶化的重要诱因之一,可进一步引发血管功能失调、细胞凋亡、心肌纤维化等病理改变。心肌梗死后,由于组织缺血缺氧、室壁张力增加等引发心肌组织坏死并释放抗原性物质、黏附分子、补体、激肽等多种炎症介质引发急性炎症反应,诱导单核细胞、巨噬细胞等炎性细胞趋化,并聚集于梗死部位,释放白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1β,IL-1β)、细胞间黏附分子-1(intercellular adhesion molecule 1,ICAM-1)等多种细胞因子,进一步扩大炎症反应的形成以清除坏死细胞,并促进坏死组织的吸收和损伤组织的修复[23]。
3.2 灵宝护心丹治疗AMI的关键信号转导通路 本研究基于kappa分析对57个靶点构建KEGG功能分组网络。通过对网络中的16个功能亚组分析发现,其中涉及多个与AMI病理过程相关的信号通路,包括缺氧诱导因子(HIF-1)信号通路、FoxO信号通路、凋亡信号通路、核因子-κB(NF-κB)信号通路。
3.2.1 NF-κB信号通路 NF-κB是心脏应激反应快速表达基因,当细胞受到活性氧(ROS)等外界因素刺激时,通过一个或多个信号转导途径激活蛋白激酶,致使胞浆中的NF-κB三聚体复合物中的IκB的活化,迅速发生核易位,与特异性κB序列结合而启动靶基因转录, 参与包括炎症、凋亡在内的多种生物学反应[24]。Na等[25]发现藤黄可以降低诱导型一氧化氮合酶(iNOS)、基质金属蛋白酶(MMP)-2、MMP-9、ICAM-1、IL-6和TNF-α在心肌梗死大鼠中表达水平,其机制可能与抑制NF-κB/p38途径的激活有关。
3.2.2 HIF-1信号通路 HIF-1是一种转录因子,在许多动物物种中均起着主要氧稳态调节器的作用。 HIF-1通过调节血管生成和血管重塑来控制氧气的输送,并通过调节葡萄糖代谢和氧化还原稳态来控制氧气的利用[26]。动物模型分析表明,通过激活这些稳态机制,HIF-1信号通路在缺血性心脏病和压力超负荷心力衰竭的病理生理过程中起着至关重要的保护作用[27]。Yu 等[28]研究了阿托伐他汀联合常规治疗对AMI大鼠HIF-1和血管内皮生长因子(VEGF)表达的影响及其治疗效果,结果表明阿托伐他汀联合常规治疗相比单一常规治疗能更好地降低大鼠血清HIF-1和VEGF水平,从而改善左心室功能。
3.2.3 FoxO信号通路 FoxO1是一种主要位于细胞核中的转录因子,其通过翻译后修饰,包括磷酸化、乙酰化、泛素化等多种途径调节其下游基因的表达,从而参与凋亡、自噬、氧化应激、细胞增殖和代谢失调等多种生理病理过程[29]。Zhao等[30]研究观察到利用lncRNA MEG3模拟物转染低氧心肌细胞后,可以显著增加低氧状态下心肌细胞中的FoxO1表达量,抑制心肌细胞的增殖速率,加速心肌细胞的凋亡速率。Qiu等[31]细胞实验研究发现,运用si-RNA转染技术的H9c2心肌缺氧细胞中,miR-370可通过靶向FoxO1抑制H2O2诱导的H9c2细胞的氧化应激损伤和细胞凋亡。
3.3 灵宝护心丹所含关键活性化合物及其药理学作用 通过对化合物-靶标网络中活性化合物节点的拓扑参数进行分析发现,槲皮素(degree为39)、β-谷甾醇(degree为37)、丹参酮ⅡA(degree为31)的degree值排名靠前,证明其在化合物-靶标网络中处于核心位置。结合分子模拟对接的结果,槲皮素、β-谷甾醇、丹参酮ⅡA与核心靶标蛋白Sirt1、FoxO1、CASP3的结合能均小于-5.0 kJ/mol,表明这些化合物与以上蛋白结合较稳定。槲皮素是一种类黄酮,具有抗氧化活性,具有心肌保护作用。Chen等[32]研究报道使用槲皮素预处理可降低原代心肌细胞中乳酸脱氢酶的含量和Caspase-3活性,降低丙二醛含量和ROS水平,并且减少凋亡细胞的百分比,同时发现通过使用pAD/14-3-3γ-shRNA抑制14-3-3γ表达,则将削弱上述心脏保护作用,这证明槲皮素可以通过抑制氧化应激并通过14-3-3γ改善线粒体功能来保护心肌细胞。丹参酮ⅡA是一种二萜醌类化合物,具有多种药理活性,包括抗氧化、抗炎和抗凋亡作用。Wei等[33]研究证明丹参酮ⅡA磺酸钠可以通过干预ERK(1/2)/Nrf2/HO-1/AMPK/ACC/CPT1通路,上调抗氧化系统相关蛋白表达,改善心肌梗死大鼠的心脏功能障碍和心肌酶谱的变化,发挥心肌梗死大鼠的心脏保护作用。β-谷甾醇是一种植物甾醇类成分,可影响多种细胞信号通路,包括细胞周期、细胞凋亡、细胞增殖、血管生成炎症。Wong等[34]实验证明β-谷甾醇可刺激H9c2心肌细胞线粒体的ATP生成能力,增加细胞谷胱甘肽氧化还原循环反应,抑制缺氧/复氧诱导的H9c2细胞凋亡反应,同时发现在心肌缺血/再灌注损伤大鼠中β-谷甾醇可能通过上调线粒体谷胱甘肽氧化还原循环发挥心脏保护作用。
综上所述,本研究通过网络药理学的方法探讨了灵宝护心丹治疗AMI的潜在分子机制,灵宝护心丹由9味药物组成,其含有的多种活性化合物通过作用于不同靶标蛋白、不同信号转导通路发挥对AMI的治疗作用,体现了中药复方协同性、系统性的特点。研究结果发现,灵宝护心丹可能通过以下途径发挥其治疗作用:①作用于FoxO1信号通路,通过抑制氧化应激作用诱导的内源性细胞凋亡,控制线粒体损伤,减少ROS的产生,从而发挥对缺血心肌细胞的保护作用;②作用于NF-κB信号通路,调节TNF-α、IL-6、 IL-1β、ICAM-1等多种细胞因子的表达,减少心肌梗死后由于组织缺血缺氧、室壁张力增加等引发的心肌组织坏死,抑制急性炎症反应,挽救缺血心肌组织。本研究运用网络药理学以及结合分子模拟对接的方法,预测了灵宝护心丹治疗AMI的相关信号通路,为后续的疗效机制研究提供了依据和方向。
