邻苯二甲酸二丁酯对电活性生物膜性能影响及机制
2021-04-15王沛芳张艺璇张语航
王沛芳,张艺璇,董 跃,张语航,王 超
(1.河海大学浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 210098;2.河海大学环境学院,江苏 南京 210098)
邻苯二甲酸二丁酯(dibutyl phthalate,DBP)属于邻苯二甲酸酯(phthalate esters,PAEs)中的一种,分子式为C16H22O4(C6H4(COOC4H9)2),是塑料制品中最常用的增塑剂[1],广泛存在于水、空气和食物中[2-3]。表1为我国部分地区地表水和市政污水处理厂进水中DBP平均质量浓度[4-15]。可见,我国的地表水[4-5]和市政污水[6-7]中均含有不同浓度的DBP,且在人口密度和经济发展水平越高的地区,水体尤其是市政污水中的DBP污染负荷越高[8-10]。
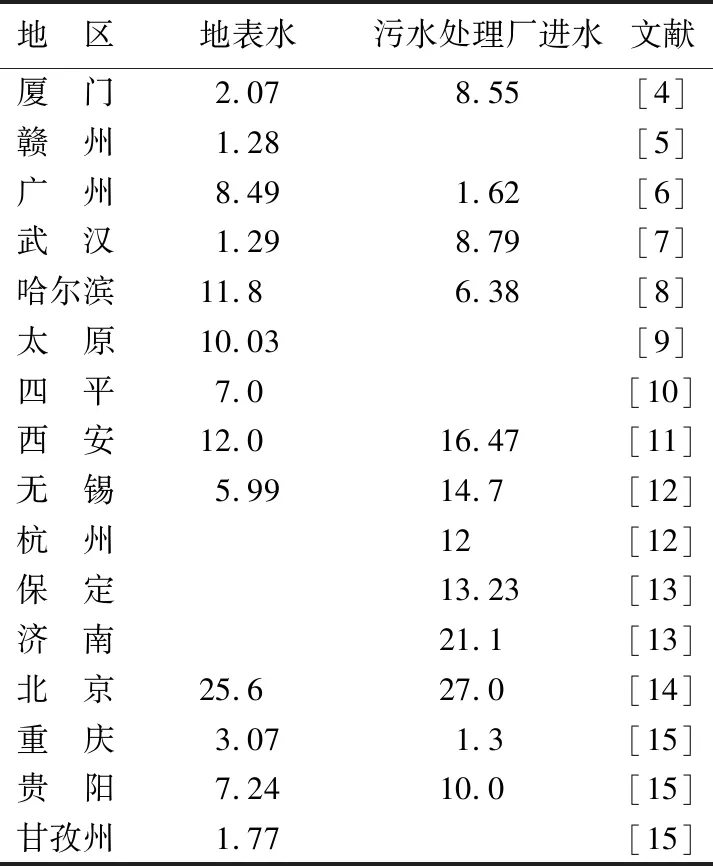
表1 我国部分地区地表水和市政污水处理厂进水中DBP平均质量浓度
生物电化学系统(bioelectrochemical system,BES)是利用电活性菌的胞外电子传递能力回收生物质能源的装置。在BES中,阳极上生长着一层电活性生物膜(electroactive biofilm,EAB),主要由电活性菌群和微生物分泌的胞外聚合物(extracellular polymer substances,EPS)组成,能将有机污染物降解过程产生的氧化电子直接转移到阳极,并在外电路中形成电流。BES在市政污水可持续处理领域具有重要的应用价值,工程化的EAB性能受到污水中有机物类型和浓度的显著影响,对污水中的有毒有害物质十分敏感,并最终影响其污水处理能力[16-17]。
DBP会影响微生物的生长代谢。研究发现随着DBP质量浓度增大,生物膜中的微生物代谢活动变得缓慢[18],暴露于DBP中的细菌细胞形状不规则,细胞壁破碎,细胞质出现空泡现象,细胞内物质含量减少,核糖体萎缩甚至消失[19]。因此污水中广泛存在的DBP必然会对EAB性能产生影响,并最终影响EAB降解有机污染物的效能。目前,DBP对EAB性能的影响研究仍不多见,且研究对象局限于BES的电流产出,并未深入挖掘DBP对EAB在组成结构、群落演变等方面的影响,无法系统阐明其影响机制。

图1 反应器设计Fig.1 Reactor design
本文通过对不同质量浓度DBP条件下EAB输出电压和功率的监测,考察DBP对EAB产电活性的影响;通过对EAB外包裹EPS成分和含量的分析,揭示DBP刺激下EPS的变化规律,并对不同质量浓度DBP条件下EAB反馈和防御机制进行分析;通过分析EAB上微生物群落的组成和相对丰度的改变,找出DBP影响下的优势菌群。通过上述研究,最终明晰DBP对EAB性能的影响及机制,以期为EAB用于市政污水处理的实践提供预测。
1 试验材料和方法
1.1 BES反应器构建和运行
试验所用的反应器为双室BES反应器(图1),该反应器由有机玻璃制成,分为阳极室和阴极室,阴极室和阳极室之间由阳离子交换膜(Nafion117,美国杜邦公司)分隔,并通过硅胶垫密封。反应器的阳极由平行并联的碳纤维刷(长8 cm、直径2 cm,T700SC-24000,日本东丽公司)组成,阳极室尺寸为长4 cm、宽4 cm、高12 cm;阴极为石墨片(长4 cm、高9 cm、厚1 cm,99.9%,河北盛世达金属公司),阴极室尺寸为长4 cm、宽4 cm、高12 cm。阳极和阴极室顶部各设置两个直径为1 cm的孔,用于换液及取样分析。
接种菌来自实验室内已稳定运行1 a的BES出水。阳极液为人工合成废水,组成成分为质量浓度为1 g/L的CH3COONa、质量浓度为0.31 g/L的NH4Cl、质量浓度为0.13 g/L的KCl、质量浓度为10.32 g/L的Na2HPO4·12H2O、质量浓度为3.32 g/L的Na2HPO4·2H2O;每升合成废水加入1 mL的微量元素和维生素溶液,其成分包括质量浓度为25 g/L的氨三乙酸、质量浓度为37.5 g/L的七水硫酸镁、质量浓度为6.25 g/L的一水硫酸锰、质量浓度为12.5 g/L的氯化钠、质量浓度为1.25 g/L的七水硫酸亚铁、质量浓度为1.25 g/L的二水氯化钙、质量浓度为1.25 g/L的六水氯化钴、质量浓度为1.625 g/L的氯化锌、质量浓度为0.125 g/L的五水硫酸铜、质量浓度为0.125 g/L的十二水硫酸铝钾、质量浓度为0.125 g/L的硼酸、质量浓度为0.312 5 g/L的二水钼酸钠、质量浓度为0.312 5 g/L的六水氯化镍、质量浓度为0.312 5 g/L的二水钨酸钠、质量浓度为10 g/L的生物素(维生素H)、质量浓度为10 g/L的叶酸(维生素B9)、质量浓度为50 g/L的维生素B6、质量浓度为25 g/L的核黄素(维生素B2)、质量浓度为25 g/L的硫胺(维生素B1)、质量浓度为25 g/L的烟碱酸(维生素B3)、质量浓度为25 g/L的泛酸(维生素B5)、质量浓度为0.5 g/L的维生素B12、质量浓度为25 g/L的P-氨基苯酸、质量浓度为25 g/L的硫辛酸;控制DBP的质量浓度分别为0、1 mg/L、10 mg/L。阴极液为铁氰化钾溶液,组成成分为质量浓度为16.462 g/L的K3[Fe(CN)6]、质量浓度为3.725 g/L的KCl。在30℃的恒温箱内,同步启动3组BES反应器,每组设定3个平行,阴极和阳极之间连接200 Ω电阻,当输出电压小于60 mV时更换底物。系统稳定运行6个月。
1.2 电化学数据采集
BES的输出电压由安捷伦数据采集器连续采集,测得的数据每30 min记录1次。以运行时间t为横坐标,输出电压U为纵坐标作图可得输出电压曲线。在BES输出功率测试前,首先保持开路12 h以达到稳态,并逐渐连接阻值1 000 Ω至10 Ω的电阻,每个阻值稳定30 min,获得BES的功率密度曲线。
利用循环伏安法(cyclic voltammetry,CV)表征不同DBP质量浓度下EAB电化学活性的差异。CV的测定通过电化学工作站(CHI660,上海辰华)来完成,采用三电极体系,工作电极与阳极相连,参比电极连接饱和Ag/AgCl电极,辅助电极连接阴极。扫描电压为-0.6~0.4 V,扫描速率为1 mV/s。
1.3 EAB微观形貌观察
通过扫描电子显微镜(scanning electron microscope,简称SEM,JSM-7001F,日本电子株式会社)对阳极表面附着的EAB进行微观形貌观察,EAB预处理流程为:先以0.1 mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)清洗3次后加入2.5%的戊二醛溶液,在4 ℃冰箱中固定12 h使微生物细胞形态保持完好;然后以50%、70%、90%及100%的乙醇溶液逐级梯度脱水,每种溶液下脱水5 min,最后用氮气彻底吹脱;放入冷冻干燥机中干燥12 h,观测前将生物膜样品进行喷金处理,使样品表面镀上高导电的金属膜,最后放入真空样品室进行观测。
通过共聚焦激光扫描显微镜(confocal laser scanning microscopy,简称CLSM,CarlZeissLSM880,德国蔡司公司)来观测EAB表面EPS中蛋白质和多糖的分布状况。EAB样品的预处理过程为:首先用30 μL浓度为0.1 mol/L的NaHCO3溶液覆盖生物膜,使胺基处于去质子化状态;然后依次使用10 μL质量浓度为1 g/L的异硫氰酸荧光素(fluorescein-isothiocyanate,FITC)、20 μL质量浓度为0.25 g/L刀豆蛋白A(concanavalin A,Con A)、20 μL质量浓度为0.30 g/L荧光增白剂(calcofluor white,CW)溶液进行避光染色,每种染色剂染色时间分别为1 h、0.5 h、0.5 h;染色完成后用PBS缓冲液清洗多余染料,进行观测。
1.4 EPS的提取和测量
使用包括离心、超声处理和热提取的方法提取松散结合型EPS(loosely bound EPS, LB-EPS)和紧密结合型EPS(tightly bound EPS, TB-EPS)。提取步骤为:首先取1 cm2生物膜用蒸馏水配制成10 mL混合液,3 000 g离心10 min以除去黏液;其次将沉淀物依次重悬在0.05 g/L的NaCl溶液,20 kHz超声处理2 min,150 r/min水平振动15 min,8 000 g离心10 min后,通过0.22 μm醋酸纤维素膜过滤,得到LB-EPS;再次使用0.05 g/L的NaCl溶液将残留的沉淀物重悬至初始体积,并在20 kHz下超声处理2 min,随后60℃加热30 min,最后12 000 g离心20 min,通过0.22 μm醋酸纤维素膜过滤,得到TB-EPS。分析LB-EPS和TB-EPS的组分,使用TOC分析仪(Liqui TOC Ⅱ,德国元素公司)测定总有机碳(total organic carbon,TOC),利用单位质量挥发性悬浮固体中含有的TOC质量来反映LB-EPS和TB-EPS含量;用葡萄糖配制标准液,使用蒽酮-硫酸法测量多糖(polysaccharide,PS)含量[20];用牛血清白蛋白配制标准液,使用改良的Lowry方法测量蛋白质(protein,PRO)含量[21]。
1.5 微生物群落分析
BES运行6个月后收集生物膜样品,用土壤DNA提取试剂盒(power soil DNA isolation kit,美国Mobio公司)提取总DNA。以微生物总DNA为模板,以细菌16S rDNA V4区为目的扩增区域,引物为515F(GTGCCAGCMGCCGCGGTAA)和909R(CCCCGYCAATTCMTTTRAGT)。对扩增子进行高通量测序(基于上海美吉公司Illumina Hiseq平台),以相似性97%为标准获得操作分类单元(operational taxonomic units,OTU),并对微生物群落的多样性、种类组成和相对丰度、群落在属水平的主成分进行分析[22]。
2 结果与分析
2.1 不同DBP质量浓度对BES电化学性能和EAB电化学活性的影响
为了考察投加DBP对BES产电性能的影响,对BES输出电压进行记录。图2(a)为不同DBP质量浓度下BES反应器的电压输出情况,可以看出,未投加DBP的对照组的输出电压有较长的平台期(106 h),且在更换底物后,电压上升到峰值的时间较短,而随着DBP质量浓度增大,BES最大输出电压逐渐下降。对照组的反应器产电性能最好,电压上升快,在约210 h的产电周期内最大电压可达0.60 V,并相对稳定地维持50 h。而加入1 mg/L和10 mg/L DBP的反应器产电性能显著下降。DBP质量浓度为1 mg/L时,最大电压输出为0.36 V且没有显著的平台期,产电周期缩短到约140 h。当DBP质量浓度为10 mg/L时,反应器产电性能最差,最大输出电压仅为0.24 V,产电周期进一步缩短至128 h左右。

注:V-0、V-1、V-10分别为ρ(DBP)为0、1 mg/L、10 mg/L时的电压;P-0、P-1、P-10分别为ρ(DBP)为0、1 mg/L、10 mg/L时的功率密度;K-0、K-1、K-10分别为ρ(DBP)为0、1 mg/L、10 mg/L时阴极电位;A-0、A-1、A-10分别为ρ(DBP)为0、1 mg/L、10 mg/L时阳极电位。图2 BES在不同DBP质量浓度下的产电性能Fig.2 Electricity generation performance of BES under different DBP concentrations
同时,研究了不同DBP质量浓度下的系统输出功率变化。由图2(b)可见,随着DBP质量浓度增大,系统最大输出功率下降。DBP质量浓度从0增到10 mg/L,BES的输出功率减少了52.7%,内阻从200 Ω增大到了400 Ω左右,产电性能明显受到抑制。以Ag/AgCl电极作参比电极(下同),通过对阳极和阴极的电位进行监测(图2(c)),表明阳极电位是造成BES输出功率下降的主要因素,而阴极电位保持相对恒定。研究表明,EAB是影响BES产电性能的关键因素[23],当EAB厚度逐渐增加时,膜内的电子传递能力的变化会导致系统产电性能的下降,电子传递性能主要是由于细胞间或细胞与电极间的电子转移效率决定[24-25]。因此由产电数据可以推断,高质量浓度DBP抑制了EAB内的电子转移活性,导致BES内阻增大,输出功率降低。
为了验证上述推断,明确不同DBP质量浓度对EAB电化学活性的影响,对EAB的CV曲线(图3(a))进行分析,可以看出,随着DBP质量浓度增大,CV曲线内包围的面积逐渐缩小,表明基质减少,氧化还原反应越发微弱,体系的电化学活性降低。其中,对照组峰值电流为0.018 A,明显大于DBP质量浓度为1 mg/L和10 mg/L时的峰值电流(0.012 V和0.008 V),这也说明未投加DBP条件下的EAB产电性能最好,电子转移能力最强。在此基础上,绘制不同DBP质量浓度下CV的一阶导数(DCV)曲线,通过变化速度进一步分析CV的变化规律(图3(b))。可以看出,对照组的CV一阶导数中出现了3个峰,峰1代表CV曲线开始产生峰的电位,而随着DBP质量浓度增大,峰的数目减少,且开始产生峰的电位逐渐下降,表明EAB氧化还原活性位点的丰富度降低[26],生物膜电导率及电化学活性减弱,与上述CV分析以及通过最高输出电压和功率密度得出的结论一致。

图3 不同DBP质量浓度下的CV曲线及DCV曲线Fig.3 CV curve and its first derivative DCV curve under different DBP concentrations
c型细胞色素蛋白分布在菌体的内膜、外膜和周质空间中,在电子转移过程中,作为电子传递载体或末端还原酶发挥关键作用[27]。结合图3,可以看出对照组主要氧化峰出现在-0.04 V,这与Rhodopseudomonas等硫酸盐还原细菌属所特有的一种低电位细胞色素c3的氧化还原中点电位相近(-0.044 V)[28]。1 mg/L DBP条件下的主要氧化峰出现在0.05~0.25 V之间,与细胞色素c2(0.052~0.252 V)范围相似[29]。而10 mg/L DBP条件下氧化峰出现在-0.315 V,与周质细胞色素PpcA(-0.356 V)相近,该细胞色素是外膜细胞色素与电极之间交换电子的通道[30]。故推测细胞色素c3对DBP敏感,而细胞色素c2与PpcA可能参与了DBP刺激下的胞外电子传递。
2.2 不同DBP质量浓度下EAB微形态观察与表征
通过SEM观察EAB的微观形态,结果见图4。由图4(a)(b)(c)可见,对照组EAB中菌落外形较为明显,而添加了1 mg/L和10 mg/L DBP的生物膜表面被一层黏性物质包裹,细菌外形不明显。通过多重染色和CLSM获得生物膜的空间组成和结构见图4(d)(e)(f),可见,EAB中蛋白质和α-多糖的含量很高并且分散在整个视野中,对照组中的β-多糖的含量最小,分散在视野的局部位置。当DBP质量浓度逐渐增大到10 mg/L时,β-多糖含量显著增加,并从局部视野位置扩散到整个视野中。总的来说,EAB中蛋白质和α-多糖的比例相对稳定,而β-多糖的含量随DBP质量浓度的增加而显著增加。为了进一步分析DBP对EAB中胞外蛋白质和多糖分泌的影响,对这2种成分进行定量分析。

注:SEM图标尺为10 μm,CLSM图中绿色代表PRO,红色代表α-D-PS,蓝色代表β-D-PS。图4 在不同DBP质量浓度下EAB的SEM和CLSM Fig.4 SEM and CLSM of EAB under different DBP concentrations
生物膜的EPS主要由蛋白质和多糖类物质组成,EPS对细菌在电极表面的固定和生长,以及胞外电子转移至关重要[31]。检测数据显示,投加了1 mg/L和10 mg/L DBP的反应器中EPS含量逐渐提高,较于对照组分别增大了6.90%和17.70%。值得注意的是,随着DBP质量浓度增大,LB-EPS的含量逐渐从(12.46±1.19) mg/g 下降到(9.98±0.49) mg/g ,TB-EPS从(47.1±2.46) mg/g显著提高到(60.12±1.30) mg/g,增加了27.64%。结构上TB-EPS紧密附着在细胞壁上,具有一定外形,而LB-EPS流变性强,没有明显边缘,这说明DBP引起了EAB结构上的变化。
为进一步表征DBP对EAB分泌EPS的影响,对组成EPS的2种主要成分:PRO和PS的质量浓度进行检测。结果表明,当DBP质量浓度为1 mg/L时,LB-EPS和TB-EPS中的PRO和PS总质量浓度较对照组均有所提高,在LB-EPS中从(65.82±5.26) mg/L增加16.12%到(76.43±3.07) mg/L,TB-EPS中从(194.97±10.17) mg/L增加13.26%至(220.83±10.61) mg/L。当DBP质量浓度扩大到10 mg/L时,除了LB-EPS中的PS仍略有增加之外,LB-EPS中的PRO以及TB-EPS中的PRO和PS的质量浓度均有所下降。上述结果表明,在一定质量浓度DBP刺激下,EAB通过分泌更多的PRO和PS类物质作为保护屏障对抗DBP的生态毒性。而当DBP质量浓度过高时,TB-EPS中的PRO和PS质量浓度下降,可能是由于过高质量浓度DBP的生态毒性,影响了EPS合成代谢的速率。
2.3 EAB中微生物群落结构在不同DBP质量浓度下的演变
利用Illumina高通量测序16S rRNA基因分析不同质量浓度DBP下EAB上微生物群落的组成丰度和多样性。结果显示,DBP质量浓度为1 mg/L和10 mg/L的Ace值(186.84和194.11)均小于对照组(197.90),表明投加DBP降低了EAB上的微生物丰富度,种类减少;随着DBP质量浓度由1 mg/L增加到10 mg/L,Shannon值逐渐从3.04增大到3.34,表明微生物群落多样性提高,群落均匀度增加。同时从图5(a)来看,3组EAB共有OTU数目为127,随着DBP质量浓度增加,3组EAB中所独有的物种数目先减少后增大,即组成相似性逐渐降低。
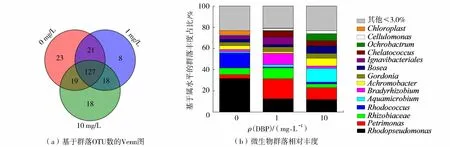
图5 不同DBP质量浓度下EAB的微生物群落分析结果Fig.5 Microbial community analysis result of EAB under different DBP concentrations
为进一步了解DBP对EAB中微生物群落的影响,在属水平上检测了不同DBP质量浓度下微生物群落的组成和相对丰度。由图5(b)可以看出,对照组的主要产电菌为Rhodopseudomonas(31.66%)和Rhodococcus(14.30%),该结果与曹效鑫[32]对其BES阳极生物膜中的优势菌分析结果相同。其中,Rhodopseudomonas属于α-变形菌门,能利用多种底物产电,特别是乙酸盐,功率输出密度高达(2 720±60) mW/m2,主要产电机制为EAB的直接电子传递[33],与上述CV曲线分析结果吻合。随着DBP质量浓度增加,优势产电菌Rhodopseudomonas和Rhodococcus迅速减少,Rhodopseudomonas在1 mg/L和10 mg/L DBP条件下分别只占12.53%和11.87%,而Rhodococcus几乎消失,分别只占0.97%和1.76%,表明这些产电菌的代谢受到明显抑制。
同时注意到,在加入DBP后Petrimonas成为优势菌,Petrimonas属于中温发酵细菌,能将复杂的有机物转化为乙酸,氢和二氧化碳[34]。Zhao等[35]研究发现,Petrimonas具有与其他物种进行直接种间电子转移来代谢有机底物的潜力。当DBP质量浓度增大,Petrimonas的相对丰度先增加(3.6%至18.86%)后减少(18.86%至11.15%)。这表明,Petrimonas在较低质量浓度的DBP下可以维持正常的增殖,随着浓度增加,细菌活性受到抑制,物种数目减少。此外,Aquamicrobium在高质量浓度DBP(10 mg/L)下大幅增加至12.96%,有研究表明,Aquamicrobium的丰度在投加高毒性金属元素—铊的BES中从0.01%增加到3.18%[36],并被发现能够代谢具有强烈生态毒性的杂环化合物噻吩-2-甲酸叔丁酯[37]、联苯和聚氯联苯等[38],说明该菌对高毒性物质具有一定抗性。由于Petrimonas和Aquamicrobium在添加DBP条件下的丰度出现显著增加,故推测其在生物膜对抗DBP毒性过程中起到重要作用。
3 结 论
a. 投加DBP会降低EAB的电化学活性,对BES的电化学性能有不利影响。随着DBP质量浓度增大,CV曲线的峰强、BES的最高输出电压和功率密度均显著下降。
b. DBP质量浓度增加导致EAB中EPS含量逐渐提高,尤其是TB-EPS含量显著提高,且高质量浓度DBP会刺激β-PS的分泌,用来抵抗DBP的生态毒性。
c. 在DBP刺激下,EAB中微生物群落丰富度降低,多样性提高,产电菌丰度下降,典型电活性菌Rhodopseudomonas和Rhodococcus对DBP敏感,代谢受到明显抑制,而Petrimonas和Aquamicrobium菌是高质量浓度DBP条件下的优势菌群,推测其在生物膜对抗DBP毒性过程中起重要作用。
