漆酶基因在柑橘褐斑病发生过程中的表达模式分析
2021-04-15龚意辉吴志蒙李论彭淑君李鹏陈致印
龚意辉 吴志蒙 李论 彭淑君 李鹏 陈致印


龚意辉(1988-),博士,主要从事园艺产品保鲜技术研究工作,主持或作为主要成员参与湖南省自然科学基金项目“漆酶在柑橘褐斑病中的作用机制”、湖南省教育厅科学研究项目“基于宏基因组学探讨EGCG@β-CD纳米粒增强降血脂功效的途径及机制”和“漆酶在黄桃褐变中的作用”等科研项目3项;在《Food Chemistry》《Plant Physiology》《Postharvest Biology and Technology》《Food Chemistry Molecular Science》《International Journal of Molecular Sciences》《南方农业学报》《包装工程》《食品与发酵工业》等国内外期刊发表学术论文18篇,其中第一作者或通讯作者11篇(SCI收录期刊3篇)。
摘要:【目的】克隆柑橘漆酶基因(CsLAC)并分析其表達规律,为进一步完善柑橘褐斑病的发生机制提供理论依据。【方法】以甜橙为试验材料,利用液相色谱—质谱联用(LC-MS)技术分析柑橘褐斑病发生过程中主要酚类化合物的变化,并采用实时荧光定量PCR分析漆酶基因在柑橘褐斑病发生过程中的表达规律。【结果】PE包装明显降低甜橙果实褐斑指数,利用LC-MS技术在甜橙果皮中共检测到1191个差异离子,共鉴定出18种酚类物质,其中没食子酸(Gallic acid)、儿茶素(Catechin)、表没食子儿茶素(Epigallocatechin)和原花青素B2(Procyanidin B2)的含量在果实贮藏期间呈下降趋势。成功克隆出7个柑橘漆酶基因,CsLAC4、CsLAC6、CsLAC11、CsLAC12、CsLAC13、CsLAC15和CsLAC17全长片段长度分别为1674、1716、1689、1740、1740、1713和1743 bp,分别编码557、571、562、579、579、570和580个氨基酸残基,与参考序列的相似性分别为99.88%、99.83%、99.70%、99.71%、99.60%、99.59%和99.89%。系统发育进化树显示,CsLAC15与荔枝LcLAC的氨基酸序列相似性较高(64.7%),CsLAC12与苹果MdLAC7的氨基酸序列相似性较高(65.7%)。氨基酸保守序列结果表明柑橘漆酶氨基酸序列含有漆酶的3个典型铜离子结构域,分别为Cu-oxidase-3、Cu-oxidase-1和Cu-oxidase-2。CsLAC4、CsLAC6、CsLAC11和CsLAC17在甜橙果实贮藏期间呈上调表达,CsLAC12和CsLAC15在果实贮藏期间总体上呈下调表达。【结论】结合甜橙果皮褐斑与CsLAC表达量的关系,推测CsLAC6的大量上调表达可能对柑橘果皮褐斑形成起促进作用。
关键词: 柑橘;漆酶;褐斑病;酚类化合物;基因表达
中图分类号: S666.4 文献标志码: A 文章编号:2095-1191(2021)12-3195-10
Expression analysis of the laccase gene during the development of peel pitting in citrus fruit
GONG Yi-hui1, WU Zhi-meng1, LI Lun1, PENG Shu-jun1, LI Peng2, CHEN Zhi-yin1*
(1School of Agriculture and Biotechnology, Hunan University of Humanities, Science and Technology, Loudi, Hunan 417000, China; 2Xiangtan City Agriculture Scientific Research Institute, Xiangtan, Hunan 4171134, China)
Abstract:【Objective】To investigate the expression characteristics of laccase gene(CsLAC)of citrus fruit,to provide a theoretical basis for the mechanism of peel pitting in citrus fruit. 【Method】Sweet orange fruit were used as experimental materials. Liquid chromatography-mass spectrometry (LC-MS) was used to detect and analysis the main phenolic compounds during the development of peel pitting at the storage stage, and the expression of laccase genes were monitored during the development of peel pitting in citrus fruit using real-time fluorescence quantitative PCR. 【Result】The results showed that peel pitting was inhibited by PE packaging treatment. A total of 1191 differential ions were detected in the peel of sweet oranges by LC-MS and 18 phenolic compounds were identified. The contents of gallic acid,catechin, epigallocatechin and procyanidin B2 were decreased during the storage of citrus fruit. Seven laccase genes were cloned by RT-PCR. The full lengths cDNA of CsLAC4, CsLAC6, CsLAC11, CsLAC12, CsLAC13, CsLAC15,CsLAC17 genes were 1674, 1716, 1689, 1740, 1740, 1713, 1743 bp, encoding 557, 571, 562, 579, 579, 570, 580 amino acids residues, with similarities to the reference sequence of 99.88%, 99.83%, 99.70%, 99.71%, 99.60%, 99.59% and 99.89%, respectively. Phylogenetic analysis showed that CsLAC15 had 64.7% amino acid sequence similarity to litchi LcLAC, while CsLAC12 had 65.7% similarity to apple MdLAC7 amino acid sequence. The laccase amino acid sequences in different plants had a structure of three highly conserved domains:Cu-oxidase-3, Cu-oxidase-1 and Cu-oxidase-2. The expressions of CsLAC4, CsLAC6, CsLAC11, CsLAC17 were up-regulated and CsLAC12 and CsLAC15 were down-regulated during the storage of sweet orange fruits. 【Conclusion】 Combining the relationship of peel pitting and CsLAC expression,it is suggested that the CsLAC6 in pericarp may contribute to the peel pitting of sweet orange fruit.
Key words: citrus; laccase; peel pitting; phenolic compounds; gene expression
Foundation item: Hunan Natural Science Foundation(2020JJ5270); Science and Technology Innovation Project of Hunan(2020RC1014); Scientific Research Project of Hunan Provincial Department of Education(20A281)
0 引言
【研究意义】柑橘是我国南方地区重要的特色水果,也是世界上栽培面积最广的水果之一。柑橘因色泽鲜艳,果汁丰富,营养、保健及药用价值高等特点而受到广大消费者的喜爱。柑橘果实褐斑病又称干疤病,是柑橘果实低温贮藏中普遍发生的一种生理失调病害,尤其是甜橙类果实褐斑病发病率达20%~50%,严重时高达90%(Fan et al.,2009;Cronjé et al.,2017)。褐斑病的发生严重降低柑橘果实的外观品质,其病斑部位更容易受到炭疽病、青霉病和绿霉病等病原菌的入侵而导致果肉变质和果实腐烂。果皮褐斑病不仅严重影响果实外观光洁度和风味,还会降低鲜销果实的出口价格和国际市场竞争力,严重制约我国柑橘产业的进一步发展。柑橘褐斑病的形成机理仍是目前柑橘果实采后生理研究中迫切需要解决的重点和难点问题。漆酶(苯二醇:氧化还原酶,Laccase,EC1.1.03.2)是由多基因家族编码并广泛分布于果实中的一个重要酶,在果实中具有广泛的生理作用。近年来研究发现,漆酶在荔枝和苹果果皮褐变中起着重要的作用(Fang et al.,2015;Gong et al.,2018),但漆酶在柑橘褐斑病中的作用研究鲜见报道。因此,克隆柑橘LAC基因(CsLAC)并分析其表达模式,以期深入研究漆酶基因在柑橘褐斑病发生过程中的作用机制,对提高柑橘果实品质和耐藏性具有重要意义。【前人研究进展】不少学者对柑橘褐斑病的生理生化进行了研究,且大多集中在症状、褐斑果皮组织特征及诱发因素等方面(Fan et al.,2009;Vicente et al.,2013),对褐斑病的发病机制却缺乏系统研究。柑橘果实发生褐斑病后,果皮表现出皱缩、干疤的症状,并形成不规则的深褐色病斑(Lafuente and Zacarías,2006)。目前,国内外研究认为果实褐斑病与酶促褐变、冷害、膜脂过氧化等因素有着密切关系。高雪(2006)研究发现,在褐斑严重的奉节脐橙果皮中过氧化物酶(POD)活性较高,且随褐斑病的严重程度总体呈升高趋势。与正常果实比较,褐斑严重的皇冠梨果皮和果肉中酚含量及POD和多酚氧化酶(PPO)活性较高(关军锋等,2005,2009)。柑橘果实内的自由基清除系统在持续低温胁迫作用下被打破,导致细胞膜脂质过氧化加剧,大量积累丙二醛产物,进一步加剧毒害细胞膜系统,在冷害后期细胞膜系统降解呈絮状而变得不清晰,打破了细胞区域化分隔系统,造成细胞内酚类物质、PPO和POD等从液泡内溢出与外界发生接触,加快果皮酶促褐变进程,使得果皮表现出褐斑病症状(Cajuste and Lafuente,2007)。漆酶是一个古老的氧化还原酶,属于多铜氧化酶家族,广泛分布于很多植物种类中(Giardina et al.,2010;Reichel et al.,2013)。漆酶能催化O2通过4个电子还原成水,并伴随着一些酚类和芳香类底物的氧化,这些酚类和芳香类化合物脱去羟基上的电子和质子形成自由基,导致酚类和木质素类化合物裂解(Schuetz et al.,2014;Wang et al.,2015)。近年来,关于漆酶在植物组织褐变中的作用研究有一些报道。Fang等(2015)研究表明,荔枝漆酶在果皮花色素苷降解和采后果皮褐变中起着关键作用。帅良等(2017)采用RT-PCR对龙眼漆酶进行全长克隆,发现漆酶基因的上调表达可能与龙眼褐变关系密切。Gong等(2018)研究漆酶在采后苹果虎皮病中的生物学作用,发现MdLAC7在虎皮病严重的苹果果皮中表达量高,可能在虎皮病发生过程中起着重要作用。【本研究切入点】前人研究表明漆酶在果实酶促褐变中起着重要作用,但有关漆酶在采后柑橘果实褐斑病中的作用尚未见报道。【拟解决的关键问题】以甜橙为试验材料,结合聚乙烯(PE)包装处理,利用实时荧光定量PCR(qRT-PCR)检测漆酶在不同褐斑程度果皮中的相对表达量,并对漆酶进行生物学信息分析,利用液相色谱—质谱联用(LC-MS)技术测定甜橙果实褐斑病发生过程中主要酚类物质的相对丰度,为完善柑橘褐斑病的发生机制提供理论依据。
1 材料与方法
1. 1 试验材料
于2020年11月15日在漣源市曲溪村柑橘基地采摘甜橙果实,挑选果实大小一致、色泽均匀、无病虫害、无机械伤害的果实。采摘后立即运到实验室进行试验处理。甲醇、水、甲酸和醋酸铵均为质谱级纯度,购自美国Thermo Fisher公司;TRUEscript RT MasterMix购自北京密码子生物科技有限公司;TUREscript 1st Stand cDNA SYNTHESIS Kit购自北京艾德莱生物科技有限公司;TaKaRa PCR Amplification Kit、PMD 20-T Vector Kit和TaKaRa Gel DNA Purification Kit Ver2.0购自TaKaRa公司;2×SYBR Green QPCR Mixture预混液购自广州东盛生物科技有限公司。
主要仪器设备:质谱仪Q ExactiveTM HF-X(Thermo Fisher,Germany),色谱仪Vanquish UHPLC(Thermo Fisher,Germany),色谱柱Hypesil Gold colu-mn(100 mm×2.1 mm,1.9 μm,Thermo Fisher,USA),低温离心机D3024R(Scilogex,USA);analytikjena-q TOWER2.2型荧光定量PCR仪、普通PCR仪analy-tikjena-Easycycler和超微量核酸蛋白测定仪scandrop100均购自德国耶拿分析仪器股份公司;PE保鲜袋由广州健阳生物科技有限公司生产提供,规格为400 mm×400 mm,双层膜厚度均为0.05 mm。
1. 2 试验处理
将挑选好的甜橙果实12个一组装入PE保鲜袋,用橡皮筋绑紧封口后置于温度(15±1)℃、相对湿度85%的恒温箱中贮藏42 d。同时,以不作任何处理的甜橙果实放置于相同贮藏条件下作为对照组(CK),每处理3次生物学重复,每重复3个果实。分别在0、14、28和42 d进行果皮取样,将果皮迅速用液氮充分浸泡,彻底冻结后立即用锡箔纸包装,放入自封袋置于-80 ℃超低温冰箱中保存,用于后续漆酶基因表达及质谱数据采集。
1. 3 试验方法
1. 3. 1 果实褐斑指数测定 参照Knight等(2002)、高雪和李正国(2009)的方法略有改动,以12个甜橙果实为基数计算果实褐斑指数。褐斑分级标准如下:0级:果皮完全无褐斑;1级:≤1/4面积果皮轻微褐斑;2级:1/4~2/4面积果皮褐斑;3级:2/4~3/4面积果皮褐斑;4级:≥3/4面积果皮严重褐斑。
褐斑指数=Σ(褐斑级别×该级别果实占总果实
的百分比)
1. 3. 2 酚类物质提取 参照Want等(2012)的方法并略有改动。称取100 mg经液氮研磨至粉末的甜橙果皮样品,加500 μL 80%(v/v)甲醇后涡旋振荡混匀,将样品置于冰浴中静置5 min,在4 ℃、18000 r/min条件下离心20 min,吸取一定量的上清液加质谱级水稀释至甲醇含量为53%;并在4 ℃、18000 r/min条件下离心20 min,然后从每个样品中取550 μL放入新的样品管中,记录好样品名称和顺序,最后从每个试验样本中取30 μL混匀作QC样本;以53%甲醇作空白样本,前处理过程与试验样本相同。将以上各样品保存至样品瓶中,用于后续LC-MS分析。
1. 3. 3 色谱条件 色谱柱Hypesil Gold column(100 mm×2.1 mm,1.9 μm);柱温40 ℃;流速0.2 mL/min;正模式:流动相A为0.1%(v/v)甲酸,流动相B为甲醇;负模式:流动相A为5 mmol/L醋酸铵,pH 9.0,流动相B为甲醇;进样量100 μL;色谱梯度洗脱程序如表1所示。
1. 3. 4 酚类物质的LC-MS分析 采用高分辨率串联质谱仪Q ExactiveTM HF-X对色谱柱洗脱下来的未知酚类物质进行正负离子模式检测。正离子模式扫描范围选择m/z 100~1500;ESI源的设置:毛细管电压3.2 kV,气体Ⅰ(GSⅠ)和气体Ⅱ(GSⅡ)分别设为40和10 arb,离子源温度320 ℃。将下机数据(.raw)文件导入CD搜库软件(CD3.1,Thermo Fisher)中,进行保留时间、质荷比等参数的简单筛选,然后对不同样品根据保留时间偏差0.2 min和质量偏差在百万分之五内进行峰对齐,使鉴定更准确,随后根据设置的质量偏差为百万分之五、信号强度偏差30%、信噪比3、最小信号强度100000、加和离子等信息进行峰提取,同时对峰面积进行定量,再整合目标离子,然后通过分子离子峰和碎片离子进行分子式预测,与北京诺禾致源科技股份有限公司自建代谢物数据库、Metlin(http://metlin.scripps.edu)和mzVault数据库进行比对,用空白样本去除背景离子,并对定量结果进行归一化,最后得到酚类物质的鉴定和定量结果。
1. 3. 5 总RNA提取与cDNA第一链合成 使用RNA提取试剂盒(北京华越洋生物科技有限公司)提取甜橙果皮总RNA,并用1%琼脂糖凝胶电泳检测总RNA质量。以总RNA为模板,采用Aidlab公司反转录试剂盒(TUREscript 1st Stand cDNA SYNTHESIS Kit)的步骤合成cDNA第一链,置于-30 ℃保存,用于后续漆酶基因的克隆及表达分析。
1. 3. 6 CsLAC基因克隆及生物信息学分析 在 NCBI数据库(https://www.ncbi.nlm.nih.gov/)中查找已发表的柑橘漆酶基因的氨基酸序列,设计漆酶基因的特异性引物(表2)。以甜橙果皮cDNA为模板,参照TaKaRa PCR Amplification Kit的说明步骤进行PCR扩增,用1%琼脂糖凝胶电泳检测扩增片段,切胶,回收,连接pMD20-T载体上,转化大肠杆菌DH5α感受态细胞,通过PCR鉴定出阳性克隆,将各样品送至中美泰和生物技术(北京)有限公司测序。根据柑橘漆酶基因测序所得到的氨基酸序列,使用Clustal X 1.83对柑橘漆酶基因的同源性及序列进行多重比较分析;运用MEGA 6.0中的邻位相连法(Neighbor-joining,NJ)构建漆酶基因系统发育进化树。
1. 3. 7 CsLAC基因表达分析 利用Primer 5.0进行漆酶基因荧光引物设计,通过Oligo 6.0对已设计好的引物进行评价,如表3所示。参照Shuai等(2016)、Gong等(2018)的方法,qRT-PCR使用荧光染料为2×SYBR Green QPCR Mixture,扩增体系10.0 μL:cDNA模板1.0 μL,200 nmol/L上、下游引物各0.5 μL,2×SYBR? Green Supermix 5.0 μL,ddH2O 3.0 μL。以Citrus RNA polymeraseII(CRPII,EF174422)作為本研究的内参基因(Liu et al.,2008),各样品的表达量均是相对于内参基因。荧光表达量计算采用2-△△Ct法(Ponchel et al.,2003),由荧光定量PCR仪软件系统自动分析得出结果。
1. 4 统计分析
使用Excel 2007对试验数据进行处理和分析,以Sigmaplot 12.5作图。
2 结果与分析
2. 1 PE包装对甜橙果实褐斑指数的影响
由图1可知,在甜橙果实贮藏期间,果皮褐斑指数随着贮藏时间的延长呈逐渐上升趋势,而PE包装处理的甜橙果实在贮藏0~14 d无褐斑病发生,贮藏至第28和42 d的果实褐斑指数均极显著低于对照组(P<0.01,下同)。表明PE包装处理能明显抑制甜橙果实褐斑病的发生。
2. 2 PE包装对甜橙果实酚类物质含量的影响
利用LC-MS技术鉴定采后甜橙果实贮藏期间的代谢物,共鉴定出1191个差异离子,在甜橙果皮中鉴定出18种酚类物质(表4),包括矢车菊素-3-O-芸香糖苷、根皮苷、绿原酸、槲皮素、甜橙素等。
在甜橙果实贮藏期间,矢车菊素-3-O-芸香糖苷总体上呈升高趋势,PE包装处理的矢车菊素-3-O-芸香糖苷含量高于对照组(图2-A);没食子酸、表没食子儿茶素、原花青素B2和儿茶素含量在果实贮藏期间呈逐渐下降趋势(图2-B、图2-D、图2-E和图2-G);根皮苷含量呈逐渐上升趋势,PE包装诱导根皮苷含量增加(图2-C),槲皮素和绿原酸含量在果实贮藏期间呈先升高后下降的变化趋势(图2-F和图2-H);对照组的桔黄酮含量呈先升高后下降的变化趋势,PE包装的桔皮素含量则变化不大(图2-I)。
2. 3 CsLAC基因克隆结果
在NCBI数据库中查找柑橘漆酶基因的氨基酸序列,以甜橙果皮cDNA为模板,设计漆酶基因的特异性引物。扩增序列经BLAST比对后发现成功从甜橙果皮中克隆得到7个漆酶基因,分别为CsLAC4、CsLAC6、CsLAC11、CsLAC12、CsLAC13、CsLAC15和CsLAC17(图3),基因片段长度分别为1674、1716、1689、1740、1740、1713和1743 bp,分别编码557、571、562、579、579、570和580个氨基酸残基,与参考序列的相似性分别为99.88%、99.83%、99.70%、99.71%、99.60%、99.59%和99.89%。
2. 4 CsLAC基因的生物信息学分析结果
对上述克隆得到的7个甜橙漆酶基因编码的氨基酸序列与荔枝(LcLAC)、苹果(MdLAC7)和黄桃(PpLAC)进行同源性分析,结果显示,CsLAC15与LcLAC的氨基酸序列相似性较高(64.7%),而CsLAC12与MdLAC7的氨基酸序列相似性较高(65.7%)(图4)。结合本课题组证实了荔枝漆酶在果皮褐变中起着关键作用(Fang et al.,2015),MdLAC7可能在虎皮病褐变中起着重要作用(Gong et al.,2018),初步推测柑橘漆酶基因可能与褐斑病的发生存在一定关联性。通过选取荔枝、苹果和甜橙漆酶的氨基酸序列进行保守序列分析,结果发现,柑橘漆酶氨基酸序列同样含有漆酶的3个典型铜离子结构域,分别为Cu-oxidase-3、Cu-oxidase-1和Cu-oxidase-2(图5)。
2. 5 CsLAC基因表达分析结果
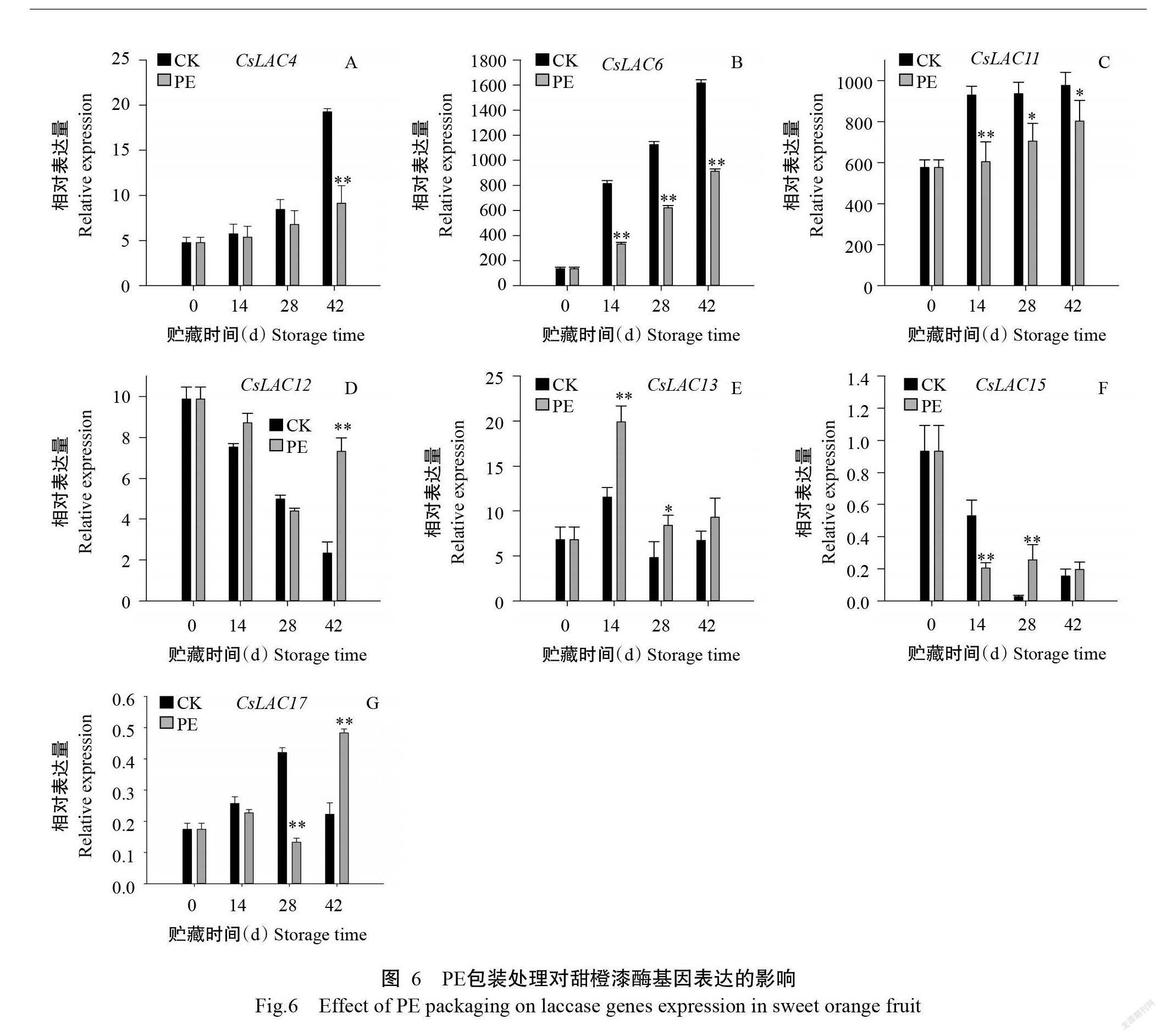
本研究利用qRT-PCR检测7个漆酶基因在甜橙褐斑病发生过程中的表达情况。由图6可知,甜橙果皮中的CsLAC4、CsLAC6和CsLAC11相对表达量随着贮藏时间的延长呈增加趋势,在采后贮藏第42 d表达水平达最大值,PE包装处理则抑制这3个基因的表达水平(图6-A~图6-C);CsLAC12和CsLAC15基因在果实贮藏过程中呈下调表达(图6-D和图6-F);CsLAC13相对表达量在果实贮藏期间呈先上升后下降的变化趋势,在采后贮藏第14 d出现最大值(图6-E);对照组中CsLAC17相对表达量在甜橙果实贮藏期间呈先升高后降低的变化趋势,而PE包装处理的CsLAC17相对表达量在贮藏期间总体上呈上升趋势(图6-G)。综合这7个漆酶基因的表达水平,CsLAC6的相对表达量明显高于其他6个漆酶基因,表明不同漆酶基因在柑橘褐斑病中的表达水平存在明显差异,CsLAC6在甜橙果实贮藏过程中的高表达量水平可能促进甜橙果实褐斑病的发生。
3 讨论
漆酶是一种含铜的多酚氧化酶,广泛存在于很多果实中(Fang et al.,2015;Berni et al.,2019)。漆酶是一个古老的氧化还原酶,不同来源的漆酶核苷酸序列差异很大(Mayer and Staples,2002)。其底物分布广泛,能催化酚类、芳胺类、羧酸类、甾体类激素、生物色素、金属有机化合物和非酚类物质生成醌类化合物、羰基化合物和水(D'Annibale et al.,2010)。柑橘果实中含有丰富的酚类化合物且种类丰富,包括儿茶素、咖啡酸、绿原酸、没食子酸、根皮苷和桔皮素等酚类物质(Marie et al.,2015;Buyukkurt et al.,2019;Multari et al.,2020)。本研究利用LC-MS初步在甜橙果皮中鉴定出19种主要酚类物质,包括儿茶素、绿原酸、没食子酸、咖啡酸、原花青素B2和表没食子儿茶素等。郑洁等(2014)利用超高效液相色谱法在纽荷尔脐橙和宽皮柑橘类果皮中鉴定出绿原酸、橙皮苷、咖啡酸等18种酚类化合物。本研究发现,没食子酸、儿茶素、表没食子儿茶素和原花青素B2的含量在甜橙果实贮藏期间呈逐渐下降趋势,推测可能作为漆酶氧化的底物,逐渐被催化氧化生成褐色物质,导致其含量下降,从而使甜橙果皮褐斑症状表现出来。罗耀红等(2008)研究表明,植物漆酶能氧化表儿茶素、绿原酸及原花青素聚合体等多酚类物质。由此可知,柑橘果皮中漆酶催化氧化酚类底物生成褐色物质,从而导致果皮褐斑病的形成。
本研究系统发育进化树分析显示,CsLAC15与荔枝漆酶具有较高的同源性,而CsLAC12与苹果漆酶具有较高的同源性。氨基酸保守序列分析发现,柑橘漆酶氨基酸序列含有漆酶的3个典型铜离子结构域,分别为Cu-oxidase-3、Cu-oxidase-1和Cu-oxidase-2。研究表明荔枝漆酶和苹果漆酶包含3个多铜氧化酶家族结构域,并与PPO区分开(Fang et al.,2015;Gong et al.,2018)。甜橙果皮中CsLAC6基因的表达水平逐漸上升,果实褐斑指数也呈迅速上升趋势,CsLAC6基因相对表达量与果皮褐斑指数存在较强的正相关关系,推测原因可能是CsLAC6基因相对表达量的增加导致甜橙果皮中漆酶总量及活性的增加,使果皮中底物氧化量增加,加快了甜橙果实褐斑症状的形成。结合漆酶基因在苹果虎皮病褐变和荔枝果皮褐变过程中所起的作用和研究结果(Fang et al.,2015;Gong et al.,2018),推测CsLAC6基因在甜橙贮藏期间的大量上调表达可能促进了甜橙褐斑症状的形成。综上所述,CsLAC6可能在甜橙果实褐斑病形成中起着重要作用。
4 结论
不同漆酶基因在甜橙果实褐斑病发生进程中的表达水平存在明显差异,其中CsLAC6在贮藏期间高水平的上调表达,暗示CsLAC6可能在甜橙果实褐斑病的发生过程中起着重要作用。
参考文献:
高雪,李正国. 2009. 奉节脐橙果皮褐变生理的研究[J]. 食品科学,30(8):280-283. [Gao X,Li Z G. 2009. Physiological study of peel pitting of Fengjie navel orange fruit[J]. Food Science,30(8):280-283.] doi:10.3321/j.issn:1002-6630.2009.08.064.
高雪. 2006. 奉节脐橙果皮褐变生理及相关基因的分离研究[D]. 重庆:重庆大学. [Gao X. 2006. Study on the phy-siology of peel browning and isolation of related genes of Fengjie Navel Orange fruit[D]. Chongqing:Chongqing University.]
关军锋,窦世娟,及华,孙玉龙. 2009. 采后包装对黄冠梨冷藏期间品质和果皮褐斑的影响[J]. 保鲜与加工,9(6):25-27. [Guan J F,Dou S J,Ji H,Sun Y L. 2009. Effect of postharvest packaging on quality and peel browning spot of Huangguan pears during cold storage[J]. Storage and Process,9(6):25-27.] doi:10.3969/j.issn.1009-6221.2009. 06.007.
关军锋,及华,冯云霄,李丽梅,孙玉龙,司建丽. 2005. 黄冠梨果皮褐斑病与酚类物质代谢的关系[J]. 华北农学报,20(6):80-83. [Guan J F,Ji H,Feng Y X,Li L M,Sun Y L,Si J L. 2005. The correlation of peel browning spot with phenolics metabolism in Huangguan pears[J]. Acta Agriculturae Boreali-Sinica,20(6):80-83.] doi:10.3321/j.issn:1000-7091.2005.06.021.
罗耀红,左莹,苏钰琦,马惠玲. 2008. 漆酶对酚类化合物生物催化氧化动力学研究——以儿茶酚和表儿茶素为模式底物[J]. 林产化学与工业,28(3):13-17. [Luo Y H,Zuo Y,Su Y Q,Ma H L. 2008. Study on kinetic behaviors of the biocatalysis of laccase on oxidation of phenolic compounds——Using catechol and epicatechin as model substrates[J]. Chemistry and Industry of Forest Products,28(3):13-17]. doi:10.3321/j.issn:0253-2417.2008.03.003.
帥良,赵昱清,廖玲燕,宋慕波,朱东建,蔡文,段振华,吴振先,韩冬梅. 2017. 龙眼漆酶基因(DlLac)的克隆及表达分析[J]. 食品工业科技,38(13):95-100. [Shuai L,Zhao Y Q,Liao L Y,Song M B,Zhu D J,Cai W,Duan Z H,Wu Z X,Han D M. 2017. Cloning and expression analysis of the laccase gene (DlLac) from Dimocarpus longan[J]. Science and Technology of Food Industry,38(13):95-100.] doi:10.13386/j.issn1002-0306.2017.13.018.
郑洁,赵其阳,张耀海,焦必宁. 2014. 超高效液相色谱法同时测定柑橘中主要酚酸和类黄酮物质[J]. 中国农业科学,47(23):4676-4687. [Zheng J,Zhao Q Y,Zhang Y H,Jiao B N. 2014. Simultaneous determination of main flavonoids and phenolic acids in citrus fruit by ultra performance liquid chromatograph[J]. Scientia Agricultura Sinica,47(23):4676-4687.] doi:10.3864/j.issn.0578-1752. 2014.23.015.
Berni R,Piasecki E,Legay S,Hausman J F,Siddiqui S K,Cai G,Guerriero G. 2019. Identification of the laccase-like multicopper oxidase gene family of sweet cherry(Prunus avium L.) and expression analysis in six ancient Tuscan varieties[J]. Scientific Reports,9(1):3557. doi:10.1038/s41598-019-39151-z.
Buyukkurt O K,Guclu G,Kelebek H,Selli S. 2019. Characterization of phenolic compounds in sweet lime (Citrus limetta) peel and freshly squeezed juices by LC-DAD-ESI-MS/MS and their antioxidant activity[J]. Journal of Food Measurement and Characterization,13(1):3242-3249. doi:10.1007/s11694-019-00246-w.
Cajuste J F,Lafuente M T. 2007. Ethylene-induced tolerance to non-chilling peel pitting as related to phenolic metabolism and lignin content in ‘Navelate fruit[J]. Postharvest Biology & Technology,45(2):193-203. doi:10.1016/j.postharvbio.2007.01.019.
Cronjé P J R,Zacarías L,Alférez F. 2017. Susceptibility to postharvest peel pitting in Citrus fruits as related to albedo thickness,water loss and phospholipase activity[J]. Postharvest Biology and Technology,123:77-82. doi:10. 1016/j.postharvbio.2016.08.012.
D'Annibale A,Celletti D,Felici M,Mattia E D,Giovannozzi-Sermanni G. 2010. Substrate specificity of laccase from Lentinus edodes[J]. Acta Biotechnologica,16(4):257-270. doi:10.1002/abio.370160408.
Fan J,Yang Y W,Gao X,Yang Y W,Xue G,Deng W,Falara V,Kanellis A K,Li Z G. 2009. Expression of a senescence-associated cysteine protease gene related to peel pitting of navel orange(Citrus sinensis L. Osbeck)[J]. Plant Cell Tissue & Organ Culture,98(3):281-289. doi:10.1007/s11240-009-9561-7.
Fang F,Zhang X L,Luo H H,Zhou J J,Gong Y H,Li W J,Shi Z W,He Q,Wu Q,Li L,Jiang L L,Cai Z G,Oren-Shamir M,Zhang Z Q,Pang X Q. 2015. An intracellular laccase is responsible for epicatechin-mediated anthocyanin degradation in litchi fruit pericarp[J]. Plant Physiology,169(4):2391-2408. doi:10.1104/pp.15.00359.
Giardina P,Faraco V,Pezzella C,Piscitelli A,Vanhulle S,Sannia G. 2010. Laccases:A never-ending story[J]. Cellular & Molecular Life Sciences,67(3):369-385. doi:10.1007/s00018-009-0169-1.
Gong Y H,Song J,Du L N,Vinquest M,Palmer L C,Fillmore S,Pang X Q,Zhang Z Q. 2018. Characterization of laccase from apple fruit during postharvest storage and its response to diphenylamine and 1-methylcyclopropene treatments[J]. Food Chemistry,253(1):314-321. doi:10. 1016/j.foodchem.2018.01.142.
Knight T G,Klieber A,Sedgley M. 2002. Structural basis of the rind disorder oleocellosis in Washington navel orange(Citrus sinensis L. Osbeck)[J]. Annals of Botany,(6):765-773. doi:10.1093/aob.mcf258.
Lafuente M T,Zacarías L. 2006. Postharvest physiological disorders in citrus fruit[J]. Stewart Postharvest Review,2(1):1-9. doi:10.2212/spr.2006.1.2.
Liu H G,Wang Z K,Cao Y Q,Xia Y X,Yin Y P. 2008. Detection of Citrus tristeza virus using conventional and fluo-rescence quantitative RT-PCR assays[J]. Acta Phytopathologica Sinica,238:24-30. doi:10.3724/SP.J.1005.2008. 01083.
Marie D H,Audray D,Thibault D,Bidel L P R,Christian J A,Yann F,Frédéric B,Fanciullino A L. 2015. Mapping the genetic and tissular diversity of 64 phenolic compounds in Citrus species using a UPLC-MS approach[J]. Annals of Botany,115(5):861-877. doi:10.1093/aob/mcv012.
Mayer A M,Staples R C. 2002. Laccase:New functions for an old enzyme[J]. Phytochemistry,60(6):551-565. doi:10.1016/S0031-9422(02)00171-1.
Multari S,Licciardello C,Caruso M,Martens S. 2020. Monitoring the changes in phenolic compounds and carote-noids occurring during fruit development in the tissues of four Citrus fruits[J]. Food Research International,134:109228. doi:10.1016/j.foodres.2020.109228.
Ponchel F,Toomes C,Bransfield K,Leong F T,Douglas S H,Field S L,Bell S M,Combaret V,Puisieux A,Mighell A J,Robinson P A,Inglehearn C F,Isaacs J D,Markham A F. 2003. Real-time PCR based on SYBR-Green I fluorescence:An alternative to the TaqMan assay for a relative quantification of gene rearrangements,gene amplifications and micro gene deletions[J]. BMC Biotechnology,3(1):1-13. doi:10.1186/1472-6750-3-18.
Reichel M,Triani R,Wellh?fer J,Sruamsiri P,Reinhold C,Sybille N. 2013. Vital characteristics of litchi (Litchi chinensis Sonn.) pericarp that define postharvest concepts for Thai cultivars[J]. Food & Bioprocess Technology,6(5):1191-1206. doi:10.1007/s11947-011-0762-9.
Schuetz M,Benske A,Smith R A,Watanabe Y,Tobimatsu Y,Ralph J,Demura T,Ellis B,Samuels A L. 2014. Laccases direct lignification in the discrete secondary cell wall domains of protoxylem[J]. Plant Physiology,166(2):798-807. doi:10.1104/pp.114.245597.
Shuai L,Li J,Niu J J,Qian P H,Liu W H,Xue X Q,Han D M,Wu Z X. 2016. Sucrose-metabolizing enzymes and their genes in the arils of two Dimocarpus longan cultivars[J]. Biologia Plantarum,60:741-748. doi:10.1007/s10535-016-0602-x.
Vicente A R,Manganaris G A,Minas I S,Goulas V,Lafuente M T. 2013. Cell wall modifications and ethylene-induced tolerance to non-chilling peel pitting in citrus fruit[J]. Plant Science,210(9):46-52. doi:10.1016/j.plantsci.2013. 05.001.
Wang W,Liu F,Jiang Y J,Wu G M,Guo L X,Chen R L,Chen B Z,Lu Y P,Dai Y C,Xie B G. 2015. The multigene family of fungal laccases and their expression in the white rot basidiomycete Flammulina velutipes[J]. Gene,563(2):142-149. doi:10.1016/j.gene.2015.03.020.
Want E J,Masson P,Michopoulos F,Wilson I D,Theodoridis G,Plumb R S,Shockcor J,Loftus N,Holmes E,Nicholson J K. 2012. Global metabolic profiling of animal and human tissues via UPLC-MS[J]. Nature Protocols,8(1):17-32. doi:10.1038/nprot.2012.135.
(責任编辑 罗 丽)
