白条双锯鱼胚胎及仔稚鱼发育形态学观察
2021-04-15吕爽夏苏东高燕张丹尤宏争牟希东
吕爽 夏苏东 高燕 张丹 尤宏争 牟希东

摘要:【目的】觀察记录白条双锯鱼从受精到孵化的胚胎发育及早期个体发育规律,为海葵鱼的人工繁育提供科学依据。【方法】以人工海水为养殖用水,在水温(27±1)℃、盐度27‰的条件下,白条双锯鱼自然产卵,经紫外灯照射杀菌后进行人工孵化及仔稚鱼培育,在显微镜下定期观察记录受精卵及仔稚鱼发育过程的形态特征变化,并手绘制图。【结果】白条双锯鱼受精卵整体上呈长条状,橙红或粉红色,轮廓类似葫芦状的椭圆形,长径2.40~2.60 mm、短径0.90~1.20 mm。依据受精卵的分裂、分化及发育形态,可将白条双锯鱼胚胎发育过程划分为:卵裂前期、卵裂期、囊胚期、原肠期、神经胚期、体节期、翻转期、血管形成期和器官形成期。白条双锯鱼受精卵经8~10 d的孵化时间破膜,初孵仔鱼体长4.10~4.50 mm;孵出第1 d即可开口摄食轮虫,孵出后7 d左右由仔鱼期进入稚鱼期,尾鳍、臀鳍和背鳍彼此分离,此时的体长达7.67±0.48 mm;至孵化后第20 d开始出现第一道白色条纹;孵化后第30 d仔稚鱼体色由黑色转为暗红色,并开始长出第二道白色条纹;从孵化后第50 d第二道白色条纹开始褪去;至孵化后第60 d其体色开始转为红色。【结论】白条双锯鱼胚体发育时间为8~10 d,相较于双锯鱼属其他品种需要更长的孵化时间,究其原因是白条双锯鱼受精卵尺寸更大。此外,孵化环境温度对受精卵的发育时间有明显影响,在适当范围内,环境温度越高白条双锯鱼受精卵发育速度越快。白条双锯鱼仔稚鱼饲养宜分为3个阶段喂养不同类型的饵料,以保证仔稚鱼的高成活率。
关键词: 白条双锯鱼;受精卵;胚胎发育;仔稚鱼;形态学
中图分类号: S965.82 文献标志码: A 文章编号:2095-1191(2021)12-3303-08
Morphologic observation on embryonic and larval
development of Amphiprion frenatus
LYU Shuang1,2, XIA Su-dong1*, GAO Yan3, ZHANG Dan1, YOU Hong-zheng3,
MOU Xi-dong2, SUN Jin-hui1, JIANG Ju-feng3, MAO Tian-qi1
(1Department of Fishery Science, Tianjin Agricultural University/Tianjin Key Lab of Aqua-Ecology and Aquaculture, Tianjin 300384, China; 2Key Laboratory of Recreational Fisheries, Ministry of Agriculture and Rural Affairs/
Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510380, China;
3Tianjin Fisheries Research Institute, Tianjin 300221, China)
Abstract:【Objective】Observed and recorded the embryonic development and early ontogenesis of Amphiprion frenatus from fertilization to hatching, to provide scientific basis for artificial breeding of anemonefish. 【Method】Artificial seawater was used for aquaculture, anemonefish spawned at (27±1)℃, and in the salinity of 27‰ conditions. Artificially hatching and breeding larval and juvenile after the aquaculture water was sterilized by ultraviolet lamp. Morphological changes of zygote and larval and juvenile during development were observed regularly under a microscope and the images were freehand sketched. 【Result】The fertilized eggs of A. frenatus were long strips, orange-red or pink, with a gourd-like oval shape in outline, with a long diameter of 2.40-2.60 mm and a short diameter of 0.90-1.20 mm. According to the division, differentiation and developmental morphology of the zygote, the embryonic development of A. frenatus could be divided into following stages:precleavage stage, cleavage stage, blastocyst stage, gastrum stage, neuroembryo stage, segmental stage, turnover stage, angiogenesis stage and organogenesis stage. It took 8-10 days for the zygote to develop and break its egg membrane. The length of the newly hatched A. frenatus was 4.10-4.50 mm. On the first day after hatching, they could open their mouths to take food. They took about 7 d to develop from larva stage to juvenile stage. The caudal, anal and dorsal fins were separated from each other and the body length at this time reached 7.67±0.48 mm. The first white stripe appeared on the 20 d after incubation. On the 30 d after hatching, the body color of juvenile fish changed from black to dark red and began to grow a second white stripe. From 50 d after hatching, the second white stripe began to fade. On the 60 d after incubation, its body color began to turn red. 【Conclusion】The actual development time of the embryo body is 8-10 d, which is longer than that of other species belonging to Amphiprion. The reason is that the fertilized eggs of the A. frenatus are larger in size. In addition, the incubation environment temperature has influence on the development time of fertilized eggs, and the higher the ambient temperature is, the faster fertilized eggs of A. frenatus develop. The feeding of larval and juvenile of A. frenatus can be divided into three stages by feeding different types of bait to ensure the high survival rate of larval and juvenile.
Key words: Amphiprion frenatus; zygote; embryonic development; fish larvae; morphology
Foundation item:“Blue Granary Technology Innovation” Project of National Key Research and Development Program of China(2019YFD0902103); Open Project of Key Laboratory of Recreational Fisheries, Ministry of Agriculture and Rural Affairs(XXYY202102); Ornamental Fish Innovation Team Project of Tianjin Mariculture Research System(ITTMRS2021004)
0 引言
【研究意义】白条双锯鱼(Amphiprion frenatus)又名番茄小丑鱼(Tomato clownfish)或红小丑鱼(Red clownfish),隶属于鲈形目(Perciformes)雀鲷科(Pomacentridae)海葵鱼亚科(Amphiprioninae),分布于印度洋和太平洋珊瑚礁海域(张芬等,2017;李晓雨等,2018)。海葵鱼是热带海水观赏鱼的重要品种,因其色彩绚丽多彩,形态甜美可爱,体型小巧灵动而备受消费者喜爱。海葵鱼除了短暂的仔稚鱼期,其生命周期中绝大部分时间与海葵共生,且能降低海葵蛰刺对自身的伤害(Feeney and Brooker,2017)。随着自然环境的破坏及人工捕捞强度的增加,自然海域海葵鱼类资源量逐年下降,但其人工繁育与养殖技术得到快速发展,因此亟待开展海葵鱼生物学特性,尤其是繁殖生物学特性的研究,进一步推动海水观赏鱼人工养殖及其相关产业的健康发展。【前人研究进展】目前,针对海水观赏鱼的研究主要集中在其生活习性、分布、分类、生理、人工繁殖及发育等方面,已实现人工繁殖的鱼类仅限于虾虎鱼科(Gobiidae)、拟雀鲷科(Pseudochromidae)和雀鲷科的部分品种。在雀鲷科中已发现的海葵鱼约有30种,能实现人工繁育的有十几种(刘亚娟等,2019)。针对海葵鱼的胚胎及仔稚鱼发育,Aratake和Naknzono(2005,2006)研究了红双带小丑鱼(A. clarkii)暂养在日本九州岛西、南2个海域中其产卵卵径和数量的季节性变化规律及卵径与蕴含能量间的关系;Liew等(2006)在实验室条件下观察了眼斑双锯鱼(A. ocellaris)胚胎发育的形态特征;Yasir和Qin(2007)研究了公子小丑鱼的繁殖习性及胚胎和仔鱼的发育过程;Dhaneesh等(2012)研究了背纹双锯鱼(A. akallopisos)的繁殖特性、胚胎发育规律及其盐度耐受性;Ye等(2011)探究了温度对红双带小丑幼鱼成活率及生长发育的影响。近年来,国内外学者对海葵鱼繁殖生物学的研究逐步深入,尤其是随着分子技术的发展,其繁殖发育过程中的性转化机制也取得一定进展(Park et al.,2010;Kim et al.,2012)。鲍鹰等(2009,2011)对白条双锯鱼和棘颊雀鲷(Premnas biaculeatus)的亲鱼、仔稚鱼培养方法进行总结;Ghosh等(2010)探究了ntl和sox3基因在白条双锯鱼胚胎发育中的表达位置,并对白条双锯鱼受精卵中胚层和神经外胚层的发育过程进行分析;鞠晨曦和吴美慧(2018)对白条双锯鱼人工养殖环境下的亲鱼饲养、幼鱼孵化及仔稚鱼喂养的技术要点进行阐述。【本研究切入点】随着海水观赏鱼产业的发展,针对海葵鱼的研究越来越多,其繁殖特性和胚胎发育规律得到进一步明确,涉及背纹双锯鱼(Dhaneesh et al.,2012)、眼斑双锯鱼(鞠晨曦等,2014)、棘颊雀鲷 (单乐州等,2015;王珊珊,2015)及毕加索小丑鱼(何丽斌等,2017)等,但至今未见有关白条双锯鱼胚胎与仔稚鱼发育形态特征变化的研究报道。【拟解决的关键问题】开展白条双锯鱼的人工孵化及养殖,通过显微镜拍照及绘制图像方式进行白条双锯鱼胚胎及仔稚鱼发育观察记录,阐明其胚胎学和早期个体发育规律,为海葵鱼的人工繁育提供科学依据。
1 材料与方法
1. 1 白条双锯鱼亲本培育
2020年6月—2021年2月,在天津市水产生态及养殖重点实验室进行白条双锯鱼亲本培育。供试亲鱼购自天津市观赏鱼市场,其来源为泰国渔民野外捕捞并进口至国内,共20尾,成功配对6组。白條双锯鱼养殖于玻璃水槽中,养殖用水为人工海水,水温(27±1)℃,盐度27‰,溶解氧>5 mg/L,光照周期12 h:12 h;投喂虾肉糜和鱿鱼肉糜,每天上、下午各投喂1次,饲料制成直径1.8~2.3 mm的球状,每次每对亲鱼投喂12~16粒,每天要及时清理残余的饲料。每3 d换水1次,每次换水量在20%左右。
1. 2 白条双锯鱼产卵、孵化及仔稚鱼培育
白条双锯鱼在产卵前利用嘴啄食和胸鳍扇动的方式,清理巢穴中岩石表面的藻类、污物及砂砾,然后将卵产于经精心清理的岩石上。白条双锯鱼产卵前后有护卵行为,可选取适当具有遮蔽性的容器作为产卵床,如花盆或瓦罐壁等。本研究选用从中间剖开的半边陶制花盆作为白条双锯鱼的产卵床和巢穴。
白条双锯鱼亲鱼通常在下午16:00时前后开始产卵,每次产卵300~700枚。雌鱼发情后以腹部摩擦产卵床排出卵子,与此同时雄鱼在雌鱼排出的卵子上射精以完成受精,形成受精卵。交配历时一般为1.5~3.0 h。受精卵的动物极形成黑褐色附着丝,协助受精卵黏附在产卵床上。产卵后,白条双锯鱼亲鱼护卵特性表现为孵化过程中精心维护产卵床环境,亲鱼面向鱼卵用其胸鳍扇动水流,为受精卵提供充足氧气。本研究于孵化缸内放置气石充气增氧,旨在产生水流吹动鱼卵块,辅助鱼卵孵化并协助仔稚鱼破膜。在孵化过程中,水温控制在(27±1)℃,盐度为27‰,使用紫外灯照射杀菌,保证盐度、水温与亲鱼缸相同。计录好受精卵破膜的时间,当天晚上紧闭门窗遮光,缓慢拿出产卵床置于孵化缸中,同时以气石持续充气,为受精卵破膜提供助力以确保孵化成功率,孵化过程一般需2.0 h左右,孵化完成后调节孵化缸气石至适量气流。
破膜后采用光照诱导收集初孵仔鱼,并转移至仔鱼缸(40 cm×25 cm×25 cm)内饲养。仔鱼孵出第1 d开始投喂经小球藻营养强化的轮虫,轮虫投放量保持在10~12个/mL;同时在白条双锯鱼仔鱼培育缸中添加小球藻。从孵出第6 d开始渐进添加丰年虾幼体,投喂密度为0.5个/mL;孵出第26 d开始投喂配合饲料,孵出第35 d开始全部转变为投喂人工配合饲料。在转食训化期间遵循单次少量的原则,避免造成仔稚鱼摄食不当而伤亡。
1. 3 观察方法
亲鱼产卵结束后,将产卵巢穴取出进行取样。亲鱼产卵第1 d每30 min取样1次,第2 d每1 h取样1次,第3 d每2 h取样1次,第4 d开始每4 h取样1次,第5 d开始每6 h取1次样。每次取样量为5~10枚受精卵。使用解剖刀将样本卵刮下并以滴管吸取,置于显微镜载玻片上进行观察。刮取后剩余的受精卵放回原缸中继续孵化,分开后的亲鱼和受精卵保持同样的水温、盐度、溶氧量及光照条件。参照刘亚娟等(2019)的方法,使用光源引诱仔稚鱼至水面并收集,在JNOEC JSZ 6型号光学显微镜(德国OPTON公司)下进行观察,后期稚幼鱼需同时配合肉眼观察,采用相机拍照记录,并在显微镜下手工绘图,记录白条双锯鱼受精卵及仔稚鱼发育过程的形态特征变化。
2 结果与分析
2. 1 白条双锯鱼胚胎发育观察
通过观察白条双锯鱼受精卵的分裂、分化及发育形态,并结合相关研究资料,可将白条双锯鱼胚胎发育过程划分为:卵裂前期、卵裂期、囊胚期、原肠期、神经胚期、体节期、翻转期、血管形成期和器官形成期(鞠晨曦等,2014;邵鑫斌等,2017)。在试验过程中约有60%的受精卵样本可较清晰观察到上述几个发育阶段的主要形态和功能特点。
2. 1. 1 受精卵形态 白条双锯鱼受精卵整体上呈长条状,轮廓类似葫芦状的椭圆形。受精卵动物极一侧有丛状的附着丝,有助于将受精卵黏附在产卵床上。附着丝在初入水中时有一定的流动性和黏性,约经10 min后缓慢呈现固化。受精卵中间部位呈内凹的圆弧,类似葫芦的细腰部。在植物极一侧圆弧较小,较动物极一侧圆弧更尖细收敛。在整个孵化过程中,卵壳形态和尺寸无明显变化,呈现出类似于蛋壳一样的刚度,并具有一定程度的弹性。白条双锯鱼受精卵长径2.40~2.60 mm,短徑0.90~1.20 mm。在淡黄色的原生质内部有0.3~0.5 mm的球形油滴,还有数目不定的小滴散布在受精卵内。卵黄呈黄澄色,整个卵块在宏观视角上呈橙红或粉红色。受精卵在进入水体后因吸水膨胀而现出卵周隙,且长径的膨胀尺度在0.30 mm左右。
2. 1. 2 卵裂期(1~4 h) 白条双锯鱼受精卵进入水体后先进行受精卵激活。水分子经过受精卵的外膜渗透作用进入外壳与卵黄绒毛膜之间,从动物极进入并逐步浸入植物极,从而将外壳与卵黄绒毛膜分离,形成卵周隙,并在植物极一侧出现明显的月牙形空间。此时,受精卵激活完成,动物极的有丝分裂开始活跃,纺锤丝开始形成并进入有丝分裂过程。
卵细胞受精1 h后,原生质开始不断地从整个受精卵向动物极一侧流动。受精1 h 20 min后,初期动物极单个大的受精卵细胞开始从正中间的部位分裂,呈现出受精卵细胞的第一道分裂沟。分裂沟持续扩展,最终将受精卵细胞分为两半,形成2个细胞,即2-细胞期(图1-1);受精2 h 10 min后,在垂直于第一道分裂沟的位置,第二道分裂沟开始成型。从动物极一侧观察,呈现出如同将蛋糕以垂直交叉切割成均匀的4个等份,即受精卵发育至4-细胞期(图1-2);此后,胚盘细胞以30~35 min的间隔进行有丝分裂,依次进入8-细胞期(图1-3)、16-细胞期(图1-4)、32-细胞期(图1-5)和64-细胞期(图1-6)。随着胚盘细胞的不断分裂,在整体胚盘体积无明显变化或稍有增大的情况下,胚盘细胞逐渐变小并开始层叠。单个胚盘细胞也从边界分明、清晰可见逐渐变为分裂沟纵横交错,且细小而难以区分。
2. 1. 3 囊胚期(4~12 h) 受精卵经卵裂不断地细分变小,直到细胞边界模糊难以区分。细胞层叠并隆起,囊胚吸附在动物极的绒毛膜一侧并开始包裹动物极的原生质膜,呈碗状或帽状(图1-7)。随着囊胚体不断地扩展并包裹绒毛膜,而形成囊胚腔(图1-8)。白条双锯鱼受精卵从受精后5~6 h开始进入囊胚期;至受精后8 h可观察到油球(图1-9),也就是中央大油滴有向动物极移动的趋势。究其原因可能是原生质因胚盘的能量消耗不断向动物极移动,从而带动脂肪球移动。在原生质的流动过程中也观察到离散的小油滴融合或破散现象。白条双锯鱼受精胚盘在受精后12 h左右开始结束囊胚期,进入原肠胚期。
2. 1. 4 原肠胚期(12~20 h) 在原肠胚期,胚体呈口袋状,起始于动物极不断向植物极扩张包裹。胚盘随着自身的不断分裂与分化,原肠胚不断变深,并逐渐包裹吞噬卵黄(图1-10)。当这种包裹扩张至卵黄的25%位置后,原肠胚一侧沿纵向出现加厚迹象,即胚体的雏形。原肠胚包裹卵黄达到50%的位置时,可明显地观察到原肠胚包裹卵黄前缘投像出来的胚环(图1-11)。原肠胚继续发育生长,在后续过程中可看到原肠胚的细胞开始向胚体聚集,促使胚体愈发粗壮、明显,但其他部位的细胞对原生质依然包裹(图1-12)。受精20 h后,受精卵开始脱离原肠胚,进入神经与体节发育期。
2. 1. 5 神经与体节发育期(20~35 h) 白条双锯鱼卵受精20 h后,胚体开始发育形成神经系统和体节。胚体与胚外膜层完全包裹原生质时,胚体发育得愈发粗厚,开始形成头部和神经外胚层。此时,贯穿胚体的神经索和神经通道也逐渐显现。在动物极附近出现视泡(视芽),也就是视原基,是白条双锯鱼眼睛的发育起源结构,在受精25 h左右开始显现(图1-13和图1-14)。同期,白条双锯鱼的吻部结构开始形成,但不是非常明显。胚环消逝,胚孔同时消失闭合。从受精23 h后开始,可观察到体节结构,体节数量为4~6个。发育进行到受精35 h后可观察到23~25个体节(图1-15)。黑色素细胞也在这一期间形成,主要出现在胚体的背部及胚外膜的大部分区域,大面积分布的黑色素细胞使得受精卵集群块肉眼观察呈棕色。卵黄的原生质被大量消耗,只剩原来下的50%~60%。胚体尾巴脱离卵黄,且尾巴具有抽甩动作。
2. 1. 6 翻转期(35~70 h) 白条双锯鱼受精卵在受精35 h后,胚體开始反转。即随着胚体尾部的不断摆动推动,以及胚体体长的发育变长,致使朝向动物极的胚体头部越过动物极而朝向植物极。整个胚体在动物极半圆形的空间内翻折(图1-16)。受精48 h后,可在受精卵样本中观察到心脏的结构。此时,心脏只是胚体头部与卵黄囊交接部的一个膜状,并逐渐发育成管状结构。心脏雏形的跳动较微弱,55~60次/min,尚未观察到明显的血细胞。值得注意的是,从受精卵受精开始即观察到卵黄中央大油滴的附近有一团黑色斑块状物质——黑色素,发育到翻转期黑色素团扩散消融,同时黑色素细胞在胚体各部均有出现。与此同时,胚体结构进一步分化,可观察到明显的耳板及嗅囊结构,但未观察到耳石。尾巴摆动越来越剧烈,更多长度的尾巴开始脱离卵黄囊,胚体头部开始越过动物极而朝向植物极(图1-17),翻转过程完成。
2. 1. 7 血管形成期(70~120 h) 受精100 h后,首次观察到血细胞的出现(图1-18)。血细胞数量逐渐增多,在心脏的泵输作用下往返于胚体与胚外膜之间,不断将胚外膜吸收的卵黄营养物质及从外界吸收氧气运输到胚体,供给胚体发育。此时,可观察到胚外膜和胚体上有纵横交错的血管通路(图1-19)。血液在心脏靠近胚外膜血管处聚集,等待心脏将其泵入胚体(图1-20),其心率达110~120次/min。视泡的尺寸增大,且颜色愈发黑亮(图1-21)。能观察卵群块,颜色转为深棕色。
2. 1. 8 器官形成期(120~150 h) 受精120 h后,胚体的血红细胞数量进一步增多,呈现出粉红色的血管通路,心肌也呈红色。心脏脉搏已加快到150~160次/min,胸鳍雏形已极为明显(图1-22)。对未破壳的受精卵进行解剖观察,发现白条双锯鱼的胸鳍已发育成熟,但背鳍、尾鳍和臀鳍依然包围着胚体的躯体,并相互连接。白条双锯鱼的吻部已基本成形,但尚未开口;消化道已形成,腹腔内壁呈现光谱样彩色光泽;眼睛已发育较成熟,乌黑且有光泽,虹膜囊散布于视网膜上;耳石成对出现(图1-23)。整个胚体的尺寸已发育生长至卵长径的1.4~1.6倍。
2. 1. 9 孵化期(150~210 h) 胚体在卵膜内弯曲,卵壳尺寸并未发生明显变化,但膨大的胚体几乎充满整个卵壳(图1-24)。心包已完全发育成形,心脏脉搏已加快到160~170次/min。整个胚体的尺寸已发育生长至卵长径的1.8~2.0倍。仔鱼尺寸达4.10~4.50 mm,而卵黄尺寸仅为0.50~0.80 mm。剧烈摆动的尾部击破卵壳,仔鱼从尾部破壳而出。
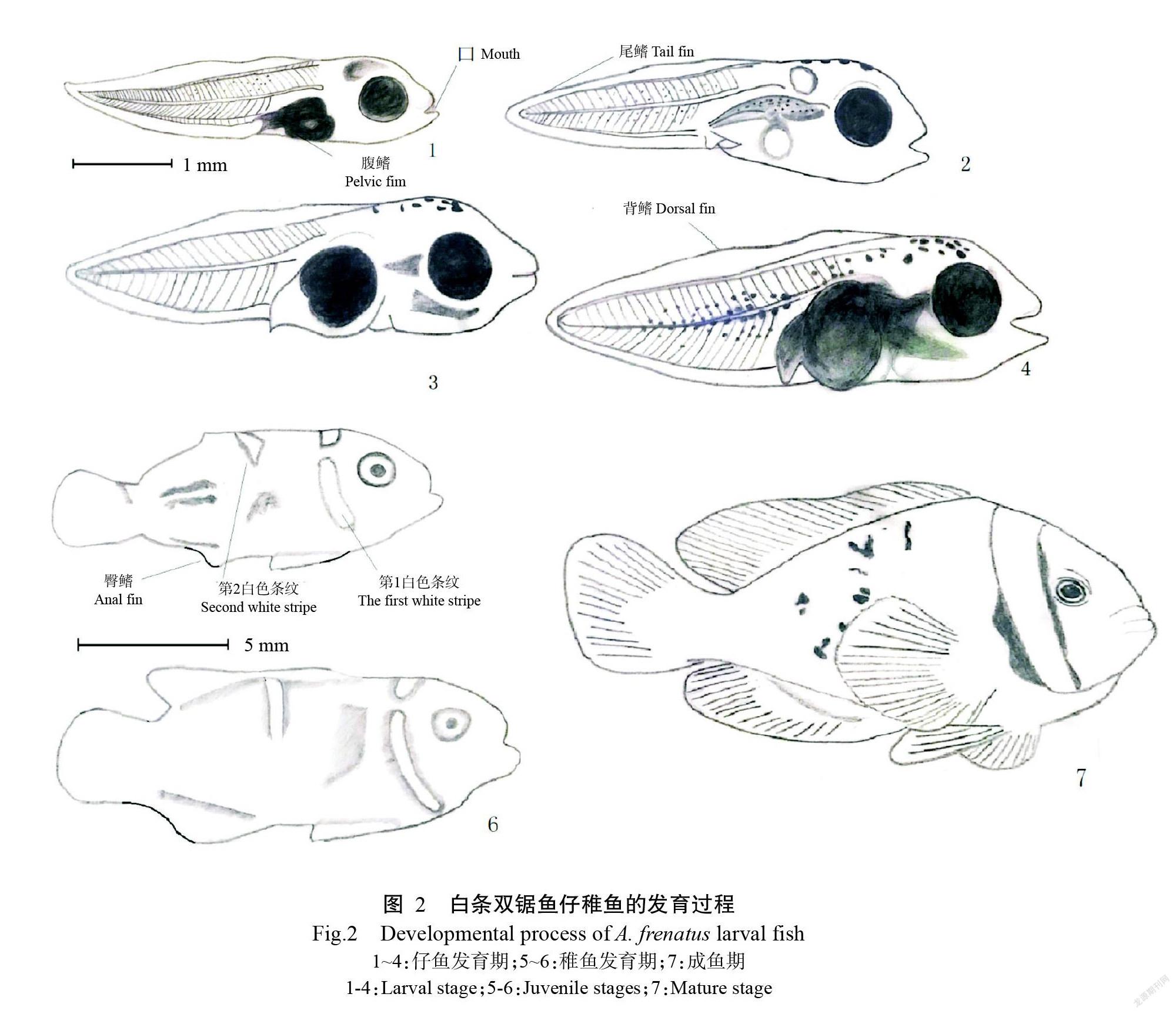
2. 2 白条双锯鱼仔稚鱼形态学观察
刚出壳的白条双锯鱼仔鱼体长4.10~4.50 mm。孵出1 d后仔鱼即可摄食,此时投喂轮虫;刚孵出仔鱼的背鳍褶皱连接着尾鳍和臀鳍褶皱,鳍状体下的鳍条逐渐明显,背鳍和臀鳍开始在鳍褶上发育。与其他海葵鱼不同的是,白条双锯鱼的背鳍连接为一体,其后部较长,飘逸而出。消化道内充满食物,呈绿色;红色素开始显现,鱼体呈澄红色。孵出后第7 d仔鱼转变为稚鱼,尾鳍、臀鳍和背鳍彼此分离,此时的体长达7.67±0.48 mm;孵出后第14 d,稚鱼的体长达12.53±0.65 mm;孵出后第18 d,其体长达16.54±1.86 mm,此时整个幼鱼呈橘红色;孵出后第20 d,在白条双锯鱼稚鱼眼睛的后部、腮的前部生长出一条从头顶向下颌的白色条纹,条纹宽度达2.50~3.50 mm,是白条双锯鱼较有标志性的条纹;背鳍中部同样出现一条白色条纹,但在后续发育过程中逐渐退化消失。
在发育过程中,白条双锯鱼仔稚鱼的体色也发生明显变化。刚出壳的仔鱼呈澄红色,后逐渐转变为橘红色,从孵出后第15 d起仔稚鱼体色变黑;至孵出后第20 d开始出现第一道白色条纹;孵出后第30 d仔稚鱼体色由黑色转为暗红色,并开始长出第二道白色条纹;从孵出后第50 d第二道白色条纹开始褪去;至孵出后第60 d其体色开始转为红色。
3 讨论
3. 1 白条双锯鱼胚胎发育过程及孵化时间
白条双锯鱼卵为黏性卵,包含有大油滴且布满细小油滴,拍摄图片时受精卵结构易被油滴干涉遮挡。为此,本研究采用显微镜拍照结合手绘制图的方法对白条双锯鱼受精卵发育过程进行详细阐述,结果发现白条双锯鱼受精卵的各发育阶段与已研究报道的雀鲷科海葵鱼亚科双锯鱼属鱼类相似,包括棘颊雀鲷、眼斑双锯鱼、背纹双锯鱼、克氏双锯鱼(A. clarkii)及黑双锯鱼(A. melanopus)等,但不同研究对海葵鱼受精卵发育阶段的划分略有不同。何丽斌等(2017)将其划分为受精卵期、胚盘期、卵裂期、囊胚期、原肠胚期、神经胚期和器官形成期,王珊珊(2015)则将胚盘期列为卵裂前期,同时在神经胚期后增加了体节期、翻转期和血管形成期,并在最后阶段增加了孵化期。本研究参照王珊珊(2015)的划分方法对白条双锯鱼的胚胎发育阶段进行划分,且描述更清晰。
海葵鱼的胚胎发育过程与水温、光照、盐度、供氧量、气流水流强度及品种等密切相关。一般情况下,水温越高的孵化环境其孵化破壳时间越短。与其他的海葵鱼品种相比,白条双锯鱼的受精卵尺寸更大,发育所需的时间更长。鲍鹰等(2009)研究表明,在水温(26±1)℃、盐度30‰~32‰的条件下白条双锯鱼人工孵化时间为10 d;Anto和Turingan(2010)研究发现,在水温(25±1)℃、盐度(32±1)‰的条件下白条双锯鱼孵化时间为8~11 d;Ghosh等(2010)在白条双锯鱼的研究中统计得知其孵化时间为7 d;Dhaneesh等(2012)研究表明背纹双锯鱼的孵化时间为6.5 d;张薇(2019)对白条双锯鱼野生鱼、眼斑双锯鱼野生鱼、海葵双锯鱼(A. percula)选育种和眼斑双锯鱼选育种的胚胎发育进行观察,发现4种海葵鱼的孵化时间均大于7 d;何丽斌等(2017)研究证实水温为(26±1)℃时毕加索小丑鱼的孵化时间约9 d;而本研究观察得知白条双锯鱼的孵化时间为8~10 d,可能由于孵化水温(27±1)℃略高所致。可见,不同品种海葵鱼受精卵孵化时间的差异主要是因品种及孵化水温等条件不同所导致。
3. 2 白条双锯鱼仔稚鱼饲养培育
白条双锯鱼仔稚鱼喂养可分為3个阶段。第一阶段通常是指孵出破壳后第1~5 d,主要饵料为轮虫;第二阶段为孵出破壳后第6~25 d,主要投喂丰年虾幼体;第三阶段为孵出破壳第26 d以后,可适当投喂鱼虾肉糜,并投喂配合饲料。试验期间每隔4~7 d均需对养殖缸进行清洁,防止藻类和细菌滋生导致白条双锯鱼发病死亡。鞠晨曦等(2014)建议在眼斑双锯鱼孵化后1~7 d喂食轮虫,孵化后3~7 d可适当增加丰年虫,至幼鱼体长超过1 cm后可喂食颗粒饲料。单乐州等(2015)研究透红小丑鱼繁殖习性及胚胎发育时发现,初孵仔鱼宜投喂轮虫,孵化15 d后开始喂食卤虫无节幼体,45 d后开始投喂配合饲料。白条双锯鱼人工繁育过程中的主要饵料依次为轮虫、卤虫无节幼体及人工配合饲料。
4 结论
白条双锯鱼胚体发育时间为8~10 d,相较于双锯鱼属其他品种需要更长的孵化时间,究其原因是白条双锯鱼受精卵尺寸更大。此外,孵化环境温度对受精卵的发育时间有明显影响,在适当范围内,环境温度越高白条双锯鱼受精卵发育速度越快。白条双锯鱼仔稚鱼饲养宜分为3个阶段喂养不同类型的饵料,以保证仔稚鱼的高成活率。
参考文献:
鲍鹰,张鹏,祝承勇,刘鸣,徐莹,王沿淞. 2011. 棘颊雀鲷人工繁殖与育苗的初步研究[J]. 海洋科学,35(3):67-71. [Bao Y,Zhang P,Zhu C Y,Liu M,Xu Y,Wang Y S. 2011. Artificial breeding of the anemonefish Premnas bia-culeatus[J]. Marine Science,35(3):67-71.]
鲍鹰,张鹏,祝承勇,王伟,刘鸣. 2009. 红小丑人工繁殖和育苗的初步研究[J]. 海洋科学,33(2):5-10. [Bao Y,Zhang P,Zhu C Y,Wang W,Liu M. 2009. Artifical breeding of the anemonefish Amphiprion frenatus[J]. Marine Sciences,33(2):5-10.]
何丽斌,朱志煌,马敏宁,张河长,吴孙龙,杨求华,周宸,林琪,黄瑞芳. 2017. 毕加索小丑鱼胚胎发育的形态学观察[J]. 应用海洋学学报,36(4):545-549. [He L B,Zhu Z H,Ma M N,Zhang H C,Wu S L,Yang Q H,Zhou C,Lin Q,Huang R F. 2017. Morphological observation on embryonic development of Picasso clownfish[J]. Journal of Applied Oceanography,36(4):545-549.] doi:10.3969/J.ISSN.2095-4972.2017.04.011.
鞠晨曦, 吴美慧. 2018. 小丑鱼的人工繁殖技术要点[J]. 水产养殖,39(2):10-13. [Ju C X,Wu M H. 2018. Key points of artificial breeding technology of clownfish[J]. Journal of Aquaculture,39(2):10-13.] doi:10.3969/j.issn.1004-2091.2018.02.004.
鞠晨曦,李云,刘红,蔡生力. 2014. 眼斑双锯鱼胚胎发育的形态学观察[J]. 海洋渔业,36(1):8-15. [Ju C X,Li Y,Liu H,Cai S L. 2014. Morphological observation on embryonic development of Amphiprion ocellaris[J]. Marine Fishery,36(1):8-15.] doi:10.3969/j.issn.1004-2490.2014. 01.002.
李晓雨,田燚,王伟,李延涛,刘钢,郭然,丛佳. 2018. 低盐胁迫对白条双锯鱼相关生理指标的影响[J]. 大连海洋大学学报,33(5):614-619. [Li X Y,Tian Y,Wang W,Li Y T,Liu G,Guo R,Cong J. 2018. Effects of low salinity stress on physiological indices in tomato clownfish Amphiprion frenatus[J]. Journal of Dalian Ocean University,33(5):614-619.] doi:10.16535/j.cnki.dlhyxb.2018.05.011.
刘亚娟,胡静,马振华. 2019. 小丑鱼繁殖生物学研究进展[J]. 水产科学,38(4):575-580. [Liu Y J,Hu J,Ma Z H. 2019. Progress on reproductive biology of clownfish:A review[J]. Fisheries Science,38(4):575-580.] doi:10. 16378/j.cnki.1003-1111.2019.04.020.
单乐州,邵鑫斌,闫茂仓,曹醒戈. 2015. 透红小丑鱼的繁殖习性、胚胎发育和胚后发育[J]. 水产科技情报,42(1):25-29. [Shan L Z,Shao X B,Yan M C,Cao X G. 2015. Reproductive habits,embryonic development and postembryo development of the red clownfish(Premnas biaculeatus)[J]. Fisheries Science & Technology Information,42(1):25-29.] doi:10.16446/j.cnki.1001-1994.2015.01.006.
邵鑫斌,單乐州,林少珍,闫茂仓,张立宁. 2017. 小丑鱼规模化养殖技术[J]. 中国科技成果,18(18):47-49. [Shao X B,Shan L Z,Lin S Z,Yan M C,Zhang L N. 2017. Clownfish scale breeding technology[J]. Chinas Scientific and Technological Achievements,18(18):47-49.] doi:10.3772/j.issn.1009-5659.2017.18.024.
王珊珊. 2015. 环境因子对棘颊雀鲷的产卵及胚胎发育的影响[D]. 舟山:浙江海洋学院. [Wang S S. 2015. The impact of environmental factors on Premnas biaculeatus spawning and embryonic development[D]. Zhoushan:Zhejiang Ocean University.]
张芬,王亚如,朱志煌,林琪,杜虹. 2017. 虾青素对红小丑鱼消化酶活性的影响[J]. 渔业研究,39(3):188-194. [Zhang F,Wang Y R,Zhu Z H,Lin Q,Du H. 2017. Astaxanthin on the influence of digestive enzyme activity of Amphiprion frenatus[J]. Journal of Fisheries Research,39(3):188-194.] doi:10.14012/j.cnki.fjsc.2017.03.004.
张薇. 2019. 雀鲷科(Pomacentridae)几种鱼类胚胎发育比较及体色发生的初步研究[D]. 上海:上海海洋大学. [Zhang W. 2019. Preliminary study on embryonic development comparison and body color development in several fishes of Pomacentridae[D]. Shanghai:Shanghai Ocean University.] doi:10.27314/d.cnki.gsscu.2019.000132.
Anto J,Turingan R G. 2010. Relating the ontogeny of functional morphology and prey selection with larval mortality in Amphiprion frenatus[J]. Journal of Morphology,271(6):682-696. doi:10.1002/jmor.10826.
Aratake H,Naknzono A. 2005. Relationship between egg size and its energy content in anemonefish,Amphiprion clar-kiai[J]. Faculty of Agriculture,Kyushu University,60(2):203-206. doi:10.15017/4364.
Aratake H,Nakazono A. 2006. Seasonal change of egg size and number in the anemonefish Amphiprion clarkii at two different localities in the temperate Kyushu,Japan[J]. Faculty of Agriculture,Kyushu University,61(1):83-91. doi:10.15017/4387.
Dhaneesh K V,Devi K N,Ajith Kumar T T,T Balasubramanian,Tissera K. 2012. Breeding,embryonic development and salinity tolerance of Skunk clownfish Amphiprion akallopisos[J]. Journal of King Saud University-Science,24(3):201-209. doi:10.1016/j.jksus.2011.03.005.
Feeney W E,Brooker R M. 2017. Anemonefishes[J]. Current Biology,27(1):R6-R8. doi:10.1016/j.cub.2016.07.046.
Ghosh J,Wilson R W,Kudoh T. 2010. Normal development of the tomato clownfish Amphiprion frenatus:Live ima-ging and in situ hybridization analyses of mesodermal and neurectodermal development[J]. Journal of Fish Bio-logy,75(9):2287-2298. doi:10.1111/j.1095-8649.2009. 02447.x.
Kim N N,Shin H S,Habibi H R,Lee J,Choi C Y. 2012. Expression profiles of three types of GnRH during sex-change in the protandrous cinnamon clownfish,Amphi-prion melanopus:Effects of exogenous GnRHs[J]. Comparative Biochemistry and Physiology. Part B:Biochemistry & Molecular Biology,61(2):124-133. doi:10.1016/j.cbpb.2011.10.003.
Liew H J,Ambak M A,Abol-Munafi A B,Chuah T S. 2006. Embryonic development of clownfish,Amphiprion ocellaris under laboratory conditions[J]. Journal of Sustaina-bility Science and Management,1(1):64-73.
Park M S,Choi C Y,Kim N N,An K W,Lee J,Kil G S. 2010. Molecular cloning and expression of TRα and TRβ in the protandrous cinnamon clownfish,Amphiprion melanopus during sex reversal[J]. Marine and Freshwater Behaviour and Physiology,43(5):371-384. doi:10.1080/10236244.2010.511128.
Yasir I,Qin J G. 2007. Embryology and early ontogeny of an anemonefish Amphiprion ocellaris[J]. Journal of the Marine Biological Association of the United Kingdom,87(4):1025-1033. doi:10.1017/S0025315407054227.
Ye L,Yang S Y,Zhu S M,Liu M,Lin J Y,Wu K C. 2011. Effects of temperature on survival,development,growth and feeding of larvae of yellow tail clownfish Amphiprion clarkii (Pisces:Perciformes)[J]. Acta Ecologica Sinica,31(5):241-245. doi:10.1016/j.chnaes.2011.06.003.
(責任编辑 陈德元)
