慢性阻塞性肺疾病合并肺动脉高压病人血清CRP、CysC和ET-1水平变化及临床意义
2021-04-14李丽
李 丽
慢性阻塞性肺疾病(COPD)是一种以气流阻塞为主要特征的慢性支气管炎和(或)肺气肿疾病,不仅会引发病人出现慢性咳嗽、咳痰、气短、呼吸困难等症状,还易诱发一系列的并发症,如慢性肺源性心脏病、慢性呼吸衰竭、自发性气胸、肺动脉高压等。肺动脉高压(PAH)是COPD最常见和最严重的并发症之一,不仅会增加COPD病人急性加重发作和再入院的风险,还会诱发右心衰竭和导致死亡[1]。因此,呼吸科临床需积极分析COPD并发PAH的危险因素,再根据相关因素对病人给予积极的干预治疗,预防和降低肺动脉高压的发生,控制病情进展和降低死亡率[2]。有研究证实,在PAH发生的整个生理病理过程中,血清C-反应蛋白(CRP)、血清胱抑素C(CysC)和内皮素-1(ET-1)等炎性细胞因子发挥了重要的作用,与疾病的发生和严重程度有密切的相关性[3-5]。本研究旨在探讨COPD合并肺动脉高压病人血清CRP、CysC及ET-1水平变化特征及其临床意义,现报道如下。
1 资料与方法
1.1 临床资料 选择我院呼吸内科2018年1月—2019年3月收治的210例COPD病人。纳入标准:符合中华医学会“慢性阻塞性肺疾病诊治指南(2013年版)”的诊断标准[6];医院伦理委员会批准,病人知情同意且依从性良好。排除标准:合并呼吸睡眠暂停综合征、肺栓塞、支气管哮喘;严重糖尿病,肝肾功能不全者;风湿性或免疫系统疾病、恶性肿瘤,近期进行过重大手术者;智力或精神障碍,不能配合研究者。210例病人中,男157例,女53例;年龄49~85(64.7±5.8)岁;体质指数20.5~29.1(24.3±1.2)kg/m2;病程4~26(11.8±4.6)年。合并高血压病27例,轻中度糖尿病15例,高脂血症34例。
1.2 研究方法
1.2.1 分组 使用彩色多普勒超声心动图仪检测肺动脉收缩压(PASP),根据检测结果,参照欧洲心脏病协会和欧洲呼吸病协会制订的《肺动脉高压诊断和治疗指南》[7],将其分为合并肺动脉高压组(136例,PASP≥40 mmHg,1 mmHg=0.133 kPa)和未合并肺动脉高压组(74例,PASP<40 mmHg)。合并肺动脉高压组病人分为3个亚组:轻度高压组(44例,PASP<40 mmHg)、中度高压组(52例,PASP 40~60 mmHg)、重度高压组(40例,PASP>60 mmHg)。合并肺动脉高压组与未合并肺动脉高压组,以及轻度高压组、中度高压组和重度高压组性别、年龄、体重等一般资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2.2 方法 病人入院后次日清晨采集空腹血3 mL,采用免疫透析比浊法测定血清CRP水平,采用化学发光免疫法测定血清CysC水平,采用放射免疫法测定血清ET-1水平。抽取上肢动脉血,检测动脉血氧分压(PaO2);检测用力肺活量(FVC)和第1秒用力呼气容积(FEV1)等肺功能指标。比较COPD合并肺动脉高压组和未合并肺动脉高压组血清CRP、CysC及ET-1水平。比较轻度高压组、中度高压组与重度高压组血清CRP、CysC及ET-1水平及PaO2、FVC和FEV1等肺功能指标,以及随访6个月的心血管不良事件率、再入院率和死亡率等疾病转归指标。
1.3 统计学处理 采用SPSS 20.0统计软件进行数据处理。定量资料以均数±标准差(x±s)表示,采用t检验;定性资料以例数(%)表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 合并肺动脉高压组与未合并肺动脉高压组炎性因子水平比较 COPD合并肺动脉高压组血清CRP、CysC和ET-1水平均高于未合并肺动脉高压组,差异均有统计学意义(P<0.05)。详见表1。

表1 合并肺动脉高压组与未合并肺动脉高压组炎性因子水平比较 (x±s)
2.2 合并肺动脉高压组3个亚组炎性因子水平比较 血清CRP、CysC和ET-1水平比较:重度高压组>中度高压组>轻度高压组,组间比较差异均有统计学意义(P<0.05)。详见表2。
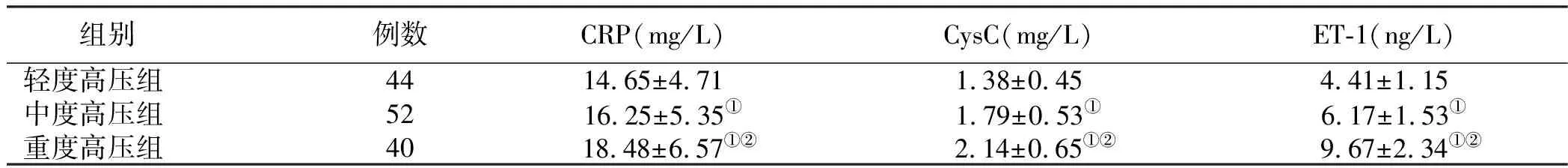
表2 合并肺动脉高压组3个亚组炎性因子水平比较 (x±s)
2.3 合并肺动脉高压组3个亚组肺功能指标比较 重度高压组PaO2、FVC和FEV1低于中度高压组与轻度高压组,中度高压组低于轻度高压组,组间比较差异均有统计学意义(P<0.05)。详见表3。
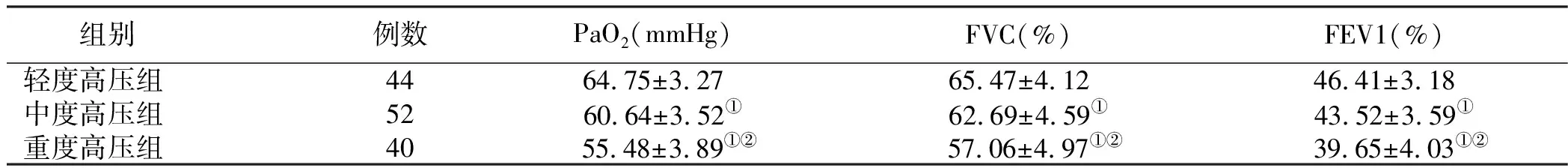
表3 合并肺动脉高压组3个亚组肺功能水平比较 (x±s)
2.4 合并肺动脉高压组3个亚组疾病的转归指标比较 重度高压组随访6个月内的心血管不良事件发生率、再入院率和死亡率均高于中度高压组与轻度高压组,中度高压组高于轻度高压组,组间比较差异均有统计学意义(P<0.05)。详见表4。
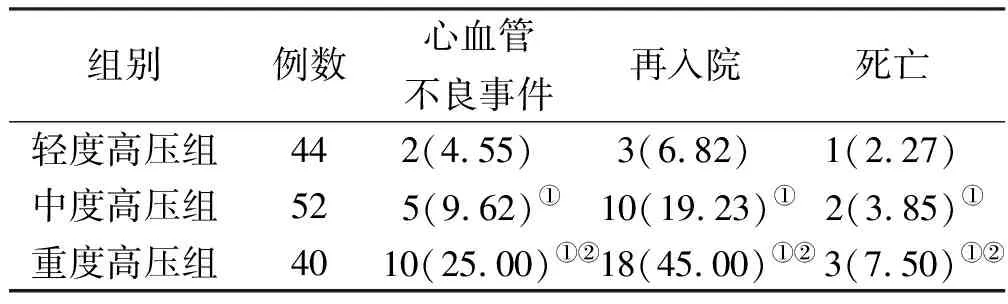
表4 合并肺动脉高压组3个亚组的疾病转归指标比较 单位:例(%)
3 讨 论
COPD是临床最常见的慢性呼吸系统疾病之一,不仅会引发病人出现慢性咳嗽、咳痰、气短、呼吸困难等症状,随着疾病的发展还会逐渐降低病人肺内气体交换容积,小气道发生狭窄,从而引发其出现低氧血症,导致和加重机体长期处于慢性缺氧状态,使肺血管阻力和肺动脉压力进行性增加,进而引发肺动脉高压[8]。COPD病人一旦发生肺动脉高压,不仅会加速病情进展,同时会明显增加病人致残和死亡的风险。因此,临床应高度重视COPD并发肺动脉高压病人,分析诱发肺动脉高压的危险因素,采取相应的措施及早对病人进行干预和治疗,才能改善疾病的预后[9]。
CRP不仅能调控内皮细胞和刺激单核细胞产生细胞因子、组织因子等,同时还能影响肺部血管重塑和促进肺循环血管阻力增加,并促使血管顺应性降低,易促进肺动脉高压形成,无论是在COPD的稳定期或急性加重期,均可作为一种重要的炎性指标。CysC能有效反映肾小球滤过功能,被临床作为肾损伤标记物。有研究证实,COPD病人的肺循环阻力增加,机体缺氧加重,易引发低氧血症导致巨噬细胞等炎症细胞及组织细胞缺氧受损释放出具有蛋白酶活性的细胞因子,从而使抗蛋白酶系统被激活,进而代偿性增高血清CysC水平[10]。COPD合并肺动脉高压病人血流动力学异常对肾脏的血液灌注量产生不良影响,血清CysC可随肾功能水平降低而升高,可作为COPD合并肺动脉高压病人的一个敏感指标[11]。ET-1是一种血管内皮细胞因子,内皮素B型(ETB)和内皮素A型(ETA)受体相互作用使ET-1诱导支气管黏膜下腺分泌,收缩平滑肌,激活血小板,刺激肺成纤维细胞和气道平滑肌细胞增生肥大;还可损伤内皮细胞,使肺动脉重构加重,从而促进肺动脉高压形成[12]。因此,ET-1与包含肺动脉高压在内的多种血管性疾病的发病均具有密切的相关性。
近年来,随着临床对COPD研究的不断深入,国内外研究均证实,COPD病人早期可出现肺动脉结构和功能改变,在疾病早期肺动脉壁可发现炎性浸润,提示在肺血管重塑过程中炎性反应起着关键性作用,肺动脉血管内皮损伤与炎性细胞浸润密切相关[13-14]。因此,检测和分析COPD合并肺动脉高压病人血清CRP、CysC 及ET-1等炎性因子水平,将有助于早期诊断和治疗该合并症[15]。本研究结果显示,合并肺动脉高压组血清CRP、CysC及ET-1水平均高于未合并肺动脉高压组,且重度高压组高于中度高压组和轻度高压组(P<0.05)。本研究结果显示,重度高压组心血管不良事件发生率、再入院率和死亡率均高于中度高压组与轻度高压组(P<0.05)。说明血清CRP、CysC及ET-1水平检测可作为判断COPD病人是否发生肺动脉高压的重要指标,还能判断COPD合并肺动脉高压的严重程度,与疾病转归有显著的正相关[16]。
综上所述,COPD合并肺动脉高压病人血清CRP、CysC及ET-1水平与肺动脉高压严重程度有关,炎性细胞因子与疾病的转归也有关系。因此,对COPD合并肺动脉高压病人进行血清CRP、CysC 及ET-1水平的检测,有助于指导临床医师正确评估COPD病人的疾病分期和严重程度,并适时采取相应的降压治疗以改善疾病预后。
