艾塞那肽促进肥胖糖尿病大鼠胰腺组织的胆固醇流出
2021-04-14张晓宁冯聚玲肖忠盛陈向恒唐卫平
赵 磊,张晓宁,冯聚玲,肖忠盛,刘 泳,龙 泓,陈向恒,唐卫平
南华大学附属第一医院1胃肠外科,3肝胆外科,湖南 衡阳421001;2南华大学衡阳医学院转化医学研究室,湖南 衡阳421001
胆固醇是细胞膜保持稳态必不可少的组成。细胞膜胆固醇蓄积和缺乏均可引起细胞功能障碍。胆固醇毒性是胰岛脂毒性的重要组成[1]。胆固醇蓄积导致β细胞功能障碍,是2型糖尿病发生的重要原因[2]。研究发现抑制小鼠胆固醇酯化导致细胞胆固醇酯减少,抑制胰腺癌的生长和转移[3]。胆固醇平衡最重要的调节途径是胆固醇逆向转运(RCT)[4]。RCT的本质是由机体细胞过量的胆固醇通过血液输送到肝脏和小肠。控制RCT 最重要的转运蛋白是ATP 结合盒转运体A1(ABCA1)[5]。研究证实ABCA1在β细胞胆固醇稳态的重要作用。糖毒性、脂毒性是肥胖合并2型糖尿病的主要特征[6]。糖尿病小鼠的巨噬细胞ABCA1表达下调,高糖抑制细胞胆固醇流出[7]。高糖通过p38 MAPK信号级联反应抑制ABCA1启动子活性,下调平滑肌细胞ABCA1表达,加速动脉粥样硬化形成[8]。高糖及高脂通过减少ABCA1和ABCG1调控的胆固醇流出促进动脉粥样硬化发展[9]。
胰高血糖素样肽-1(GLP-1)受体激动剂是一类具有良好降糖效果的肠促胰岛素类似物[10]。艾塞那肽是第一个应用于临床治疗糖尿病的肠促胰岛素激动剂[11]。艾塞那肽通过激动GLP-1受体以葡萄糖浓度依赖的方式增强胰岛素分泌[12]。艾塞那肽可明显改善胰岛功能,但其胰腺安全性存在争议。基于艾塞那肽与胰腺炎症及肿瘤之间相关性的研究结果存在不一致,甚至相互矛盾[13-16]。有研究显示GLP-1可改善胆固醇毒性所致的胰腺细胞凋亡[17]。但艾塞那肽对糖脂毒性状态下机体胰腺组织胆固醇流出有无影响目前没有报道。本研究利用肥胖糖尿病大鼠模型研究艾塞那肽对大鼠胰腺组织ABCA1表达及胆固醇代谢的影响。
1 材料和方法
1.1 实验动物
SD(Sprague-Dawley)大鼠48只(湖南斯莱克景达实验动物有限公司)空腹血糖测定1周,其结果(均值)作为正常参考值,然后随机选取24只为实验组大鼠,行高脂高糖喂养8周后,腹腔注射链脲佐菌素(STZ,35 mg/kg)1次。造模成功标准:在注射链脲佐菌素后第3天取大鼠尾静脉血液,分别测随机血糖3次,平均值大于16.7 mmol/L,大鼠出现体质量下降,饮水及进食增多。排除血糖不达标及注射后死亡的动物6只,18只糖尿病大鼠造模成功。
1.2 主要试剂与设备
ABCA1抗体购自英国Abcam公司,艾塞那肽粉末购自中国吉尔公司,丽春红、苏木素(Sigma),链脲菌素(MP Biomedicals),低温离心机(Eppendorf),电泳仪(Bio-Rad),ECL Plus 超敏发光液(Thermo pierce),PVDF 膜(Millipore),ELISA 检测试剂盒(R & D Systems)。
1.3 分组方案及处理
SD雄性大鼠48只,6周龄,体质量180~250 g(其中随机选取24只大鼠造模为肥胖糖尿病大鼠,排除血糖不达标及死亡6只)共分为4组,A:正常大鼠注射生理盐水组,B:正常大鼠注射艾塞那肽组,C:肥胖糖尿病大鼠注射生理盐水组,D:肥胖糖尿病大鼠艾塞那肽组,A、B组各12只,C、D组各9只。给药第10周末所有的大鼠用10%水合氯醛按每100 g体质量0.3 mL腹腔注射麻醉。剪开胸腔,暴露心脏,经左心室灌注0.9%PBS缓冲液约300 mL,直到大鼠肝脏颜色变浅,完整剪取胰腺组织分为2 份,1 份剪碎保存于-80 ℃冰箱保存用于Western blot,1份多聚甲醛固定用于油红O染色。
1.4 指标监测
肥胖糖尿病大鼠造模成功后,B组和D组以艾塞那肽每次5 μg/kg分别于早8∶00晚18∶00各皮下注射1次,注射1 h后进食,每周称量大鼠质量1次,根据体质量调整注射剂量。每周取尾静脉血,使用快速血糖仪检测血糖。给药后第10周处死大鼠,大鼠心脏采血后3000 r/min离心10 min后分离血清,检测血清甘油三酯(TG)、血清总胆固醇(TC)、谷丙转氨酶(ALT)、胰岛素敏感指数(ISI)=ln[1/(FBG×FINS)],胰岛素抵抗指数(IRI)=(FBG×FINS)/22.5。
1.5 蛋白质免疫印迹
使每个样品总蛋白上50~100 μg 计算各个样品所需取样量。配10%分离胶,加入TEMED后立即摇匀即可灌胶。灌胶后,用异丙醇封胶。配5%的浓缩胶,加入TEMED后立即摇匀即可灌胶。将剩余空间灌满浓缩胶然后将梳子插入浓缩胶中。根据蛋白定量的结果,第1孔点入maker,其它每空上样10 μL已变性蛋白,开始电泳。切胶ABCA1(254 000),β-actin(42 000)。转膜300 mA,ABCA1约150 min,β-actin 约1 h。转膜完毕后,用丽春红染膜,检测蛋白转膜的效率。
1.6 Real-time PCR
提取细胞总RNA,Trizol提取细胞总RNA,RNA的琼脂糖凝胶电泳,电泳槽用3%的双蒸水(灭菌DEPC处理水配制)处理0.5 h;配制1%变性琼脂糖凝胶,0.2 g琼脂糖,20 mL无菌DEPC处理水,加热至琼脂糖溶解,冷至60 ℃,加入0.5 μLEB(10 mg/mL),混匀后倒胶;取2 μL提取的RNA,按1∶5的比例与loading buffer premix混匀,170 V恒压电泳,溴酚蓝前沿迁移至凝胶总长2/3处停止电泳;凝胶成像系统下观察。以细胞总mRNA为模板,逆转录cDNA,在NCBI上搜索目的基因的序列,运用primer5软件设计引物,由上海生工合成引物。Rat-ABCA1-F:5'-GGTGGTGTTCTTCCTCGTTAC-3,Rat-ABCA1-R:5'-TCCTCGTCCTCGTCATTCAA-3。
1.7 油红O染色
取出爬片,PBS洗3次。10%甲醛室温、摇床固定10 min,弃甲醛。60%异丙醇润洗1次。加入油红O工作液(储备液和蒸馏水3∶2稀释),室温、摇床染色30 min。甘油封片、镜下观察。
1.8 组织胆固醇含量测定
将待测组织放入裂解液,混匀,静置10 min,离心5 min,取上清用于酶学测定。将5 mmol/L胆固醇标准品用无水乙醇稀释为2500、1250、625、312.5、156、78、39 μmol/L。通常稀释4个点即可。注意设置零浓度空白对照管。取190 μL工作液加入微板,在各工作液中,分别加入10 μL(5~10 μL)空白对照溶液(无水乙醇或蒸馏水均可)、标准品、待测样品。测定各管A550nm值,绘制标准曲线并计算浓度。
1.9 HE 染色
切片脱蜡,水化后切片放入苏木精水溶液染色,用自来水冲洗切片,然后分别入75%和85%酒精各脱水2 min,入0.5%的伊红染色液染色1 min;脱水透明,将切片平放,用镊子夹取少量中性树胶放置于切片上,显微镜下观察拍照。
1.10 统计学分析
采用GraphPad Prism 统计学软件进行分析,实验数据以均值±标准差表示,两组之间比较采用双向重复测量ANOVA 比较,组内比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 艾塞那肽对肥胖糖尿病大鼠血糖、体质量的影响

图1 各组大鼠血糖、体质量Fig.1 Changes of body weight and blood glucose in rats in each group. *P<0.05 vs before exenatide or saline injection in each group.
4组大鼠注射艾塞那肽或生理盐水后,定期检测血糖,共10周,结果如图1所示,正常SD大鼠注射生理盐水组及正常SD大鼠注射艾塞那肽组,血糖稳定。肥胖糖尿病大鼠注射生理盐水组血糖逐步升高。而肥胖糖尿病大鼠注射艾塞那肽,血糖水平随时间的推移逐渐下降。大鼠注射艾塞那肽或生理盐水后,动态监测体质量,结果如图1所示,正常SD大鼠注射生理盐水组,体质量逐渐上升,肥胖糖尿病大鼠注射生理盐水组体质量下降。而肥胖糖尿病大鼠注射艾塞那肽,体质量下降程度较前者更为明显。
2.2 各组大鼠胰腺组织ABCA1 mRNA、蛋白表达
为研究艾塞那肽对胰腺组织ABCA1表达的影响,我们检测各组大鼠胰腺组织中ABCA1 的mRNA、蛋白,结果如图2所示,与正常组相比,肥胖糖尿病大鼠的ABCA1表达明显下降。肥胖糖尿病大鼠的胰岛组织中,注射艾塞那肽比注射生理盐水组可明显提高ABCA1表达。
2.3 艾塞那肽对大鼠胰腺组织脂质沉积的影响
结果如图3所示,与SD大鼠组相比,肥胖糖尿病大鼠的胰腺组织脂质沉积明显增加。肥胖糖尿病大鼠注射艾塞那肽后,胰腺组织脂质沉积明显下降。
2.4 艾塞那肽对大鼠胰腺组织胆固醇含量的影响
结果如图4所示,相比于正常组大鼠胰腺,肥胖糖尿病大鼠的胰腺组织胆固醇含量明显增多。肥胖糖尿病大鼠注射艾塞那肽后胰腺组织胆固醇含量下降明显。
2.5 艾塞那肽对大鼠胰岛组织的影响
HE染色显示,肥胖糖尿病大鼠的胰岛体积缩小,着色较浅,空泡区较多,与周围的交界不清,排列较为疏松。注射艾塞那肽组的糖尿病大鼠胰岛较注射生理盐水组胰岛数目增多,体积增多,排列更为规则(图5)。
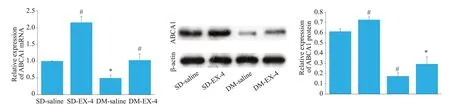
图2 各组大鼠胰腺组织ABCA1的mRNA、蛋白水平表达Fig.2 Expression of ABCA1 mRNA and protein in the pancreas of rats in each group.#P<0.05 vs SD-saline group,*P<0.05 vs DMsaline group.

图3 艾塞那肽对大鼠胰腺组织脂质沉积表达的影响Fig.3 Effect of GLP-1 on lipid deposition in rat pancreas.A:SD rats injected with saline.B:SD rats injected with exenatide.C:Obese diabetic rats injected with saline.D:Obese diabetic rats injected with exenatide.

图4 各组大鼠胰腺组织胆固醇含量Fig.4 Cholesterol content in the pancreas of rats in each group.#P<0.05 vs SD-saline group; *P<0.05 vs DM-saline group. TC: Total cholesterol; FC: Free cholesterol; CE:Cholesterol esters.
2.6 艾塞那肽对肥胖糖尿病大鼠血脂、胰岛功能的影响
结果如表1所示,肥胖糖尿病大鼠注射生理盐水组TG、TC、胰岛抵抗指数上升,胰岛敏感指数下降。注射艾塞那肽后上述指标明显改善。
3 讨论
本研究发现肥胖糖尿病大鼠胰腺组织中ABCA1表达水平显著降低,胰腺组织胆固醇含量增加,脂质沉积明显,这表明糖脂毒性影响ABCA1介导的胆固醇流出,导致胰腺组织胆固醇蓄积。进一步研究还发现该组大鼠胰岛呈现体积缩小、结构紊乱,检测结果提示大鼠血清甘油三酯、总胆固醇水平升高、胰岛分泌能力降低,这说明大鼠胰岛功能紊乱与β细胞胆固醇蓄积可能相关。
本研究中注射艾塞那肽后肥胖糖尿病大鼠胰腺组织ABCA1表达增加,胰岛形态和结构好转,组织胆固醇含量下降,胰岛分泌功能改善,这表明艾塞那肽可通过上调ABCA1表达改善糖脂毒性导致的包括胰岛β细胞在内的胰腺组织胆固醇蓄积,从而进一步改善胰腺内分泌功能。艾塞那肽降糖效果理想,同时低血糖不良反应轻微,一度被称为“智能降糖药物”。艾塞那肽通过增加β细胞再生和增殖,抑制β细胞凋亡[18]。有研究报道GLP-1R激动剂和DPP IV抑制剂可诱导胰岛β细胞增殖,减少细胞凋亡。GLP-1连续注入大鼠胰岛PDX-1表达上调,诱导β细胞增殖及新生。给糖尿病模型大鼠注射GLP-1R受体激动剂可改善葡萄糖耐量和增加胰岛β细胞增殖。而艾塞那肽是否通过促进胆固醇流出改善β细胞胆固醇蓄积,从而增强其胰岛素合成与释放功能,目前研究较少。
肝X受体(LXR)是在调节胆固醇代谢中的起核心作用的核激素受体,并且是ABCA1的主要转录激活因子[19]。LXRβ-/-小鼠的胰岛ABCA1水平降低,其GSIS受损以及胰岛组织脂质沉积增加。激活LXR使胰岛β细胞ABCA1强表达和增加胰岛素分泌[20]。在Gerin I等的研究中发现,LXRβ-/-小鼠胰岛细胞脂滴可能是胆固醇酯积累的结果,LXRβ可调控胆固醇转运蛋白ABCA1和ABCG1的表达[21]。AMP激活的蛋白激酶(AMPK)一直是治疗2型糖尿病的一个潜在的靶点。学者发现水杨酸盐可通过激活AMPKβ上调巨噬细胞的ABCA1和ABCG1表达,促进胆固醇流出[22]。在β细胞中,GLP-1与GLP-1R结合后,促使ATP的转化为胞质cAMP,进一步激活胞质内PKA/AMPK信号通路,促进GSIS[23]。GLP-1通过cAMP/AMPK信号通路直接作用LXR抑制肝细胞脂质生成[24]。上述证据提示GLP-1有可能通过激活AMPK信号通路,作用于胞核LXRβ,促进胞膜ABCA1活化,促进胰岛β细胞胆固醇流出。

图5 大鼠胰腺HE染色Fig.5 HE staining of the pancreas of rats. The volume of islet was significantly reduced, and the vacuole area was expanded in the pancreatic tissue of obese diabetic rats.A:SD rats injected with saline;B:SD rats injected with exenatide;C:Obese diabetic rats injected with saline;D:Obese diabetic rats injected with exenatide.
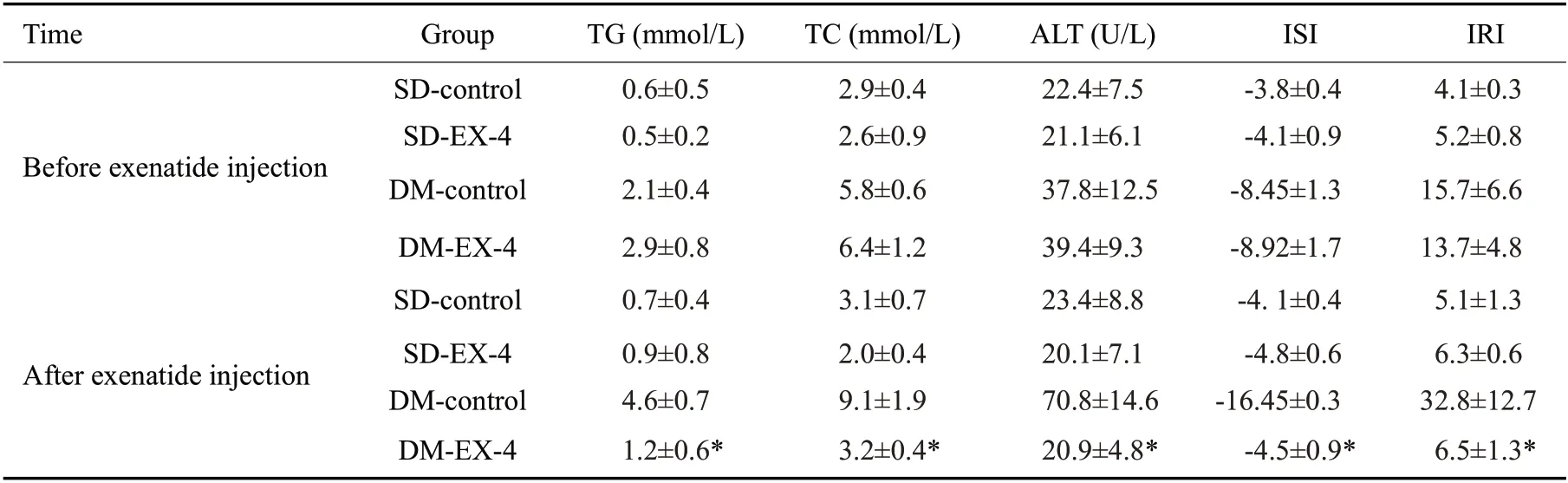
表1 各组大鼠血脂及胰岛水平的变化Fig.1 Changes of blood lipids and insulin levels in rats in each group
但艾塞那肽对胰腺组织的影响具有争议性,围绕艾塞那肽是否会引起急性胰腺炎甚至胰腺肿瘤的发生风险未形成共识,一定程度影响艾塞那肽的临床使用[25-26]。有研究表明长期应用艾塞那肽可使大鼠胰腺出现急慢性损伤,表现为腺泡细胞核固缩、胞浆空泡增多等,且腺泡炎症评分显著增加[27-28]。艾塞那肽可加速非典型性增生的胰腺上皮内成瘤(PanIN)病变的形成和生长,增加胰腺癌的发病几率[29]。但有研究显示,长期应用艾塞那肽对胰腺炎相关的生化标志物水平、胰腺组织学、导管细胞增殖或凋亡等均没有显著影响。此外研究发现某些人类胰腺癌细胞系检测有GLP-1 受体表达,但艾塞那肽并不影响胰腺癌细胞的增殖和凋亡,也不会促进裸鼠体内人类胰腺癌移植物的生长[30]。
尽管本次实验表明糖脂毒性导致大鼠胰腺组织ABCA1表达降低,其所介导的胆固醇流出受阻,胰腺组织胆固醇蓄积,而艾塞那肽可促进胰腺组织ABCA1表达,拮抗上述进程。但在艾塞那肽作用下胰腺组织具体功能的变化还需相关研究论证,内在机制研究需进一步探索,此外还需体外实验进一步研究艾塞那肽对腺泡细胞、导管细胞等胰腺细胞如的影响。
