猪宿主蛋白G3BP1对猪圆环病毒2型在PK15细胞上复制的影响
2021-04-13刘献辉张歆明申翰钦班艳芳刘艳玲张乐宜宋长绪
刘献辉,张歆明,申翰钦,班艳芳,刘艳玲,张乐宜,宋长绪*
(1.华南农业大学动物科学学院/国家生猪种业工程技术研究中心,广东 广州 510642;2.温氏食品集团股份有限公司,广东 新兴 527400)
猪圆环病毒(porcine circovirus,PCV)属于圆环病毒科,目前为止已报道了3种基因型。猪圆环病毒2型(PCV2)感染引起的疾病称为猪圆环病毒相关疾病(PCVAD),主要包括断奶仔猪多系统衰竭综合征(postweaning multisystemic weasting syndrome,PMWS)、猪皮炎与肾病综合征(porcine dermatitis and nephropathy sysndrome,PDNS)与生殖系统疾病[1-2],给全球养猪业造成了巨大的经济损失。PCV2是一种单股无囊膜DNA病毒,基因组全长1 777 bp左右,主要包括两个开放性阅读框(ORFs):编码复制蛋白(Rep)的ORF1和编码衣壳蛋白(CAP)的ORF2[3]。有研究表明,PCV2感染PK15细胞后能激活RIG-I/MDA5、cGAS/STING、NF-κB通路促进IFN-β的生成,IFN-β又能促进病毒的复制[4-5]。
先天免疫是机体防御病毒的第一道防线,模式识别受体(PRRs)是先天免疫系统中重要的免疫受体,它能够识别病原微生物存在保守的病原结构——病毒相关分子模式(PAMPs),进而诱导天然免疫的应答,激活信号级联反应,介导Ⅰ型干扰素(IFN)、细胞因子和趋化因子的产生。PRRs包括Toll样受体(TLRs)、视黄酸样受体(RLRs)、NOD受体(NLRs)和细胞质DNA受体[6]。先天免疫在防御病毒入侵过程中Ⅰ型IFN起着非常重要的作用,它能通过结合细胞表面的IFN受体,进而激活JAK-STAT信号通路,介导几百种干扰素刺激基因(ISGs)转录表达,使细胞抵御病毒的感染[7]。
宿主蛋白G3BP1(GTPase-activating protein SH3domain-binding protein 1)是应激颗粒(stress granules,SGs)重要组成分子,也是SGs的检测标志。在细胞受到环境、病毒感染等压力下,SGs形成蛋白-mRNA聚合物,导致翻译停止[8]。SGs能通过隔绝人类免疫缺陷病毒(HIV)的RNA抑制其复制[9]。SGs还是RIG-I和MDA5的定居场所,G3BP1可促进识别病毒的RNA,促进干扰素的产生并抑制病毒的复制[10-11]。最近报道G3BP1通过调控SGs进而抑制猪流行性腹泻病毒(PEDV)的复制[12],另外G3BP1可以调控IFN诱导的ISG表达,在干扰素信号通路中有着重要作用[13],G3BP1还可以招募PKR促进先天性抗病毒应答[14]。最近报道G3BP1可以促进cGAS识别DNA及催化cGAMP的产生,促进IFN-β的产生,表明G3BP1在宿主抵抗DNA病毒的感染过程中起着重要作用[15]。也有研究阐述了G3BP1可以通过正调控RIG-I介导的IFN-β表达,进而抑制RNA病毒的复制[16]。
尽管G3BP1在许多病毒感染过程中起着重要的调控作用,但未有报道其在PCV2感染过程中的功能。本文通过PCV2感染PK15细胞,研究猪的宿主蛋白G3BP1与PCV2感染过程的联系,以更好地了解PCV2的免疫机制。
1 材料与方法
1.1 细胞、病毒和质粒
PK15细胞、HEK293T细胞、真核表达质粒pCMV-HA和PCV2毒株(PCV2d)均为实验室保存。
1.2 抗体
兔源抗HA单抗、HRP标记山羊抗兔IgG均来自Sigma公司。
1.3 主要试剂
DMEM高糖细胞培养基、1%的链霉素和青霉素溶液、0.25%EDTA的胰酶购自Gibco公司;胎牛血清(FBS)购自Biological industries公司;高浓度质粒提取试剂盒、病毒核酸提取试剂盒、组织细胞RNA提取试剂盒、胶回收试剂盒购自美基公司,反转录试剂、Eastep qPCR Master Mix购自Promega公司。脂质体转染试剂Lipofectamine 3000、RNAiMAX购自Invitrogen公司。干扰素刺激DNA(interferon stimulatory DNA,ISD)购自Invivogen公司。凝胶成像仪为天能公司产品。
1.4 真核表达质粒的构建
G3BP1序列是从猪细胞中提取RNA并反转录成cDNA后,经PCR扩增得到的。参考NCBI上猪G3BP1(GenBank登录号为XR_002339497.1)的序列,在G3BP1序列上分别引进EcoRⅠ和KpnⅠ两个酶切位点,然后连接在pCMV-HA载体上,经测序鉴定,获得pCMV-HA-G3BP1真核表达载体。
1.5 G3BP1基因的过表达试验
将PK15细胞接种到12孔板中,当细胞融合度达到60%左右时,将空载体与G3BP1载体按Lipofectamine 3000 Transfection Reagent 说明书每孔转染1.2 μg,转染 24 h后,分别以感染比(MOI)为0.1和1感染细胞。
1.6 G3BP1基因敲低试验
根据猪G3BP1 mRNA序列设计了3条siRNA,如表1所示,由上海生工生物有限公司合成。按照合成说明书用二乙基焦碳酸酯(DEPC)水将siRNA稀释至20 pmol/L,保存于-20 ℃备用。将PK15细胞接种于12孔板中,待细胞融合度达到50%左右时,按Lipofectamine RNAiMAX Transfection Reagent说明书操作每孔转染10 pmol,转染24 h后提取细胞核酸用于定量分析敲低效果,或者用于接毒试验。

表1 G3BP1 siRNA oligo序列
1.7 病毒接种试验
对于G3BP1过表达或敲低的PK15细胞,分别以感染比(MOI)为0.1和1接毒,在37 ℃培养箱孵育1 h,然后用PBS清洗2遍,加入含2%FBS的DMEM培养基继续培养。分别在感染后12 h、24 h、48 h收毒,放-20 ℃冰箱。反复冻融3次后,提取病毒核酸,并用荧光定量PCR分析病毒的拷贝数。
1.8 病毒核酸的提取
采用试剂盒提病毒核酸。将12孔板里的病毒细胞液,反复冻融3次。病毒液混匀后,吸取200 μL病毒液加入20 μL蛋白酶K,然后加500 μL GRP溶液震荡混匀,静置10 min后,转移到2 mL收集管的滤柱中,12 000g离心1 min,然后加500 μL RW1溶液后,离心1 min,再加入650 μL RW2溶液,离心1 min,最后12 000g离心2 min,甩干并通过滤柱后,把过滤柱放进干净无菌的1.5 mL离心管中,加入DEPC水静置2 min,离心收集病毒核酸。核酸放-20 ℃保存,方便用于后续试验。
1.9 荧光定量PCR
荧光定量PCR引物如表2。定量引物通过Prime 3.0设计,PCV2定量引物参考文献[17]。荧光定量PCR反应体系如表3。

表2 荧光定量PCR引物

表3 荧光定量PCR反应体系
反应程序为:94 ℃预变性1 min ;94 ℃变性10 s,60 ℃退火30 s,40个循环。用绝对定量检测PCV2病毒核酸并换算成拷贝数。用相对定量测定目的基因的相对表达水平,以β-actin基因表达为内参,用2-ΔΔCT计算。
1.10 数据分析
用GraphPad Prism 5.0 软件对试验数据进行统计分析,使用Two-way ANOVA 对数据进行比对分析。
2 结果与分析
2.1 真核表达载体pCMV-HA-G3BP1的构建
PCR扩增猪G3BP1基因目的片段(1 700 bp),利用T4连接酶方法将片段连接在pCMV-HA真核表达载体上。质粒上有EcoRⅠ和kpnⅠ酶切位点,双酶切鉴定和DNA测序后,确定为目的片段的正确克隆(图1)。

M.DL5000 Marker;1.质粒pCMV-HA G3BP1的酶切图1 G3BP1真核表达载体的鉴定
2.2 真核表达载体pCMV-HA-G3BP1的表达验证
将2 μg pCMV-HA空载质粒和2 μg质粒pCMV-HA-G3BP1质粒转染到6孔板的293T细胞中,24 h后收取细胞,并用裂解液将细胞裂解。利用HA单抗进行Western blot检测后,在60 kDa处可见特异性条带(图2),与预期大小符合,表明G3BP1蛋白成功表达。

图2 蛋白质印迹法检测G3BP1的表达
2.3 过表达G3BP1促进PCV2的复制
PK15细胞转染空质粒和pCMV-HA-G3BP1,转染 24 h后,用PCV2以MOI=0.1 和MOI=1 分别感染细胞。分别在感染12 h、24 h和48 h后,采用荧光定量PCR分析病毒的拷贝数,见图3、图4。

图4 PCV2感染过表达G3BP1的PK15细胞Cap拷贝数(MOI=1)
过表达G3BP1试验组与对照组相比,PCV2感染24 h后,病毒复制增强且差异显著(P<0.05),感染48 h后较感染24 h后病毒复制的差异更为显著(P<0.01)。在MOI=0.1和MOI=1的感染细胞上,可观察到一致的结果。
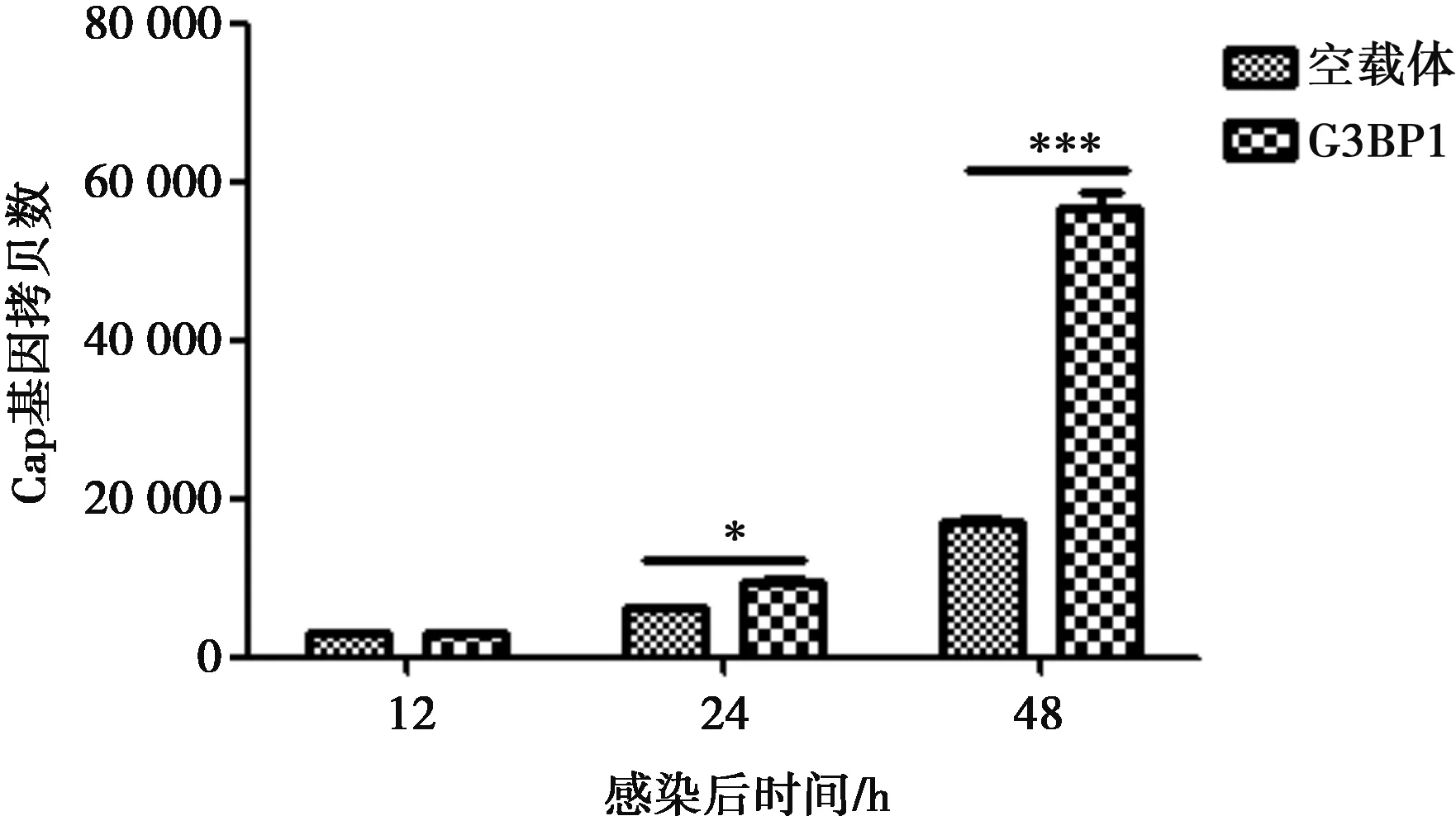
*P<0.05,***P<0.001。下同图3 PCV2感染过表达G3BP1的PK15细胞Cap拷贝数(MOI=0.1)
2.4 siRNA的筛选和下调G3BPI表达对PCV2复制的影响
为研究敲低G3BP1对PCV2复制的影响,本研究设计了3条siRNA,分别作用于G3BP1 mRNA的不同靶点。PK15细胞转染siRNA 24 h后,提取细胞RNA进行RT-PCR检测,结果见图5。检测发现3条siRNA均能降低G3BP1 mRNA的表达,其中siRNA-187干扰效果最显著。
当PK15细胞转染对照siRNA和G3BP1-siRNA 24 h后,用PCV2 MOI=0.1和MOI=1分别感染细胞。敲低G3BP1试验组与对照组相比,PCV2感染24 h 后病毒复制显著减弱(P<0.05),感染48 h后比感染24 h后病毒复制的基因拷贝数降低,差异极显著(P<0.001)。用MOI=0.1和MOI=1可观察到一致的结果,见图6、图7。

与NC-siRNA组比较,**P<0.01图5 荧光定量 PCR 检测siRNA 干扰G3BP1 mRNA表达水平

图6 PCV2感染G3BP1敲低的PK15细胞Cap基因拷贝数(MOI=0.1)

图7 PCV2感染G3BP1敲低的PK15细胞Cap基因拷贝数(MOI=1)
2.5 过表达G3BP1促进ISD诱导和PCV2感染中IFN-β的表达
细胞过表达G3BP1 24 h后,转染2 μg/mL ISD刺激12 h,荧光定量PCR检测IFN转录水平见图8,可观察到过表达G3BP1促进ISD诱导IFN-β的表达。用PCV2 MOI=1感染细胞,12 h可观察到IFN-β转录水平增加,PCV2感染12 h,病毒复制没有显著差异,所以,选取感染12 h后的细胞,检测其中的IFN-β转录水平。结果显示,过表达G3BP1显著促进了IFN-β的表达(图9)。

图8 ISD刺激12 h后的IFN-β mRNA的表达

图9 PCV2感染12 h后的IFN-β的表达
2.6 G3BPI的敲低抑制ISD诱导和PCV2感染中IFN-β的表达
2 μg/μL ISD刺激敲低G3BP1后的细胞,用荧光定量PCR检测IFN转录水平。与对照组相比,敲低G3BP1,能抑制ISD诱导的IFN-β mRNA的转录(图10);用PCV2 MOI=1感染细胞,感染12 h后检测IFN-β转录水平(图11),敲低G3BP1组能抑制IFN-β mRNA的转录。

图10 ISD刺激后的IFN-β mRNA的表达

图11 PCV2感染12 h后的IFN-β mRNA的表达
3 讨论
有研究报道,G3BP1能促进环鸟苷酸-胺苷酸合酶(cGAS)识别DNA及催化环二核苷酸(cGAMP)的产生,进而介导IFN-β的表达,U937细胞敲掉G3BP1后,用ISD和HT-DNA刺激,缺失G3BP1的细胞IFN-β水平降低,感染人疱疹病毒1型(HSV-1)24 h后,缺失组IFN-β的表达明显降低,进而病毒的复制与正常细胞组相比明显提高[18]。最近也有研究表明,G3BP1能结合病毒的双链RNA和RIG-I促进IFN-β的表达,进而调控抗病毒免疫来抑制RNA病毒的复制,用Poly I:C处理,或用仙台病毒(SeV)感染G3BP1敲低(或敲除)的HEK293T细胞,都能抑制IFN-β的产生,用SeV和水疱型口炎病毒(VSV)感染敲除G3BP1的HEK293T细胞,与正常细胞组相比病毒复制显著增强[10,16]。虽然应激颗粒主要是调控RNA病毒,但也有报道DNA病毒例如人乳头瘤病毒(HSV)能影响应激颗粒SG[19]。过去的研究表明,PCV2可以激活 cGAS/STING、RIG-I/MDA5与NF-κB信号通路,上调IFN-β的表达,IFN-β进而能促进PCV2的复制[4-5,20],但是IFN-β促进PCV2的复制机制尚未研究清楚。
本研究发现,G3BP1能正调控PCV2的复制,G3BP1能促进ISD刺激IFN-β的表达,也能促进PCV2感染初期的IFN-β 产生,所以G3BP1很可能是通过上调IFN-β,从而促进PCV2的复制。然而G3BP1是否调控RIG-I/MDA5通路,或者通过调控cGAS/STING通路增强宿主天然免疫,促进IFN-β的上调,进而增强PCV2的复制,这一问题有待探究,此外,PCV2感染是否能影响应激颗粒SG的形成,进而调控病毒的复制,这一问题也有待研究。本文章的局限是未清晰的解释G3BP1是否通过促进IFN-β 的表达促进PCV2的复制,需要进一步研究IFN-β 促进PCV2复制的机制。
综上所述,在PK15细胞上,宿主蛋白G3BP1显著促进PCV2的复制,很可能是通过上调IFN-β表达引起的。
