饲粮中添加胍基乙酸对羔羊生长性能、屠宰性能和肉品质的影响
2021-04-13刘笑梅郝小燕张宏祥杨立彬项斌伟张文佳张春香张建新
刘笑梅 郝小燕 张宏祥 杨立彬 项斌伟 张文佳 张春香 张建新*
(1.山西农业大学动物科学学院,太谷030801;2.山西祥和岭上农牧开发有限公司,右玉037200;3.北京君德同创生物技术股份有限公司,北京100085;4.山西省右玉县畜牧兽医中心,右玉037200)
当今的养殖者追求健康、高效养殖,开发高效、绿色饲料添加剂成为近些年研究的热点,目前,胍基乙酸(guanidineacetic acid,GAA)作为一种新型的添加剂,受到动物营养学家们的广泛关注。GAA又名胍乙酸,通常呈白色粉末或片状晶体,是合成肌酸的唯一前体物[1]。动物体内GAA由L-精氨酸和甘氨酸合成,随后经血液循环到达肝脏,在S-腺苷蛋氨酸-胍基乙酸-N-甲基转移酶(GAMT)的催化作用下与腺苷蛋氨酸(SAM)形成肌酸。肌酸可在肌酸激酶的作用下合成磷酸化肌酸,参与三磷酸腺苷循环,对动物的能量代谢和生长发育起着非常重要的作用[2]。此外,肌酸也是动物体内的一种半必需氨基酸,既能通过动物自身合成,也可外源补充。但是动物自身合成肌酸仅占机体所需肌酸的66%~75%,无法满足需求[3],且肌酸自身的不稳定性导致其无法直接添加于饲粮中,而GAA具有稳定性、价格适宜的特点,可以作为饲料添加剂应用于动物生产中。
目前研究证实,GAA比肌酸更能有效提高肌细胞肌酸的含量[4]。GAA在单胃动物上的研究表明,饲粮中添加GAA可以合成大量肌酸,提高猪和肉鸡的饲料转化效率,提高生长性能[5-6],提高机体抗氧化能力[7];GAA可降低建鲤肌肉能量代谢关键酶活性,进而改善其能量代谢,提高饲料转化率[8];近几年,也有少数关于GAA在反刍动物上的研究,晁雅琳等[9]研究表明,饲粮中添加GAA可以改善舍饲滩羊生长性能、屠宰性能以及脂肪沉积,提高肌内脂肪含量和大理石花纹。GAA作为合成肌酸的唯一前体物,其生物学功能受到广泛关注。目前,有关GAA作为营养性饲料添加剂对反刍动物生长性能、屠宰性能和肉品质方面的影响鲜有报道。因此,本试验在已有的研究基础上,深入研究了GAA对羔羊生长性能、屠宰性能和肉品质的影响,为GAA在反刍动物生产中的应用提供理论基础。
1 材料与方法
1.1 试验动物与试验设计
本试验于2019年在山西祥和岭上农牧开发有限公司完成。试验选取48只4月龄、体重[(24.8±1.3) kg]相近的杜泊×小尾寒羊杂交一代公羔,采用完全随机分组试验设计分为4组,每组12只羊。各组分别在基础饲粮中添加0(对照组,CON组)、300(300GAA组)、600(600GAA组)、900 mg/kg(900GAA组)的GAA。每只羊采取单栏饲养,预试期15 d,正试期70 d。
试验所用饲粮参考NRC(2007)营养需要量进行配制,基础饲粮组成及营养水平见表1。GAA由北京某农牧科技股份有限公司提供,其有效成分含量≥95%。
1.2 饲养管理
于试验开始前1周对试验羊舍消毒,给试验羊注射羊痘、小反刍兽疫和口蹄疫疫苗。预试期对所有试验羊分组、编号、驱虫。在正试期,每天08:00和17:30各饲喂1次,自由饮水,每天饲喂量根据前1天采食情况进行调整,为了使试验羊达到增重和饱食的效果,应该保证有剩料,但剩料不能超过5%,记录每天的采食量。
1.3 测定指标与测定方法
1.3.1 饲粮常规营养成分含量的测定
饲粮干物质(DM)、粗灰分(Ash)、粗脂肪(EE)、粗蛋白质(CP)含量参照AOAC(2012)[11]方法测定,中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量参照Van Soest等[12]的方法测定,钙(Ca)含量采用原子吸收法[13]测定,磷(P)含量采用钒钼黄比色法[14]测定。

表1 基础饲粮组成及营养水平(干物质基础)
1.3.2 生长性能指标的测定
试验羊共称3次重,在正试期第1天晨饲前对所有羊空腹称重,作为初始体重,在第30天进行第2次称重,在试验结束当日晨饲前进行第3次称重。根据每只羊的采食量计算平均日采食量(ADFI),根据初始体重和结束体重计算平均日增重(ADG),最后计算料重比(F/G)。
1.3.3 屠宰性能指标的测定
正试期结束当天,各组随机选取6只健康且体重相近的试验羊进行屠宰,宰前禁食16 h,宰前2 h禁水,次日07:00屠宰,记录宰前活体重。试验羊屠宰放血,去头、蹄、内脏、剥皮,称量各器官和头、蹄的重量。将胴体进行骨肉分离,称量骨重。用电子秤称量十二指肠、空肠、回肠的净重,用皮尺测定各小肠在自然状态下的长度。屠宰性能指标计算公式如下:
胴体重(kg)=宰前活重-头、蹄、皮、
内脏(除肾脏及肾周脂)重;
屠宰率(%)=(胴体重/宰前活重)×100;
净肉重(kg)=胴体重-全骨重-肾脏重;
净肉率(%)=(净肉重/宰前活重)×100;
骨肉比(%)=(全骨重/净肉重)×100;
器官指数(g/kg)=器官重/宰前活重。
1.3.4 肉品质指标的测定
屠宰后立即取试验羊左侧背最长肌,测定pH、肉色、系水力、熟肉率、剪切力以及肌肉常规营养成分。
pH:采用TESTO-205酸碱度/温度pH测定仪测定背最长肌pH。将pH计探头插入背最长肌中段横切面,分别统计屠宰后1 h背最长肌的pH(pH1 h)和24 h(4 ℃保存)后的pH(pH24 h),各测定3次,取平均值。
肉色:用CM-5分光测色仪测定屠宰后1和24 h背最长肌的亮度(L*)、红度(a*)和黄度(b*)值,各测定3次,取平均值。
熟肉率:取3块50 g左右的背最长肌长方体状肉段,去除白肉和筋膜,称重(m1),用曲别针固定防水标签。把样品铺在干净的蒸屉上,沸水锅盖上盖子蒸30 min。待加热停止后将肉取出,冷却至室温,用吸水纸将肉样吸干,去掉曲别针和标签纸,称重(m2),计算熟肉率,公式如下:
熟肉率=(m1-m2)/m1。
剪切力:从背最长肌切取2.54 cm厚的肌肉,在177 ℃的烤箱中烘烤。当中心温度达到70 ℃后,取出样品,冷却至室温,在1 ℃下冷却24 h。使用TMS-PRO质构仪测量每块样品的6个圆柱形核心(直径=1.27 cm)的剪切力。
系水力:使用TMS-PRO质构仪进行测定,选择35 kg肉块压力试验的数据库,运行程序,设置位移零点。用分析天平称量1 g左右的肉样品(m1),放在测试平台上,在样品上方放置16层滤纸,样品下方放置18层滤纸,回程的距离设置为35 mm。测定结束后取出肉样品,称重(m2)。每个样品测定3次,公式如下:
系水力=(m1-m2)/m1。
常规营养成分:参照GB 5009.3—2016《食品安全国家标准食品中水分的测定》测定肌肉中水分含量,参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》测定肌肉中粗蛋白质含量,参照GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》测定肌肉中粗脂肪含量;参照GB 5009.4—2016《食品安全国家标准食品中灰分的测定》测定肌肉中粗灰分含量。
1.4 数据统计分析
利用Excel 2010软件初步整理数据,应用SPSS 22.0统计软件进行单因素方差分析(one-way ANOVA),差异显著时用Duncan氏法进行多重比较,并采用正交多项式进行线性和二次方效应分析。P<0.05表示差异显著,0.05≤P<0.10表示有趋势。
2 结 果
2.1 饲粮中添加GAA对羔羊生长性能的影响
由表2可知,900GAA组羔羊的末重和平均日增重显著高于对照组、300GAA组和600GAA组(P<0.05),300GAA组、600GAA组和对照组之间无显著差异(P>0.05)。各组之间羔羊的平均日采食量无显著差异(P>0.05)。900GAA组羔羊的料重比显著低于对照组、300GAA组和600GAA组(P<0.05),300GAA组、600GAA组和对照组之间无显著差异(P>0.05)。
2.2 饲粮中添加GAA对羔羊屠宰性能的影响
由表3可知,饲粮中添加GAA后胴体重线性提高(P=0.035),300GAA组、600GAA组和900GAA组的胴体重较对照组分别提高了4.30%、5.40%、13.40%,其中,900GAA组的胴体重显著高于对照组(P<0.05)。饲粮中添加GAA后屠宰率有线性升高的趋势(P=0.075),但各组之间差异不显著(P>0.05)。900GAA组的净肉重显著高于对照组(P<0.05),但与300GAA组、600GAA组无显著差异(P>0.05)。300GAA组、600GAA组和900GAA组的净肉率均显著高于对照组(P<0.05),分别提高了7.55%、7.60%和6.78%。300GAA组、600GAA组和900GAA组的眼肌面积均显著高于对照组(P<0.05),分别提高了10.26%、13.26%、14.65%。

表2 饲粮中添加GAA对羔羊生长性能的影响
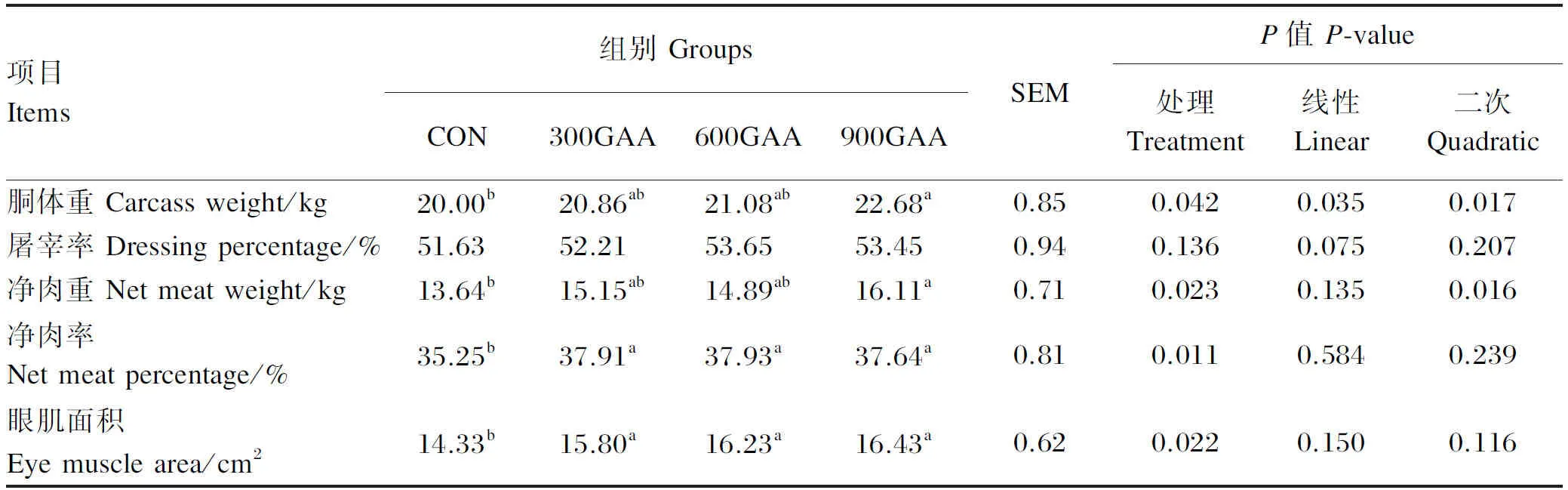
表3 饲粮中添加GAA对羔羊屠宰性能的影响
2.3 饲粮中添加GAA对羔羊器官指数的影响
由表4可知,饲粮中添加GAA对羔羊器官指数均无显著影响(P>0.05)。
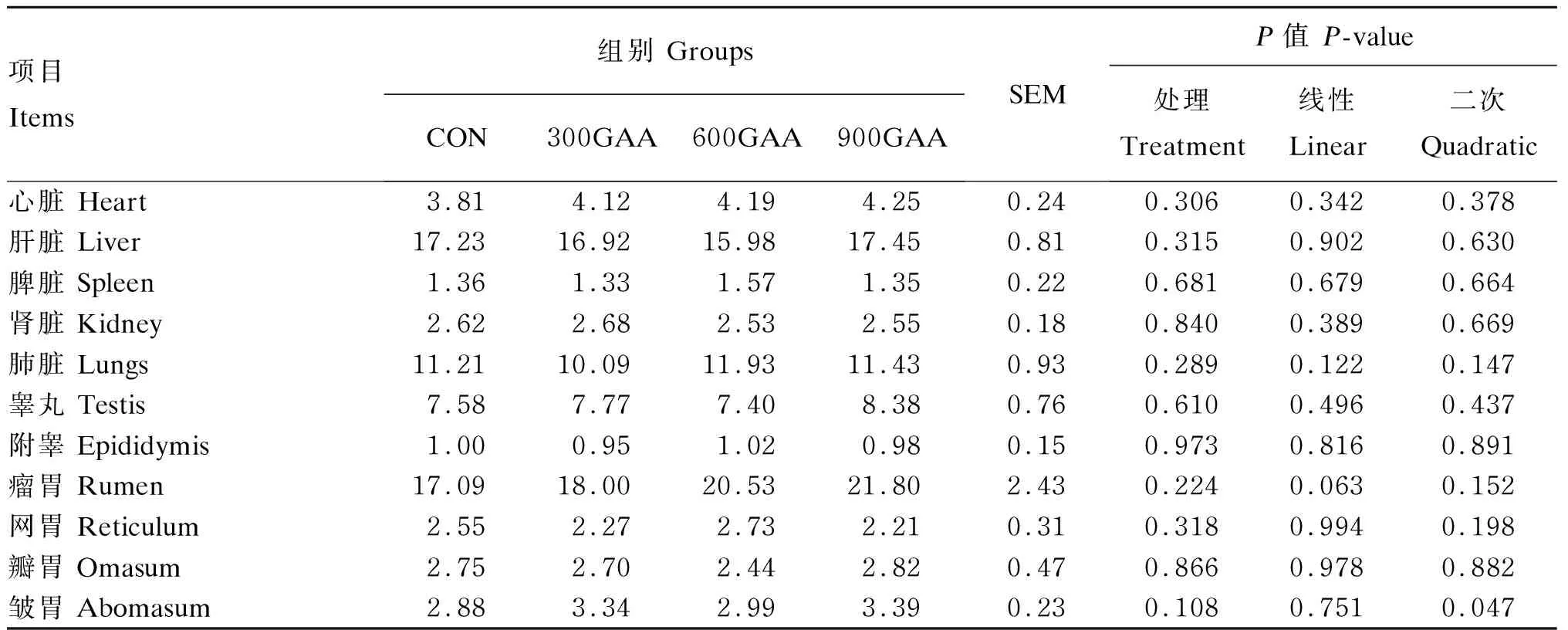
表4 饲粮中添加GAA对羔羊器官指数的影响
2.4 饲粮中添加GAA对羔羊小肠发育的影响
由表5可知,饲粮中添加GAA对羔羊十二指肠、空肠的长度、重量均没有显著影响(P>0.05)。300GAA组、600GAA组和900GAA组的回肠长度均显著高于对照组(P<0.05),分别提高了32.63%、20.13%、22.21%。饲粮中添加GAA后回肠重量线性提高(P=0.022),且900GAA组回肠重量显著高于其他各组(P<0.05)。
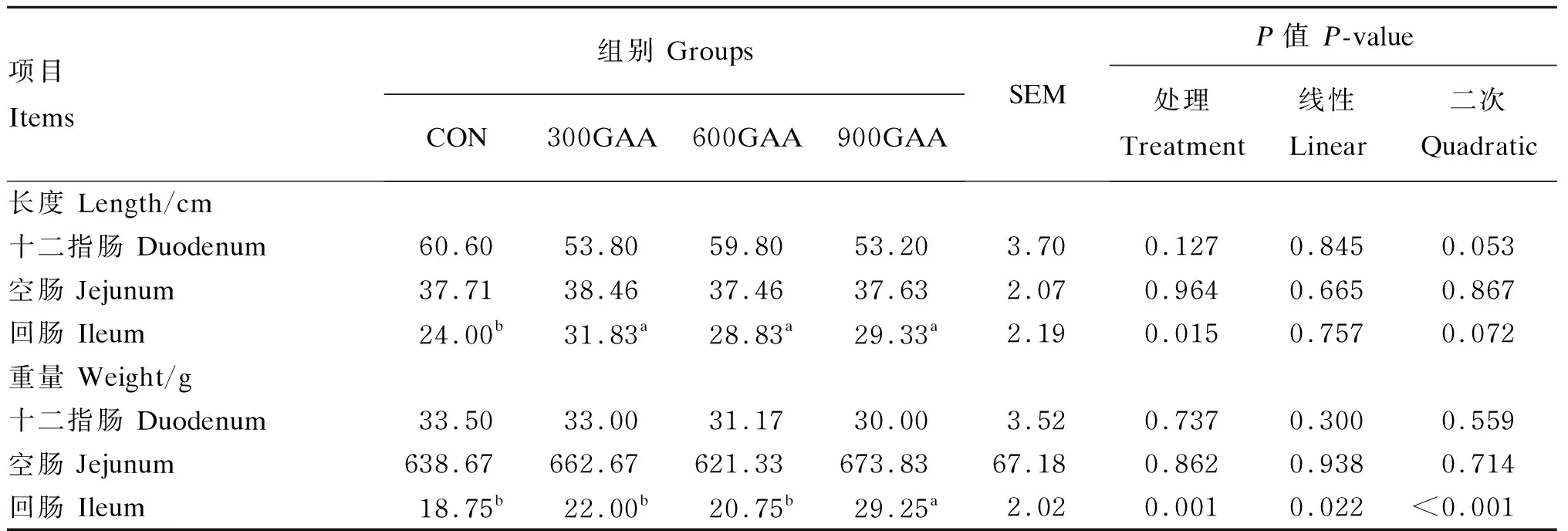
表5 饲粮中添加GAA对羔羊小肠发育的影响
2.5 饲粮中添加GAA对羔羊肉品质的影响
由表6可知,宰后1 h,各组之间背最长肌pH无显著差异(P>0.05);宰后24 h,300GAA组、600GAA组和900GAA组的背最长肌pH均显著高于对照组(P<0.05),且300GAA组、600GAA组和900GAA组之间差异不显著(P>0.05)。宰后1 h,各组之间背最长肌L*、a*、b*值无显著差异(P>0.05);宰后24 h,600GAA组的背最长肌L*值显著高于对照组和300GAA组(P<0.05),但与900GAA组无显著差异(P>0.05);各组之间背最长肌a*、b*值无显著差异(P>0.05)。300GAA组、600GAA组和900GAA组的背最长肌系水力均显著高于对照组(P<0.05),分别提高了6.43%、4.79%、6.33%。各组之间背最长肌熟肉率与剪切力均无显著差异(P>0.05)。
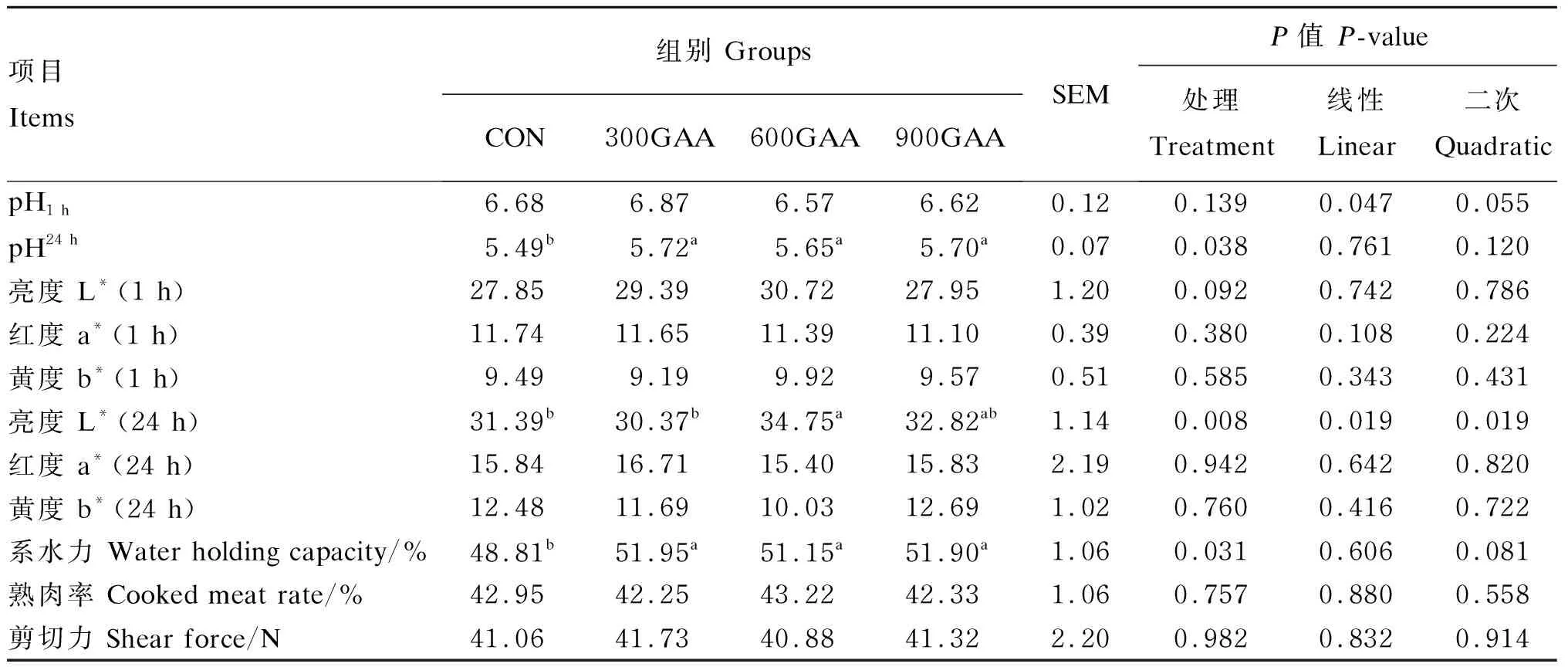
表6 饲粮中添加GAA对羔羊肉品质的影响
2.6 饲粮中添加GAA对羔羊背最长肌肌肉常规营养成分的影响
由表7可知,饲粮中添加GAA对羔羊背最长肌水分、粗脂肪和粗灰分含量没有显著影响(P>0.05)。600GAA组、900GAA组的背最长肌粗蛋白质含量显著高于对照组(P<0.05),分别提高了5.30%和3.98%,但600GAA组与900GAA组之间没有显著差异(P>0.05)。
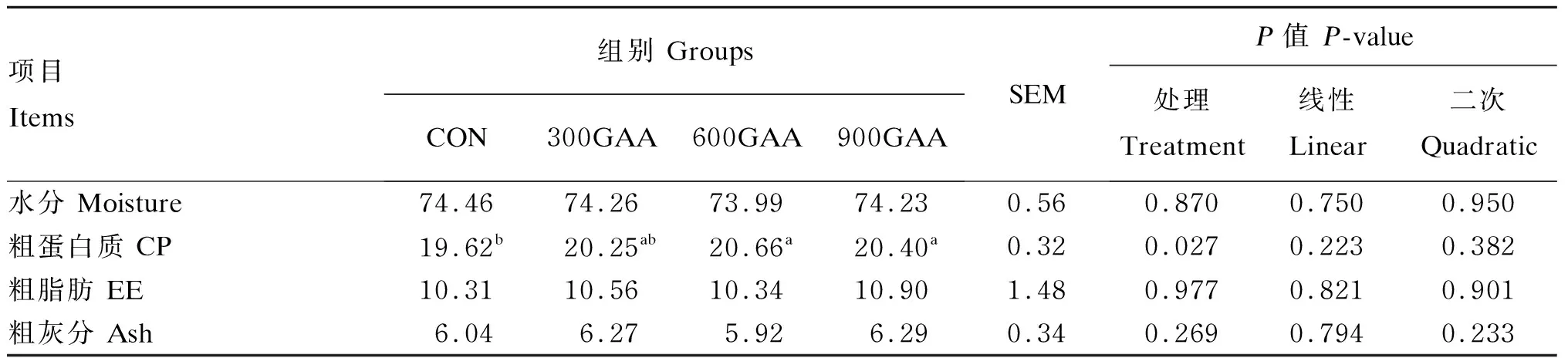
表7 饲粮中添加GAA对羔羊背最长肌常规营养成分的影响
3 讨 论
3.1 饲粮中添加GAA对羔羊生长性能的影响
GAA是机体合成肌酸的唯一前体物,饲粮中添加GAA能提高机体内肌酸的含量,从而提高了磷酸肌酸/ATP的比值,提高能量的利用率,进而促进动物生长,提高饲料利用率[3]。Michiels等[15]研究认为,饲粮中添加600 mg/kg GAA可提高罗斯肉仔鸡的平均日增重和饲料利用率。潘宝海等[16]研究表明,在育肥猪饲粮中添加300~600 mg/kg GAA可显著提高育肥猪的平均日增重和饲料转化率,但对平均日采食量无显著影响。晁雅琳等[9]研究表明,饲粮中添加800和1 200 mg/kg GAA可显著提高舍饲滩羊平均日增重和饲料转化效率,这与本试验研究结果一致。本试验结果表明,饲粮中添加900 mg/kg GAA可显著提高羔羊的平均日增重,显著降低料重比。一方面原因可能是动物机体在体内合成GAA时需要精氨酸与甘氨酸的参与,而外源添加GAA可有效减少体内精氨酸与甘氨酸的消耗量,这就为精氨酸与甘氨酸参与机体内氨基酸与蛋白质的合成提供了有利条件,从而促进动物生长[17];另一方面原因可能是饲粮中补充GAA后,促进了机体类胰岛素生长因子-Ⅰ和胰岛素的分泌,进而促进动物生长[15]。
3.2 饲粮中添加GAA对羔羊屠宰性能的影响
屠宰性能可以用于判断动物从饲粮中获取营养物质的情况,体现动物的经济价值,胴体重和屠宰率是衡量肉羊生产水平的重要依据[18]。肉羊的屠宰性能与饲养管理条件、饲粮营养水平以及品种特征相关[19]。眼肌面积大小与家畜产肉性能有强相关关系[20]。潘宝海等[16]研究发现,在育肥猪饲粮中添加500 mg/kg GAA可提高屠宰率和眼肌面积。本试验中,饲粮中添加GAA后各试验组眼肌面积均显著高于对照组,这说明饲粮添加不同水平的GAA有提高羔羊产肉性能的作用。江涛[21]研究结果也表明,饲粮中添加GAA可以显著提高育肥猪瘦肉率和屠宰率。本试验中,饲粮中添加900 mg/kg GAA显著提高了羔羊的胴体重,这与前人研究结果一致。
动物机体的机能状态在一定程度上可以通过内脏器官的重量和器官指数来说明,对于理论研究和生产实践都具有重要意义。动物内脏器官的重量受到饲粮营养水平的影响,肝脏和胃肠消化道尤为明显[22]。内脏器官对动物的生命活动有极其重要的作用,内脏器官的重量是其相应功能作用的体现,内脏器官指数反映动物的营养状况和生理功能状态,动物的内脏器官重量一般与生长发育相协调[23]。本试验结果表明,饲粮中添加GAA对各器官指数无显著影响,表明这些器官的发育与羔羊生长相协调。
3.3 饲粮中添加GAA对羔羊小肠发育的影响
小肠作为机体营养物质消化代谢的主要场所,肠道发育与畜禽的生长性能密切联系。小肠长度、重量的改变,会使小肠对营养物质的吸收改变,最终影响动物的生长性能[24]。随着饲粮纤维水平的升高,消化器官的重量和长度均会适应性增大,相应地其容积也就加大。有研究表明,随着饲粮纤维水平的升高,消化器官绝对重量差异极显著,而相对重量随着饲粮纤维水平的提高呈上升趋势[25]。本试验结果表明,饲粮中添加GAA显著影响了羔羊回肠的重量,推测饲粮中添加GAA后提高了羔羊的采食量,进而提高了饲粮中纤维含量,致使回肠重量发生变化,但是具体机制还有待进一步研究。
3.4 饲粮中添加GAA对羔羊肉品质和常规营养成分的影响
感官特征、理化特征、营养成分是肉品质评定的重要指标,在一定程度上反映肉品质[26]。肌肉pH可以反映肌肉酸度,直接反映肌肉糖酵解的情况,对肌肉系水力和嫩度有一定影响[27]。畜禽屠宰后,肌肉中的糖原会快速分解,产生乳酸,进而导致肌肉pH下降。本试验结果表明,饲粮中添加GAA显著影响了羔羊宰后24 h的背最长肌pH,这与刘洋等[28]的研究结果较一致。原因可能是饲粮中添加GAA后,羔羊肌肉中的肌酸含量增多,延缓了糖酵解的发生,减少了乳酸的积累,最终使肌肉pH提高。肌红蛋白和血红蛋白可以形成肉色,肌肉的系水力和抗氧化能力直接影响着肉色[29]。本试验结果表明,饲粮中添加GAA后对羊肉的肉色有改善作用,饲粮中添加600 mg/kg GAA可使羔羊宰后24 h的背最长肌L*值显著提高。Michiels等[15]研究也发现,饲粮中添加GAA后可以显著提高宰后鸡胸肉L*值,这可能是因为饲粮中添加GAA后,肌肉中的ATP和磷酸肌酸含量都有所增加,延缓了糖酵解的发生,从而也改善了肉色。系水力是指肌肉保持原有水分的能力,用来反映羊肉感官品质,影响着肉质的色泽、嫩度及其营养成分等。熟肉率主要是用来判断肌肉在蒸煮过程中的损失情况,熟肉率越高,羊品质越好[30]。本试验中,饲粮中添加GAA后各试验组背最长肌系水力均显著高于对照组,主要原因是肌肉的系水力直接受到pH的影响,pH可以减少肌蛋白变性,使肌原纤维蛋白质偏离其等电点,蛋白质的静电负荷增多,使蛋白质与水的相互作用增强,蛋白质与蛋白质之间的相互作用减弱,从而提高肌肉系水力。剪切力可以直接反映肉的质地,是肌肉中结缔组织含量与性质、肌原纤维蛋白化学结构状态的综合反映[31],此外,有研究表明,肌肉粗脂肪含量增加能降低肌肉剪切力[32]。本试验中,饲粮中添加GAA后各试验组背最长肌粗脂肪含量未发生显著变化,进而导致各组剪切力没有发生显著变化,这与前人研究结果有些出入,原因可能是本试验是在右玉试验基地完成,气温较低,昼夜温差较大,对试验结果产生一定影响。有研究表明,冷应激不仅影响动物机体的生物化学代谢,也影响动物脂肪沉积[33]。
水分、粗蛋白质、粗脂肪、粗灰分是评价肉质营养价值及品质的重要指标。肌肉中水分含量的多少直接影响肉的嫩度与口感。脂肪决定着肉的多汁性,肌肉中粗脂肪含量过低肉质会明显粗糙,过高又会有油腻感[34]。粗灰分可以反映肉质中矿物质和维生素的含量,肌肉中蛋白质含量是肉质营养的重要指标[25]。本试验结果表明,饲粮中添加600、900 mg/kg GAA显著提高了背最长肌粗蛋白质含量,使其营养价值提高。这些结果表明,GAA能促进机体蛋白质的合成,让机体吸收更多的营养物质在肌肉组织而非脂肪组织中[35],此外,饲粮中添加GAA可能改变了肌肉中某些氨基酸的含量,具体机制还有待研究。晁雅琳等[9]的研究结果表明,饲粮中添加GAA可以改善滩羊的脂肪沉积及提高肌内脂肪含量,与本试验结果有些出入,这可能与试验环境不同有直接关系,有待于进一步深入研究。
4 结 论
饲粮中添加适宜水平的GAA能够提高羔羊的平均日增重,降低料重比,提高羔羊胴体重、净肉率、眼肌面积和背最长肌中粗蛋白质含量,提高宰后24 h的背最长肌pH。因此,GAA作为一种新型的饲料添加剂,可以在育肥羊生产中开发利用。本试验条件下,饲粮中GAA的适宜添加水平为900 mg/kg。
