昆虫Notch信号通路研究进展
2021-04-13潘敏慧
杨 曦, 陈 鹏, 蒋 霞, 潘敏慧, 鲁 成
(西南大学, 家蚕基因组生物学国家重点实验室, 农业农村部蚕桑生物学与遗传育种重点实验室, 重庆 400715)
细胞是生命体构成的基本单位,细胞间通讯是多细胞生物的基本生命活动,调节着细胞分裂、分化、增殖和凋亡等重要的发育过程。信号通路往往作为细胞间通讯的桥梁,在单个细胞内部与相邻细胞之间,或是在细胞群、组织间传达信号,进而完成一定的生物学进程(Lajtha, 1979)。信号通路最早被称为信号转换(signal transmission)(Penn and Hagins, 1969),随后Rodbell等提出的信号转导(signal transduction)这个概念被大家熟知并广泛运用(Nielsenetal., 1980),后来也被称为信号通路(signal pathway)。当今生物学领域中被人们熟知的信号通路有Notch信号通路、mTOR信号通路、MAPK信号通路、Wnt信号通路、PI3K/AKT信号通路、JAK/STAT信号通路和Hippo信号通路等。其中Notch信号通路凭借其在生物胚胎发育及细胞生命周期中的强大作用而备受关注。
Notch信号通路最先于1917年在果蝇Drosophila中被发现。研究表明,Notch信号通路的功能非常广泛,因为它在脊椎动物和无脊椎动物体内发育的组织和器官的细胞命运决定中起着基础性的作用(Guruharshaetal., 2012)。Notch信号通路在大部分生物的形态发生过程中都会调控细胞的分化。简单地说,一个细胞可以通过Notch信号的传递影响与其直接相邻细胞的命运。随着生命科学技术的发展,Notch信号通路在现代人类肿瘤医学和分子治疗中的作用也得到深入挖掘。
从在果蝇中发现以来,基于昆虫的Notch信号通路研究一直十分活跃且收获颇丰。除了普遍使用的黑腹果蝇Drosophilamelanogaster外,在小红蛱蝶Vanessacardui、赤拟谷盗Triboliumcastaneum、德国小蠊Blattellagermanica、家蚕Bombyxmori和西方蜜蜂Apismellifera等昆虫中都进行过Notch信号通路研究。研究表明,Notch信号通路在各物种间是相对保守的(Bray, 2016),而正是由于这种高度保守性,昆虫Notch信号通路的研究结果不仅利于昆虫学领域的发展,还可以为其他动物发育机制的解析带来新的方法和思路。本文将对昆虫Notch信号通路的研究进展进行详细的阐述。
1 Notch信号通路
Notch基因的第一个突变体是在1914年由Dexter在果蝇中分离出来的,Dexter描述了该基因的致命性和单倍体不足而造成的翅缺刻(notch),从而将该基因命名为Notch(Fiuza and Arias, 2007)。直至1983年,果蝇的Notch基因才被成功克隆出来。而在人类发育和疾病中的相关研究是在1991年随着Notch1被发现与T细胞敏感性淋巴细胞白血病相关才开始的(Schroeteretal., 1998)。人们在后续研究中认识到Notch信号可以被数百个基因影响,这表明该通路的调控是一个异常复杂的网络(Kankeletal., 2007)。这个高度互联的网络与我们传统意义上认为Notch通路是简单的线性通路的观点形成了鲜明对比,它的作用与其他保守的信号通路高度相关。
1.1 组成
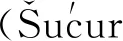

图1 Notch信号通路模式图
1.2 特征
Notch蛋白可以同时作为跨膜受体和转录因子发挥作用,这是它最重要的特征。Notch与其配体的相互作用会导致细胞内区域作为转录因子被激活。然而该通路的配体和受体之间存在顺式和反式相互作用的区别。顺式相互作用是在同一细胞膜上的配体和受体之间的作用,而反式相互作用发生在一个细胞上表达的配体和邻近细胞上的受体之间,导致受体活化。这种顺反作用的机制仍有待阐明。其实同一研究对象的所有细胞最初都同时表达受体和配体,内部细胞存在的顺式-反式相互作用的比例是一个重要的调控机制(Kovall and Blacklow, 2010)。在果蝇和线虫中的研究表明,顺式、反式互作反馈机制可以放大Notch和DSL(Delta, Serrate, Lag2)配体表达的微小差异,导致不同细胞中配体或受体的表达发生定向变化。因此,两个相邻的细胞中哪一个成为信号发送细胞,哪一个作为信号接收细胞,可能取决于顺式和反式相互作用之间的动态竞争(Fiuza and Arias, 2007)。
Notch蛋白对通路基因有剂量敏感性,这与信号的强度有关,因此信号过多或过少都会导致基因功能的改变。Notch信号通路不使用第二信使,其信号活性水平完全依赖于NICD的核内浓度。使Notch具有靶基因表达特异性的是CSL转录因子。与其他的信号通路依赖于酶促级联放大信号的特性不同,Notch信号通路缺少这一种特征,而是依赖于该通路各因子特别是受体与配体之间的化学剂量相互作用(Guruharshaetal., 2012),这一点与1.1节中提到的内容相符合。
2 昆虫Notch信号通路的作用机制
在果蝇的Notch信号通路中,受体-配体相互作用是由Notch受体的特定EGF重复序列和配体保守的细胞外区域介导的。配体的细胞外DSL结构域在一个细胞的表面表达,总是与另一个邻近细胞上的Notch胞外结构域(extracellular domain of Norch, NECD)相互作用。Delta是一种跨膜配体,它的作用具有非自主性和短距离性,只影响表达受体相邻细胞的活性(Jiaetal., 2015)。
受体-配体的结合能够引起Notch蛋白发生两次连续的蛋白剪切,分别由γ-分泌酶复合物和Kuzbanian (Kuz)/ADAM10完成。Kuz介导的剪切(S2 cleavage)发生在细胞外的近膜区域,并去除NECD。NECD的脱落通过γ-分泌酶触发跨膜区域内的第2次剪切(S3 cleavage),使NICD得以释放。NICD进入细胞核,与CSL转录抑制因子及辅因子共同激活下游靶基因的转录(Louvi and Artavanis-Tsakonas, 2012)。
CSL包含3个明显的结构域,N端结构域(N-terminal domain, NTD)、β-折叠结构域(β-trefoil domain, BTD)和C端结构域(C-terminal domain, CTD)。NTD与BTD构成序列特异性的DNA结合位点RAM。NICD均通过RAM结构域和ANK重复序列与BTD和CTD结合(Maier, 2019)。CSL之一的Su(H)单独存在时是一种转录抑制因子,NICD与之结合使其转变为转录激活因子,激活Notch诱导基因(Notch-inducible genes)的转录。NICD-Su(H)复合物直接诱导转录的靶基因是E(spl)(Enhancerofsplit),E(spl)是碱性螺旋-环-螺旋(basic helix-loop-helix, bHIH)类转录因子,它又调节其他与细胞分化直接相关基因的转录(鲁茁壮等, 2004)。
Notch介导的细胞间信号传递的强弱本质取决于附着在细胞中的配体和受体的表达差异。在同时表达Delta和Notch的细胞中,一个细胞中的配体数量相对于另一个细胞有少量增加,就可能有利于其发挥更强的信号作用。在果蝇中的实验表明,Notch信号存在一种反馈调节机制,Delta的功能缺失会下调Notch的表达,而表达Notch的激活蛋白又会抑制Delta的表达。这种现象可能是由Su(H)介导的E(spl)基因上调造成的(Artavanis-Tsakonasetal., 1999)。
任何影响Notch通路组分数量和活性的机制都可能调节其信号,这暗示着该信号通路可能存在一个复杂的调控网络。其实影响生物合成、运输、降解和许多其他分子功能的基因已被确定为通路的调节因子。特别是受体或配体的翻译后修饰,如磷酸化、糖基化和泛素化,这些都是调控Notch信号的关键步骤(Stanley and Okajima, 2010)。例如蛋白质降解就是一种非常有效的信号调节方法,它被用来保持NICD水平略高于功能阈值。其中一个解释是,对于连续信号,需要连续的增量输入。然而,还有其他方法来调控NICD的量,例如内吞作用的“吞入流量”也是调控Notch水平和活性的一个关键因素(Andersenetal., 2012)。
3 Notch信号通路重要分子在昆虫中的功能
Notch信号通路调控着一系列对生命至关重要的发育过程,如胚胎发育及器官形成中的细胞分化、增殖和凋亡(Hunteretal., 2016)。在早期Notch信号通路研究中,人们发现Notch基因位点突变的杂合体或纯合体果蝇在胚胎期死亡,在死亡的胚胎中,神经组织取代了上皮组织从而使神经组织异常丰富,雌性的杂合体果蝇翅发生各式各样的缺失,次刚毛(minor bristle)发育异常(Allmanetal., 2002)。Notch通路直接参与果蝇背部翅原基边界的形成以及翅细胞的增殖分化(Baonza and Garcia-Bellido, 2000)。随后在哺乳动物中的实验表明,Notch信号通路对哺乳动物的神经系统、生殖系统等发育有重要作用(Jingetal., 2017)。于是更多的实验结果揭示出Notch信号通路在昆虫当中的功能多样性。以下将从Notch, Delta, Fringe和Su(H)等不同的Notch信号通路组成分子出发,分别阐述它们在昆虫中行使的功能。
3.1 Notch
Notch基因在哺乳动物中有多种同源体,且各物种间相对保守。Notch蛋白由胞外域可变数量的EGFR(epidermal growth factor receptor)串联序列与物种特异LNR(Lin-12/Notch repeat)序列以及胞内多种结构域组成,是个接近300 kD的跨膜蛋白。由于分子量大,全长克隆难度高,人们对Notch基因的研究往往采取重要结构域敲除、RNA干扰、通路抑制剂处理等方法。主要研究重点聚焦在NICD上。
Notch信号通路抑制剂DAPT是通过抑制γ-分泌酶,使Notch蛋白的核内区域不能正常剪切,失去与下游靶基因的结合,从而抑制通路作用的(Fengetal., 2019)。研究发现Notch信号通常维持蜜蜂处于一个不活跃的繁殖状态中。蜂王上颚腺信息素(queen mandibular gland pheromone, QMP)通过刺激Notch信号通路作用于卵巢中的生殖细胞而使工蜂处于不育状态。使用Notch信号的化学抑制剂DAPT,抑制Notch信号可以消除蜂后QMP对工蜂卵巢活动的抑制作用。后续研究则证明在没有蜂后的情况下,工蜂卵巢中储存生殖干细胞和早期卵母细胞区域的Notch受体会退化(Duncanetal., 2016)。同样地,在果蝇雄性精囊中的生殖干细胞也受到Notch信号通路的影响,在将配体基因Delta干扰后或者敲除Notch会直接导致生殖干细胞的死亡(Ngetal., 2019)。而在埃及伊蚊Aedesaegypti雌性个体中,沉默其Notch基因会导致卵子核孔减少、抑制受精作用,从而直接影响个体繁殖,并且还会使埃及伊蚊卵子黑化,但黑化机制有待研究(Changetal., 2018)。
在对德国小蠊的研究中,研究者发现NICD的表达在卵泡细胞离开生殖细胞时会消失,直到成熟卵细胞中才会再次出现(Irlesetal., 2016)。这与果蝇中Notch信号一直伴随卵子发生过程是不一样的。在德国小蠊的卵巢中,Notch信号对于卵泡细胞维持有丝分裂活性与保持未成熟状态是必需的。当Notch信号耗竭时,会引起卵泡细胞有丝分裂停止,组织进入核内周期,细胞与细胞核都变小。卵泡细胞核内周期的进入需要Notch信号的减弱,但它在维持细胞的存活是很重要的,因为它有一定抑制凋亡的作用(Irlesetal., 2016)。而Irles的另外一个研究揭示了在昆虫卵子发生过程中,卵泡上皮细胞同时经历细胞增殖和凋亡,从而调节卵泡的生长(Irles and Piulachs, 2014)。Hippo通路是这些过程中发挥作用的关键,并且已经在果蝇的卵巢中进行了深入的研究(Chenetal., 2011)。但是与黑腹果蝇的分生型卵巢不同的是,在德国小蠊泛型卵巢中,Hippo途径似乎通过作为Notch抑制剂来调节卵泡细胞的增殖,从而触发卵泡细胞中有丝分裂向核内周期的转变(Irles and Piulachs, 2014)。其实在果蝇或德国小蠊卵巢中,生殖干细胞的生长同时受到Hippo信号通路、EGFR信号通路和Notch信号通路的共同调控,3条通路相互平衡与制约保证了细胞数量处于正常值(Elshaer and Piulachs, 2015)。Notch特别是NICD对于组织发育、细胞周期调控都具有重要作用。因为Notch信号通路发挥作用总是从NICD的产生开始的,所以相关研究围绕于此展开,也是这样才得以成功发明信号通路抑制剂DAPT,给许多Notch信号通路下游基因的研究打下了基础。
3.2 Delta
Delta(Dl)是Notch信号通路DSL配体中的一员,其具有MNNL配体保守结构域、不定数的EGFR重复序列以及受体-配体结合区域DSL结构域,其中DSL结构域各物种间高度保守。Notch信号通路的起始总是从一个细胞上的Delta结合上另一个细胞上的Notch开始的,所以将其称为该通路的“最上游”也是合理的。Delta要做到通过与细胞外受体结合来激活Notch通路这一点,首先需要自己被激活(Le Borgneetal., 2005)。通常Delta需要泛素化来激活它的全部功能。然而在没有泛素的情况下,Delta仍然可以发挥它的部分作用。Neur和Delta可以不依赖泛素而共同发送一些信号,Delta甚至可以自己发送信号。但如果没有泛素,Serrate就不能工作。所以Neur被证明能够以一种与泛素无关的方式激活Delta(Berndtetal., 2017)。作为Notch通路中被研究的最多且最深的几个信号通路组成分子之一,Delta被研究者挖掘出了不少重要功能,内容涉及多项生命进程,下面举例说明。
在昆虫中,Delta的功能大体可以总结为两种。其第1种功能是介导体节的形成与发育。Notch通路在家蚕、蟑螂等昆虫中介导分节发育,就像脊椎动物中的体细胞发生一样,它是分子震荡的核心,类似一种前进波,推动着细胞分化及发生(Chipman and Akam, 2008)。在无脊椎动物中Notch通路在中胚层或内胚层诱导和成型中起中心作用,当该通路被阻断时,整个胚层几乎缺失。而在两侧对称动物中,Notch信号帮助建立和细化中胚层细胞的组织分化边界(Appeletal., 2003)。家蚕的体节形成研究发现,BmdeltaRNAi后胚胎会产生两种缺陷型:Ⅰ型的腹部中间对称足融合,头部神经外露,脑发育紊乱。Ⅱ型胚胎节数被截短,A4后端完全消失,附足融合,阶段边界无法分清。类似现象也发生在蟑螂中(Pueyoetal., 2008)。Notch信号在果蝇腿关节形成和腿部正常发育中是必要的,这由配体Delta和Serrate在腿关节处的精确空间定位决定,并且这一过程还是与Hippo信号通路协同作用的(Córdoba and Estella, 2020)。
Delta的第2种功能是影响昆虫体细胞的细胞周期进程。核内有丝分裂是多个物种中存在的一种细胞周期变体。进行这种周期形式的细胞会部分或完全跳过M期,从而产生细胞染色质倍性升高,细胞体积变大,胞质分裂异常等现象(Edgaretal., 2014)。大量研究证据表明Notch信号通路在有丝分裂与核内有丝分裂的转换中起重要作用。Notch信号控制着上皮细胞在果蝇背部的细胞周期进程模式,细胞分裂的延迟导致了不同细胞命运的产生(Cohenetal., 2010)。Notch信号通过控制G2期的进入与否完成了这个过程。大量相关的实验在果蝇卵巢中进行,DeltaRNAi后,卵泡细胞会提前进入核内周期,影响卵腔的发育和模式形成。并且卵泡细胞的终期细胞及分裂茎部细胞消失了,这说明Notch信号通路对于卵泡细胞群的形成也是至关重要的(Assa-Kuniketal., 2007)。在赤拟谷盗中有相反的作用,Delta基因是保持卵泡在未成熟状态下处于休眠期所必需的。而在大多数情况下,Notch信号维持未分化或防止特化的细胞命运。因此,Notch在赤拟谷盗中的作用可能反映了Notch信号在昆虫卵子发生中的祖先功能(Bäumeretal., 2012)。
除此之外,Delta还有一些其他功能,比如在果蝇中肠干细胞中调节Delta表达水平,可以进一步控制Notch转录调控的激活,从而可能促进干细胞终末分化选择(Perdigotoetal., 2011)。后有证据证明由Delta激活的Notch通路与EGFR信号通路协同控制果蝇中肠干细胞的增殖、凋亡或死亡等生理过程(Reiffetal., 2019)。在果蝇眼盘中Delta与转录因子Dorsocross互作,导致细胞死亡、锥体细胞产生缺陷和眼睛变小(Pauletal., 2018)。而过表达Delta可以挽救盐诱导蛋白激酶Sik2缺失造成的眼睛发育异常缺陷(ahinetal., 2020)。在果蝇神经系统发育中Delta也充当着重要的角色。在幼龄果蝇体内敲除Delta会使腹部神经干细胞终止凋亡,从而影响神经系统的正常发育(Desplanetal., 2020)。在果蝇的肌肉由祖细胞(FCs)和具有融合能力的成肌细胞(FCMs)组成。通过Notch通路中的Delta与Ras通路中的Argos不同表达,会诱导等效肌细胞簇中的细胞发育成为祖细胞或成肌细胞(Artero, 2003)。
3.3 Su(H)
Su(H)是CSL转录因子的一员,全名是Suppressor of hairless。和Notch位点一样,Hairless(H)位点在1923年被Bridges和Morgan发现,是果蝇的单倍体不足突变形成的(Borggrefe and Oswald, 2016)。基因相互作用表明,H以剂量依赖的方式拮抗Notch信号。对比所有已知的CSL相互作用因子,H与Su(H)的结合亲和力最高(Kovall and Hendrickson, 2004)。哺乳动物中没有直接的Hairless同源体,但有研究提出功能性同源物SHARP,可直接与CSL结合并与其上的CTD相互作用,类似于Hairless。Su(H)通过与抑制因子Hairless(H)形成复合物来抑制转录。此复合物不仅与NICD竞争,还会参与组装局部染色质结构(Yuanetal., 2016)。
从功能上来看,Su(H)基因参与的生命进程也不少,且大多与Delta相关或相近。推测这是由于Delta与Notch结合后释放的NICD首先就是与Su(H)结合发挥作用的原因。将Su(H)与NICD的结合位点突变后,果蝇出现了翅原基变小,成虫翼叶缺失,以及Wingless(Wg)蛋白不表达等生理缺陷(Praxenthaleretal., 2017)。这反映了Su(H)与NICD的结合在某些器官发育中的重要作用。比如果蝇心脏细胞的分化和发育过程受到Wnt信号通路、EGFR信号通路、Notch信号通路等通路的共同调控。其中Notch通路中的Su(H)分别在与NICD结合的激活状态和与抑制因子结合的抑制状态下会造成心肌细胞不对称分裂,而产生子代分别成为心肌细胞和围心细胞(Ahmad, 2017)。
另外,在细胞调控周期方面,Su(H)也充当着不可或缺的角色。Notch基因的缺失,或它的下游转录因子基因Su(H),以及它的配体基因Delta的缺失,都会干扰从有丝分裂到核内周期的正常转变,会造成细胞的过度增殖。在果蝇脑亚神经胶质(subperineurial glia, SPG)细胞中,对Su(H)进行干扰会使细胞发生缺陷,血脑屏障破裂。对Su(H),Delta和Notch进行干扰均能使SPG细胞核数增加,倍性减少,细胞从核内周期转换为核内有丝分裂(Von Stetinaetal., 2018)。作为转录因子,Su(H)的作用一定远不止这些,利用转录因子研究方法,寻找它调控的靶基因,会是进一步研究该基因的重要思路。
3.4 Fringe
Fringe(Fng)是一种糖基转移酶,它会对NECD的EGF-R进行糖基化(Kojika and Griffin, 2001),在Notch信号通路中属于“修饰分子”。Fringe对Notch的糖基化修饰能改变Notch受体对不同配体的敏感性,例如:果蝇中Fng使神经胶质上的Notch对神经索上Delta的敏感性大于对Serrate的,这将会诱导转录因子Pros特异高表达。这种通过配体受体结合增强神经胶质内细胞间的通讯,是神经系统发育中亚型胶质细胞的分子多样性所必需的(Thomas and van Meyel, 2007)。
Fng的功能与发育相关,但在昆虫细胞、胚胎和器官发育中的作用不尽相同。在家蚕中,fl突变体由于缺失Fng基因而出现成虫期翅无法正常发育的情况,表明Fng在家蚕翅的形成过程中起着至关重要的作用(Satoetal., 2008);miRNA-2在家蚕中通过维持Bmawd和Bmfng的表达水平来保证翅的正常发育,而敲除Bmfng后,Notch信号通路的激活被抑制,翅不能正常发育(Lingetal., 2015)。在果蝇中,Fng参与翅原基在背部/腹部边界的形成(Wu and Rao, 1999),且Fng缺失突变导致胚胎后期死亡(Correiaetal., 2003)。此外,Fng还同时影响着果蝇的眼睛、附肢发育等,但家蚕Fng功能缺失只影响翅形态发生,表明Fng在不同昆虫组织分化中的作用存在差异(Satoetal., 2008)。
另外,Fng在卵子发生早期的Notch激活中起着关键作用,并为极性细胞在生殖细胞分裂成单个卵泡细胞的功能方面奠定了基础(Grammont and Irvine, 2001)。Fng的异常表达或Notch的异常激活会产生一个额外的极性细胞。另外,缺乏Fng会破坏Notch蛋白在果蝇眼球赤道系统的表达,导致眼睛的发育失常。Fng的特异高表达以及随后在赤道系统上的Notch信号对于果蝇组织镜像对称性和眼睛形态的形成至关重要(Cho and Choi, 1998)。Fng也能影响沙漠蝗Schistocercagregaria的胚胎节段形态形成(Deardenetal., 2000)。
3.5 其他分子及功能
除了以上昆虫Notch信号通路几个关键基因之外,还有很多相关研究中涉及到该通路的其他分子。例如,Groucho (gro)作为辅抑制因子与Smart和Hairless等共同抑制CSL活性,从而参与Notch信号通路,并通过与其他配对蛋白的相互作用在发育过程中发挥重要作用,包括胚胎分节、神经发生和性别决定(Liu, 2012)。在家蚕胚胎中,通过RNAi使gro表达量下调导致蚕体出现典型的对称表型,其奇数段完全缺失,表明Bmgro在家蚕的体节形成过程中起着直接的作用。然而,对Bmnotch的RNAi产生了腹中线对称融合的缺陷型,这说明gro行使的功能不是由Notch信号直接介导的。
另外,Notch信号通路在细胞周期调控方面,与上述的Notch,Delta和Su(H)的作用都有关,而Fringe对于Notch联合周期转换调控不是必要的(Dengetal., 2001)。在Notch,Delta和Su(H) 3种基因缺失突变体果蝇中,都观察到Cut表达量的上调以及周期转换异常的现象;为了诱导有丝分裂至核内周期的转换,Notch信号不仅通过上调Fzr促进M期退出,还抑制了G2/M进展所需的Cdc25同源基因String和G1期Dacapo的下调,保证了S期的进入(Sun and Deng, 2005)。Notch信号通路的功能远不止我们所了解的这些,相信在后续的相关研究中,能够继续探索扩大Notch信号通路调控网络,寻找到更多的相关基因以及其他的生物学功能。
4 小结与展望
昆虫Notch信号通路的研究取得了不少成果,鉴于Notch信号通路在昆虫的发育和调节中的重要作用,了解其功能以及它如何与细胞和生命过程相联系具有相当大的价值。Notch信号通路在昆虫中已报道的功能给予我们如下启发:在细胞分化及去分化,在组织重塑、昆虫变态发育过程中,Notch通路的各种组分是如何分别行使调控作用的?参考其对果蝇唾液腺细胞周期的调控作用,推测Notch信号通路对于泌丝经济昆虫家蚕的重要器官——丝腺的细胞周期,是否也有类似的功能?Notch信号通路的功能探究还不止于此,研究前景还很深远。
Notch信号通路在正常发育的细胞中具有广泛的作用,所以它的研究对象也从昆虫扩展到了更多物种。近年来在哺乳动物的研究中表明,Notch信号通路不仅与神经病理性疼痛相关,还与阿兹海默症等神经退行性疾病、脑损伤有关。Notch受体与配体的异常表达往往会直接影响肿瘤细胞的发生,与其他通路的基因互作使Notch通路在不同情况下行使促癌或抑癌作用(Qinetal., 2019)。这些功能与Notch信号通路参与细胞、组织的发育和分化有关,基于该通路的干细胞、T细胞与疾病研究也成为目前医学界的研究热点。
本文从Notch信号通路的构成、特征、作用机制,以及几个关键通路组成分子在昆虫中的生物学功能等方面介绍了昆虫Notch信号通路研究进展。对Notch信号通路的更深一步研究,有利于我们加强对昆虫胚胎发育、器官发育的了解,帮助寻找靶基因从而提升经济产能,协助经济昆虫产业上的病害防治等。所以昆虫Notch信号通路的研究,不仅有益于昆虫学研究及经济昆虫产业应用,并且还能给予人类Notch信号通路研究提供新的思路和参考。随着研究的深入,复杂而精密的Notch信号通路一些待解决的问题也显现出来,例如: Notch受体在完整的状态下以及被剪切后是以何种方式传递信号的?完整的Notch是怎样通过不依赖CSL的信号途径来发挥作用的?在意识到Notch信号通路不是一个简单的线性通路后,它与其他信号通路互作的分子机制也将成为今后研究人员攻关的方向。
