一碳代谢与肿瘤治疗的研究进展
2021-04-12柴东奇王卫星
柴东奇,王卫星
0 引言
20世纪20年代,Otto Warburg发现肿瘤细胞即使在有氧情况下依然倾向于利用糖酵解而不是线粒体氧化磷酸化产生能量,这种现象被称为“Warburg效应”[1]。它表明肿瘤细胞为了适应其增殖能力的变化会调整自身的新陈代谢。尽管如此,在当时肿瘤细胞代谢的改变并未受到关注,直到最近十几年,人们才逐渐开始对肿瘤代谢重编程产生重视[2]。一碳单位是指含有一个碳原子的有机基团,包括甲基、甲烯基、甲炔基、甲酰基等,一碳代谢就是一碳单位在生物体内生成与转移利用的过程。肿瘤细胞需要大量的一碳单位用于核苷酸的合成、DNA的甲基化、NAD(P)H、ATP和一些代谢中间产物的产生以维持肿瘤的快速增殖。本文将从肿瘤中一碳单位的产生与利用两个方面的改变入手,探讨营养素治疗以及靶向相关酶在抗肿瘤中的应用。
1 一碳单位的产生
一碳单位来源于氨基酸的分解代谢,包括丝氨酸、甘氨酸等以及胆碱。肿瘤中的一碳单位主要来自丝氨酸,肿瘤细胞通过快速摄取外源性丝氨酸来增加一碳单位的供应,而当外源性丝氨酸缺乏时,肿瘤细胞可以激活丝氨酸合成途径(serine synthesis pathway,SSP)生成丝氨酸。这两种途径使肿瘤细胞能获取足够的丝氨酸以维持自身最大的生长速率[3-4]。丙酮酸激酶M2(pyruvate kinase M2,PKM2)在肿瘤增殖时表达,当丝氨酸减少时,PKM2活性降低,糖酵解产生丙酮酸减少使更多的3-磷酸甘油酸(3-phosphoglycerate,3-PG)转化为丝氨酸[5]。甘油磷酸酯突变酶1在肿瘤中广泛上调,它能催化3-PG生成的2-磷酸甘油酸(2-PG),2-PG可以激活磷酸甘油酸脱氢酶(phosphoglycerate dehydrogenase,PHGDH)将3-PG从糖酵解转向丝氨酸合成[6]。有研究表明某些乳腺癌、胰腺癌和肺癌患者中PHGDH表达升高并且大部分表达升高的患者都表现出不良的预后[7-9]。哺乳动物同时具有细胞质丝氨酸羟甲基转移酶(serine hydroxymethyltransferase 1,SHMT1)和线粒体丝氨酸羟甲基转移酶(SHMT2)[10],在大部分快速增殖的细胞中,丝氨酸主要是由SHMT2催化产生一碳单位,并以甲酸的形式进入细胞质中参与核苷酸的合成。在SHMT2缺失的细胞系中,它们能通过SHMT1分解代谢丝氨酸来支持胸苷酸和嘧啶的合成[11]。
甘氨酸可以通过甘氨酸裂解系统产生一碳单位。甘氨酸在甘氨酸脱羧酶(glycine decarboxylase,GLDC)作用下裂解,并在氨甲基转移酶的作用下提供一个一碳单位进入叶酸循环,见图1[12]。有研究表明,线粒体中的甘氨酸合成与肿瘤的快速增殖存在密切联系,其机制可能是甘氨酸可直接参与嘌呤核苷酸的从头合成或者是提供一碳单位用于核苷酸的合成以及细胞内的甲基化反应[13]。GLDC在非小细胞肺癌和卵巢癌等肿瘤中的表达异常升高。在肿瘤发生早期,GLDC的高表达通过促进一碳单位的生成用于核苷酸的合成从而促进肿瘤的发展[14]。组氨酸也是一碳单位的来源,它先代谢成亚胺甲基谷氨酸,在转化为谷氨酸的过程中,四氢叶酸(tetrahydrofolate,THF)接受一个亚胺甲基生成亚胺甲基-THF,而后除去铵离子变成亚甲基-THF。色氨酸则可通过犬尿酸途径代谢生成一碳单位[4]。在叶酸缺乏期间,胆碱是一碳单位的重要来源,胆碱代谢的中间产物甜菜碱、二甲基甘氨酸、肌氨酸,可以直接用于同型半胱氨酸的再甲基化和产生一碳单位[15]。
2 一碳单位的利用
2.1 叶酸循环
肿瘤细胞的快速增殖需要大量的核苷酸,一碳单位可通过叶酸循环产生嘌呤和胸苷酸[16]。叶酸循环可发生在线粒体或细胞质中,肿瘤中线粒体通路通常持续性地过表达,抑制线粒体途径后,10-甲酰-THF的减少会诱导细胞转而利用细胞质途径来产生和利用一碳单位[17]。在线粒体途径中,5,10-亚甲基-THF氧化的关键步骤可以由两个同工酶亚甲基四氢叶酸脱氢酶2(methylenetetrahydrofolate dehydrogenase 2,MTHFD2)和MTHFD2L(MTHFD2-like)催化,见图1。在一项比较19种不同肿瘤中1000多种酶的差异性表达的研究中发现MTHFD2是其中表达上调最多的酶[18]。在乳腺癌、肺癌和急性白血病等肿瘤中抑制MTHFD2的表达能够影响癌细胞的增殖[19-21]。虽然两种线粒体同工酶在正常细胞和肿瘤细胞中都有表达,但有研究表明MTHFD2L的表达在肿瘤细胞中并未显示出明显的上调,在抑制MTHFD2表达后,肿瘤细胞不会代偿性增加MTHFD2L的表达[22]。因此,在靶向肿瘤线粒体叶酸途径的治疗中应选择MTHFD2作为治疗靶点。
叶酸循环也能为细胞增殖提供所需的NAD(P)H和ATP。敲除MTHFD基因后发现无论是细胞质还是线粒体MTHFD同工酶的缺失,都会导致细胞NADPH/NADP(+)和还原型谷胱甘肽/氧化型谷胱甘肽比值的降低,从而降低细胞的抗氧化应激能力[23]。能量不足时,癌细胞通过丝氨酸分解代谢生成甘氨酸和甲酸盐,在此过程中,ADP在线粒体10-甲酰-THF合成酶的作用下转化为ATP。同时该途径可产生NADH,NADH可通过氧化磷酸化产生ATP[24]。
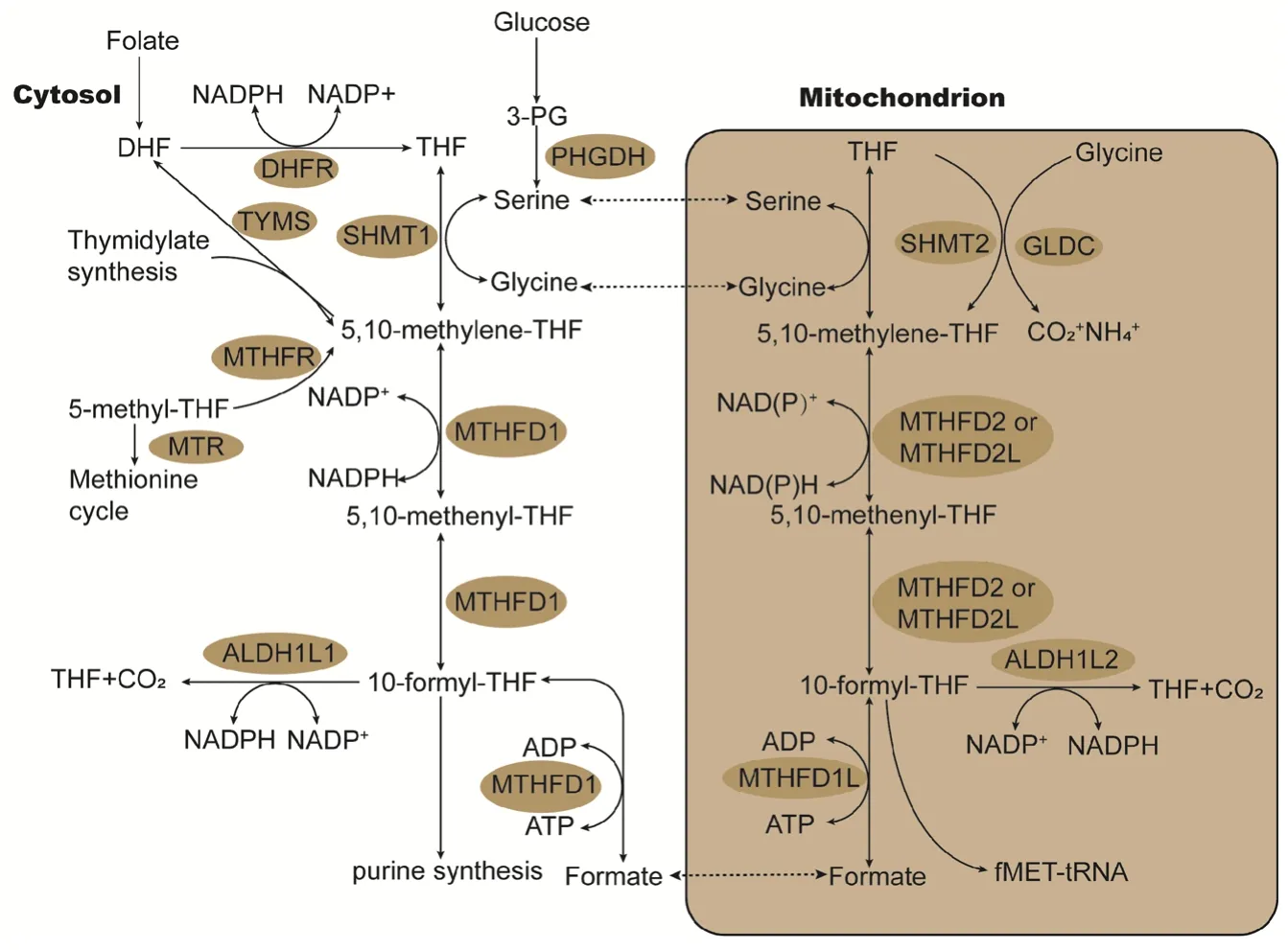
图1 叶酸循环Figure 1 Folate cycle
2.2 蛋氨酸循环
蛋氨酸循环中,一碳单位可用于同型半胱氨酸再甲基化重新生成蛋氨酸。蛋氨酸在甲硫氨酸腺苷基转移酶作用下产生S-腺苷蛋氨酸(sadenosylmethionine,SAM),而后在甲基转移酶的作用下将甲基基团转移到各种生物分子,包括蛋白质、核酸、脂质等[25],见图2。然而,当蛋氨酸充足时,肿瘤细胞不需要一碳代谢提供的一碳单位用于蛋氨酸的再生,但是有研究发现叶酸循环仍可通过提供ATP支持蛋氨酸向SAM的转化[26]。
甲基化状态的改变是由于甲基转移酶和去甲基化酶活性的差异造成的,SAM是这些酶主要的甲基供体,蛋白质、核苷酸、代谢产物的甲基化改变可导致癌症的发生。有研究发现,限制蛋氨酸的摄入可以影响SAM的水平和SAM/SAH比值,从而影响组蛋白甲基化水平,这种变化可以在重新补充蛋氨酸后完全恢复[27]。mTOR通路的异常激活可在大多数肿瘤中发现,有证据表明mTOR信号的激活能够通过影响丝氨酸和一碳代谢,从而调节DNA甲基化促进肿瘤发生[28]。肝脏激酶B1(liver kinase B1,LKB1)能直接激活与AMP-活化蛋白激酶相关的14个激酶家族,其中许多激酶与细胞的代谢重编程有关。有研究发现,LKB1缺失的细胞中有更多葡萄糖和谷氨酰胺代谢的中间产物进入一碳代谢通路中,使SAM产生增多导致DNA甲基化水平升高,提示LKB1缺乏的肿瘤可能对抑制DNA甲基化治疗更加敏感[29]。
2.3 转硫化途径
转硫化途径通过同型半胱氨酸与蛋氨酸循环相耦联,丝氨酸与同型半胱氨酸可在胱硫醚β合酶(cystathionine beta-synthase,CBS)作用下缩合生成胱硫醚,见图2。胱硫醚由胱硫醚裂解酶(cystathionine lyase,CGL)裂解来生成α酮丁酸和半胱氨酸。半胱氨酸可以用于谷胱甘肽合成和牛磺酸的代谢。谷胱甘肽是细胞中最丰富的代谢物之一,它可以通过清除和减少活性氧,维持适当的NADPH/NADP+比值来维持细胞的氧化还原平衡[13]。另外,半胱氨酸也可通过CBS和CGL脱硫生成硫化氢,硫化氢是一种气体信号分子,它可以硫化靶蛋白中反应性Cys残基,从而提高目标蛋白质的催化活性[30]。
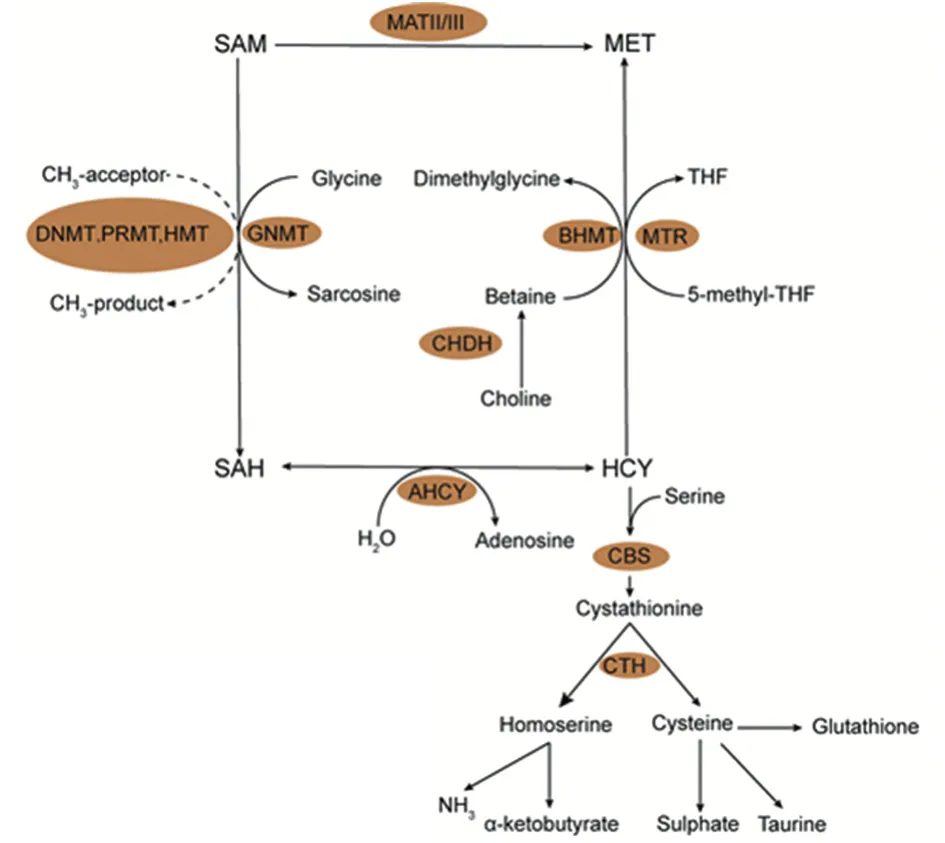
图2 蛋氨酸循环和转硫化途径Figure 2 Methionine cycle and transsulfuration pathway
3 一碳代谢与抗肿瘤治疗
3.1 营养素治疗
为了产生足够的一碳单位来满足自身的增殖需求,肿瘤细胞通常会增加对细胞外的丝氨酸、甘氨酸等原料的摄取,因此限制饮食中的丝氨酸、甘氨酸可能是一种良好的治疗策略。在小鼠移植瘤模型中,研究发现小鼠可以适应慢性的丝氨酸和甘氨酸的缺乏,并且肿瘤的体积减小,生存时间延长。在p53缺失的小鼠中肿瘤的体积减少更加显著,这可能是由于p53缺乏时,糖酵解和氧化磷酸化之间的转化受损,导致ATP生成不足[3]。另有研究表明,丝氨酸和甘氨酸的缺失增加了丝氨酸的从头合成和甘氨酸的代谢,这会降低谷胱甘肽的合成并增加活性氧水平[31],p53缺乏时,细胞不能增加谷胱甘肽的合成并且氧消耗增加,这都会使细胞氧化还原平衡受损[3]。提示限制饮食中的丝氨酸在治疗p53缺失肿瘤中可能具有更好的治疗效果。
二甲双胍被广泛应用于2型糖尿病的治疗,在实验模型中可以明显抑制肿瘤生长。有研究发现,在缺乏丝氨酸和甘氨酸饮食联合二甲双胍治疗的小鼠中,肿瘤的生长速度以及肿瘤的最终体积显著减小。其机制可能是丝氨酸的缺乏可以抑制二甲双胍诱导的糖酵解途径的代偿性增加[32]。也有研究表明,在缺乏丝氨酸的培养基中增加甘氨酸的量,能使SHMT介导的反应反向进行,降低NADPH/NADP+比值和细胞抗氧化应激能力,从而进一步损伤细胞[23]。在大肠癌肝转移中,增加饮食中的甘氨酸可通过减少肿瘤的微血管密度产生抗肿瘤作用[33]。叶酸是一种水溶性的B族维生素,叶酸摄入量不足可能会改变DNA甲基化,增加患癌症的风险。相反,补充叶酸可以预防幽门螺杆菌相关性胃癌[28],但也有研究显示,低叶酸摄入量能显著降低胃癌风险[34]。另外,Huang等研究表明,较高的维生素B6和胆碱摄入量可以降低胰腺癌的风险[35]。
3.2 靶向一碳代谢的酶
早在70余年前,Faber和他的同事发现叶酸可以刺激急性淋巴细胞白血病细胞的增殖,并使用氨基蝶呤诱导了患者的临床缓解。之后,更多靶向一碳代谢途径的药物被发现,例如甲氨蝶呤、5-氟尿嘧啶等。近年来,靶向一碳代谢的酶已经成为一种新型的抗肿瘤治疗策略。在SSP途径扩增的肿瘤中,如黑色素瘤、乳腺癌、结肠癌和肺癌,PHGDH是肿瘤细胞增殖和存活所必需的。在一种称为神经内分泌前列腺癌的高度致命的前列腺癌亚型中,有研究表明,抑制PHGDH能够减少体内肿瘤生长以及抑制前列腺癌细胞向神经内分泌前列腺癌细胞分化[36]。这表明PHGDH是癌症治疗的主要潜在靶点之一。有研究显示,使用PHGDH抑制剂NCT-502、NCT-503可以抑制细胞培养中依赖PHGDH的细胞系和原位异种移植瘤的生长,它不仅可以减少葡萄糖来源的丝氨酸产生,还能减少细胞利用一碳单位合成核苷酸,这是因为抑制SSP途径会增加SHMT1的活性使部分一碳单位用于丝氨酸的生成[37]。
SHMT2和MTHFD2是肿瘤中最稳定的过表达酶,为了抑制肿瘤细胞利用丝氨酸产生一碳单位,需要同时抑制SHMT1和SHMT2,在Ras基因突变的结肠癌细胞中敲除SHMT1和SHMT2可以抑制异种移植物的形成。虽然SHMT1和SHMT2的联合抑制剂,如SHIN1在细胞实验中已被证实具有良好的稳定性,但是由于它在生物体内可被快速清除而不能有效的使用[10]。MTHFD2是肿瘤和正常细胞中表达差异最大的酶,在人类移植瘤和小鼠白血病模型中,抑制MTHFD2可降低白血病的肿瘤负荷,延长生存期[21]。肿瘤的干细胞样特性与肿瘤的复发和耐药性有关,有研究发现,在对吉非替尼产生耐药性的肺癌细胞中,MTHFD2介导的线粒体一碳代谢可通过影响β-连环素途径来维持肿瘤的干细胞样特性并可通过消耗5-氨基咪唑羧胺核糖核苷酸产生耐药性[19]。因此,在MTHFD2表达升高的肿瘤中靶向MTHFD2的治疗可能可以根治肿瘤,防止复发。在MCF-7细胞中,MTHFD2的缺失使细胞通过丝氨酸产生甘氨酸途径受损,这时细胞主要依靠胞外途径获得甘氨酸[38],提示抑制MTDHF2联合饮食中甘氨酸的控制可能是一种较好的治疗策略。
3.3 调节甲基化
肿瘤的表观遗传状态改变是一个研究热点,靶向组蛋白和DNA翻译后修饰的酶的几种药物正在进行临床前评估和早期临床试验。其中包括甲基转移酶抑制剂,它可以抑制SAM介导的组蛋白和DNA的甲基化改变细胞的表观遗传状态[39]。目前已经有多种药物被FDA批准用于临床,其中包括阿扎胞苷和地西他滨。地西他滨可与DNA结合,而阿扎胞苷与RNA和DNA结合,从而抑制DNA甲基转移酶[40]。SGI-110(guadecitabine)是地西他滨的前药形式,是一种小分子DNA甲基化抑制剂,相比于目前的一些核苷类似物,它的性质更加稳定。在小鼠卵巢癌模型中,SGI-110可以增加顺铂化疗的敏感度,对于铂类耐药的卵巢癌患者,SGI-110的联合治疗可能会有较好的疗效[41]。另外,组蛋白乙酰化修饰在表观遗传学调控中起着关键作用,并受组蛋白去乙酰化酶和组蛋白乙酰转移酶调控,组蛋白去乙酰化酶在多种癌症类型中过度表达,可以通过抑制组蛋白去乙酰化酶进行抗肿瘤治疗[42]。
4 总结
随着对肿瘤细胞中一碳单位的产生与利用的改变更深入的探究,多种抗肿瘤治疗方法被提出,包括营养素治疗,靶向一碳代谢相关途径的酶等,但仍有很多问题亟待解决,例如营养治疗中,减少丝氨酸的摄入对于SSP途径扩增的肿瘤效果可能并不明显。靶向一碳代谢途径的酶时,由于很多代谢酶具有不同的亚型,不同亚型的酶结构高度相似,因此会导致药物选择性不佳而引起潜在的不良反应。靶向特定亚型的代谢酶可能会引起其他亚型的代偿性激活,例如抑制MTHFD2后,MTHFD1可以代偿性的激活[17]。总之,靶向一碳代谢途径的抗肿瘤治疗仍存在许多难点,需要进一步的研究。
